文献解读|Nat Commun(14.7):地塞米松对重症 COVID-19 患者的肺部和全身影响不同
✦ +
+
论文ID
原名:Distinct pulmonary and systemic effects of dexamethasone in severe COVID-19
译名:地塞米松对重症 COVID-19 患者的肺部和全身影响不同
期刊:Nature Communications
影响因子:14.7
发表时间:2024.06.28
DOI号:10.1038/s41467-024-49756-2
背 景
临床试验表明,中等剂量的皮质类固醇(包括地塞米松)可降低重症 COVID-19 患者的死亡率。相反,而较高剂量的地塞米松可能会增加低氧血症、无通气患者的死亡率。虽然对 COVID-19 患者进行类固醇随机对照试验已经改变了临床实践,但皮质类固醇对这些患者的细胞和区室特异性作用尚不清楚。
实验设计
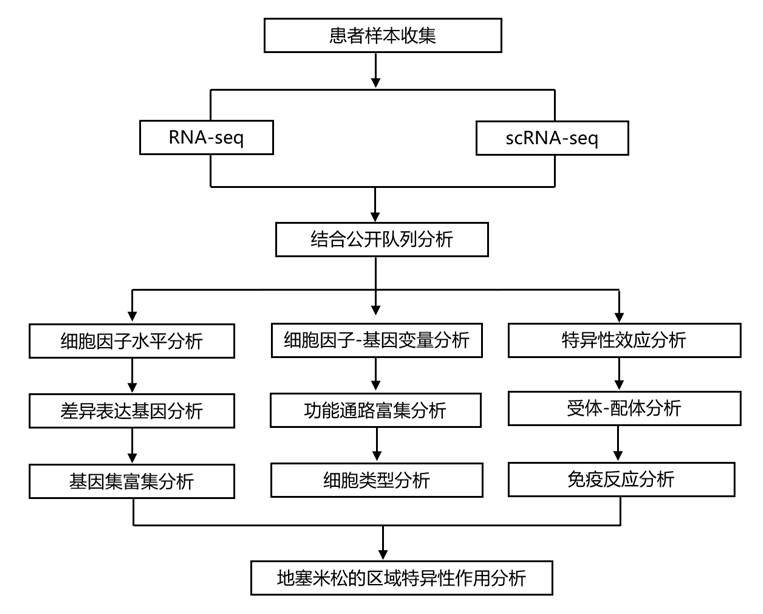
结 果
01
地塞米松调节重症 COVID-19 患者血液样本中的细胞因子和免疫细胞基因表达
本项研究对两所医院[加州大学旧金山医学中心 (UCSFMC) 和扎克伯格旧金山总医院 (ZSFG)]患有 COVID-19 急性呼吸窘迫综合征 (ARDS) 的使用呼吸机的成年人(年龄 ≥ 18 岁)进行了一项前瞻性队列研究。患者从 2020 年 4 月纳入观察队列,在 2020 年 7 月 RECOVERY 试验公布之前,这两个机构的患者并未常规接受 COVID-19 ARDS 皮质类固醇治疗,而当时地塞米松作为重症 COVID-19 住院患者的治疗手段。研究团队间采集了患者的气管抽吸物 (TA)和外周血样本(PBMC)进行多组学分析(图 1a-b),这些样本来源于接受地塞米松 (Dex)治疗的患者和未接受地塞米松 (NoDex) 治疗的患者。
与 NoDex 患者相比,Dex 患者的血浆 IL-6 和 IFN-γ 明显降低(图1c)。但是,Dex 患者中,IL-10(一种抑制炎症反应的细胞因子)的水平明显较高(图1c),其他细胞因子在各治疗组中没有表现出显著差异。
然后,他们比较了 Dex和 NoDex组之间的外周血基因表达,发现了 4050 个差异表达基因(DEG)(图 1d)。参与 T 细胞共刺激的免疫基因(例如TNFRSF4)和参与 T-/B- 和 NK 细胞活化的IL21R,以及参与过敏反应的几个基因(MS4A2,PTGDR2)在 Dex 患者中下调。在 Dex 患者中上调的基因包括ADAMTS2,一种由 TGF-β 上调的前胶原 N-内切肽酶,据报道由糖皮质激素上调,以及RLN3,参与对 DNA 损伤和修复的反应。基因集富集分析 (GSEA) 确定了 21 条显著失调的通路(图 S3),Dex 患者中最富集的通路包括三羧酸循环和几种线粒体相关通路、防御病原体和干扰素信号传导。相反,NoDex 患者的基因表达特征与感觉转导通路的富集一致,可能与白细胞群体的差异有关,以及与成纤维细胞生长因子受体 (FGFR) 和 G 蛋白偶联受体 (GPCR) 等细胞存活相关通路的激活有关。
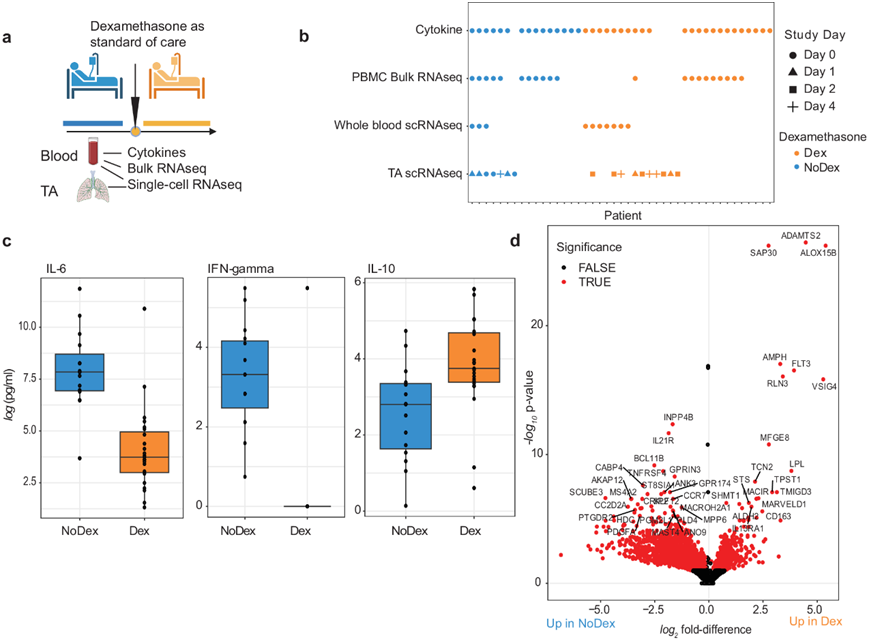
图1. 地塞米松调节 COVID-19 患者血液中的细胞因子和免疫细胞基因表达。
(a)实验流程图。(b) 每个分析包括的患者和时间点。(c)重要细胞因子IL-6、IL-10和干扰素γ (IFN- gamma)的对数转换。(d) 用DESeq2绘制差异表达基因的火山图。

图S3. 基因集富集分析。
02
血液转录组和血浆细胞因子数据的监督整合分析确定了对地塞米松的共同变化反应
接下来,他们使用了 DIABLO(一种偏最小二乘判别分析),来识别基于地塞米松治疗分层的模态之间共有的成分(“变量”),目的是鉴定基因表达和蛋白质水平之间的协变关系。Variate 1(变量 1) 清楚地将 Dex 与 NoDex 患者区分开来(图 2a)。
在分析细胞因子数据对变量1的贡献时,发现Dex患者根据以下特征可区分:较低的IP-10水平(参与干扰素γ信号传导);较低的炎性细胞因子IL-6和IL-18水平;较低的ICAM-1水平(参与炎症和白细胞募集);以及较低的Ang-2水平(一种促进血管生成并与Ang-1对抗的因子)。相反,Dex患者表现出较高的Ang-1水平以及较高的蛋白C和IL-10水平,在单峰分析中观察到的减弱的促炎性细胞因子信号传导(图 2b)。
与NoDex患者相比,Dex患者在先天免疫反应和细胞因子信号传导通路上相对升高(图2c)。DIABLO揭示的协变关系显示,循环细胞因子中的炎症反应减少,而外周血基因表达中的炎症反应增加。在Dex患者中,涉及病原体防御以及干扰素信号传导的通路富集,这与外周血基因表达分析结果一致。此外,变量1所代表的基因表达变化与转录调控的改变有关,特别是与表观遗传相关过程有关。
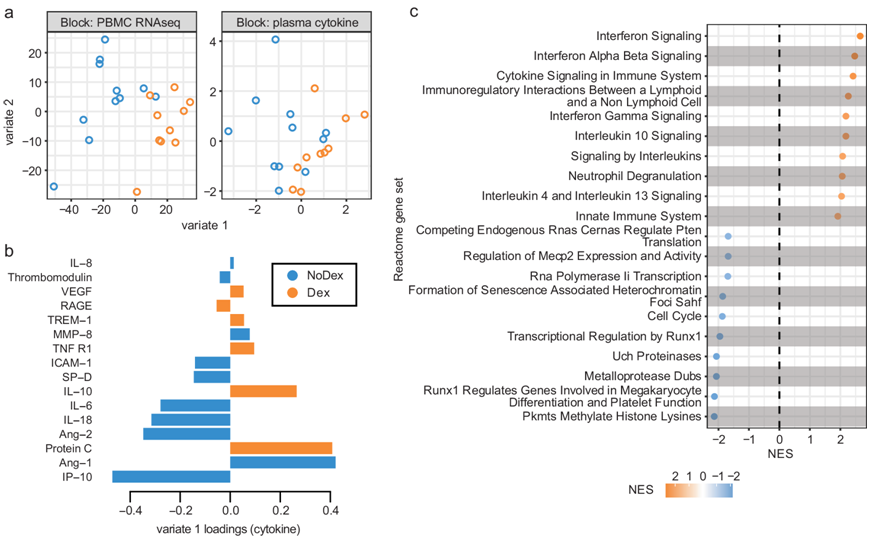
图2. 血液转录组和血浆细胞因子数据的监督整合分析捕捉了地塞米松对免疫细胞通路和调节剂的共同变化影响。
(a) 使用 DIABLO 对比较 Dex 和 NoDex 的患者的血浆细胞因子(17 种细胞因子变量)和PBMC RNA-seq(500 个基因变量)数据(配对)进行综合分析。(b) 细胞因子对 DIABLO 变量 1 的贡献。(c) 基因集富集分析。
03
单细胞分析揭示了地塞米松对肺部和血液中的免疫细胞的不同影响,这些影响可以在外部数据集中重现
为了比较地塞米松治疗的全身和组织特异性效果,他们检测了7 名 Dex 和 3 名 NoDex 患者的全血 (WB) 单细胞转录组(scRNA-seq)数据,以及 10 名 Dex 和 7 名 NoDex 患者的 TA scRNA-seq 数据(图 3a-b),使用单个数据处理流程对齐、协调和聚类数据并识别来自两个区域的细胞类型(图 3c-d),以及发现了地塞米松引发的细胞特异性效果(图 3e-f)。他们确定了与地塞米松相关的共有和区室特异性差异基因表达(图 3g-h,图 S4),不同区室之间最一致的是中性粒细胞差异基因表达(图 3g)。Dex 受试者的肺和血液中中性粒细胞中 S100A 家族促炎基因的表达下降。相反,T 细胞亚群的基因表达水平在不同区室之间不一致。CD4 和 CD8 T 细胞在不同解剖部位中显著的差异表达基因是 FKBP5,它是糖皮质激素受体活性的典型转录组标记物。
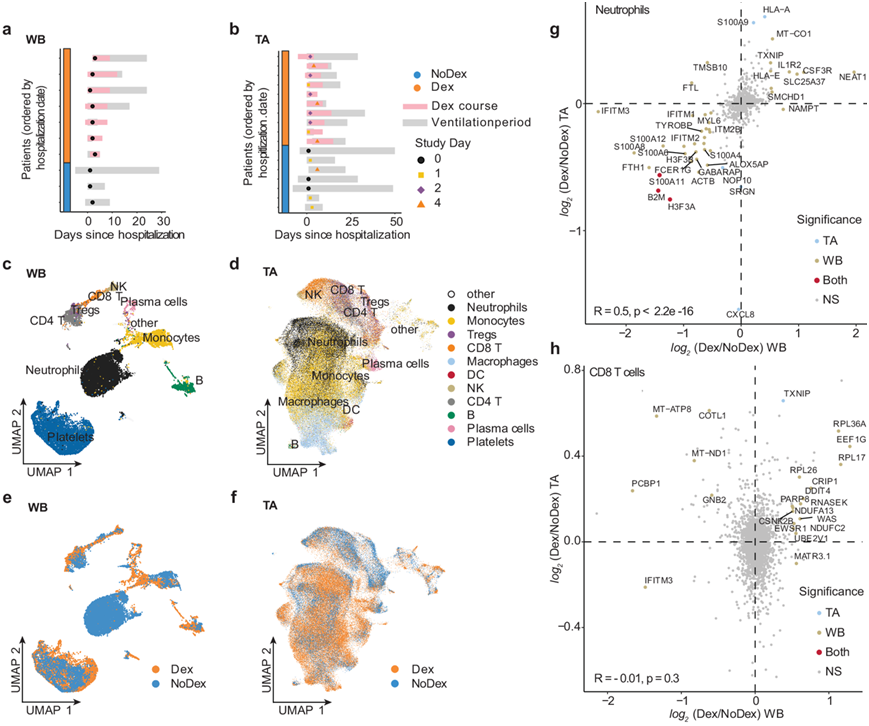
图3. 接受或未接受地塞米松治疗的患者的肺和外周血样本的单细胞分析。
(a-b) 绘制每个患者全血 (WB)或气管抽吸物 (TA) 样本的收集情况。(c-f) UAMP可视化。(g-h) Dex 和 NoDex 基因表达的差异倍数分析。
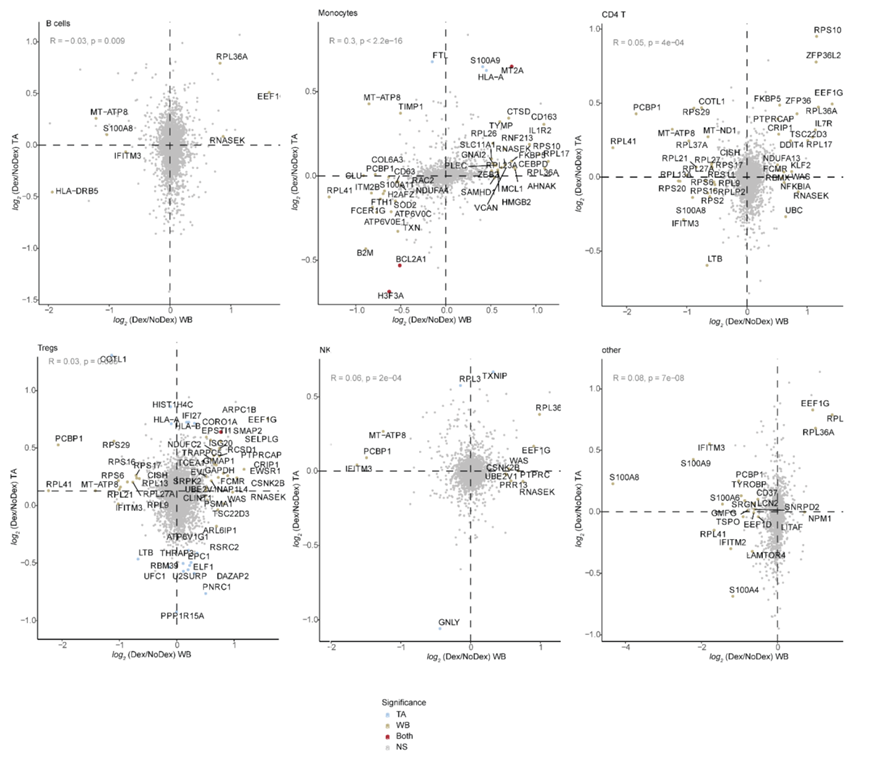
图S4. 跨组织差异表达基因分析。
为了评估地塞米松的作用是否在数据集之间可重复,他们分析血液数据集和肺数据集(图4a-b,图S6)。在血液数据集中,他们观察到 Dex 患者的中性粒细胞中的先天免疫信号传导和脱颗粒减少,单核细胞中淋巴细胞和非淋巴细胞之间的免疫调节相互作用减少。两个血液数据集均显示 Dex 患者 B 细胞的适应性免疫反应和共刺激减少,以及 CD4 和 CD8 T 细胞中细胞反应水平以及与传染病和流感反应相关的通路降低。有趣的是,与中性粒细胞和 CD8 T 细胞的观察结果相比,B 细胞、CD4 T 细胞和单核细胞中的反应在方向上与这些途径中恢复到健康对照水平一致(图 4a)。
相反,在检测本项研究的肺部数据集时,观察到了可重复但通常与血液中观察到的不一致的效应,最突出的是 Dex 患者 T 细胞亚群和 NK 细胞中流感相关基因的干扰素信号和反应升高,而在血液单细胞数据集中未观察到干扰素或流感信号(图 4b)。如预期的那样,健康对照组的干扰素信号低于 COVID-19 患者。不一致的效应还包括与 CD4 T 细胞的翻译和细胞对饥饿的反应相关的通路,在 Dex 患者的肺部中似乎较高,但在血液中较低。
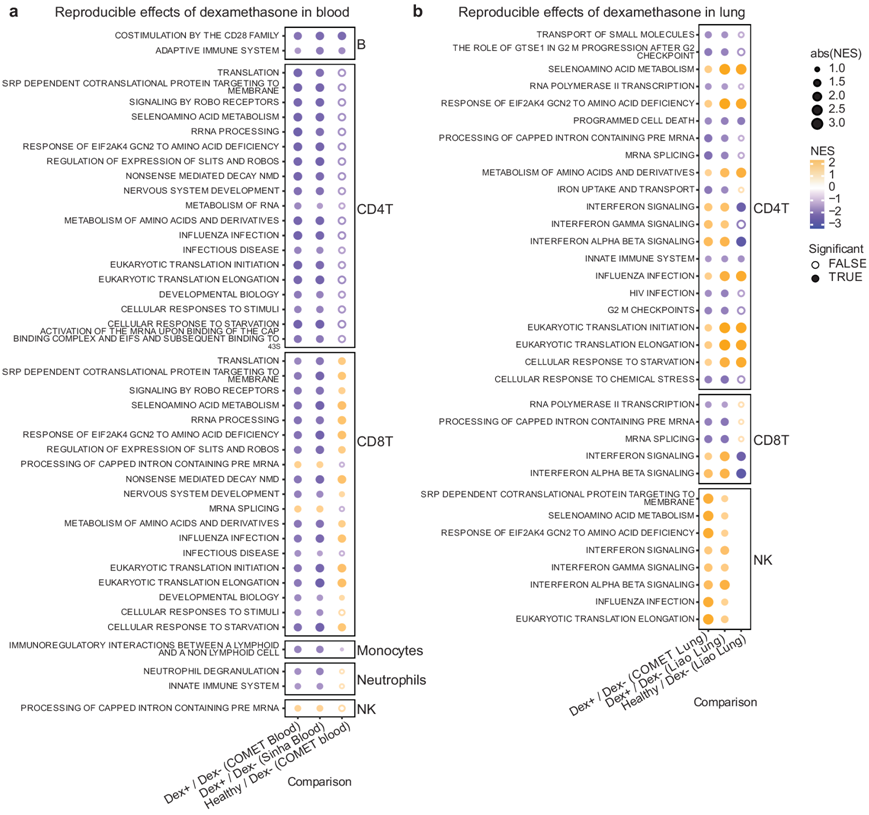
图4. 地塞米松对肺和外周血中细胞类型特异性基因表达具有不一致的影响。
(a-b) 按细胞类型划分的血液和肺中基因集富集分析的净富集得分。
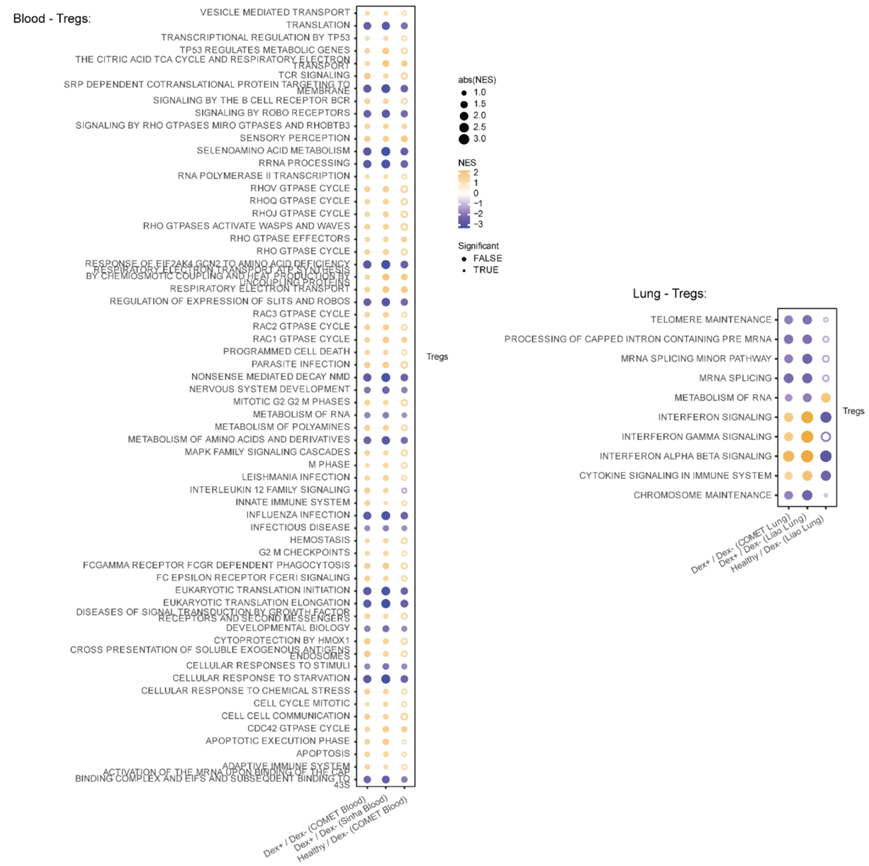
图S6. 血液和肺中Tregs基因集富集。
04
地塞米松对组织损伤消退和抗原呈递和 T 细胞反应的抑制有影响
他们使用 CellChat分析了配体-受体通讯,还比较了 COMET 研究患者(血液和 TA)和 公开数据中 Dex 和 NoDex 受试者之间的细胞间信号传导。在 TA 中,CellChat 确定了在 Dex 和 NoDex 样本中活性不同的几种通路(图 5a)。地塞米松与 MHC-II 信号显著减少有关(图 5b),这表明肺中抗原呈递给 CD4 细胞可能减少。此外,CellChat 发现 TA 中的 SELPLG 活性显著降低(图 5c),表明地塞米松可能通过这些机制在减少肺损伤方面发挥作用,因为先前的研究将 SELPLG 与小鼠肺损伤和人类非 COVID-19 ARDS 的较高风险联系起来。在血液中也观察到了类似的影响,但这种影响的幅度远小于 TA 样本,且统计上不显著。
检测到的相互作用的聚类热图将两个 NoDex COVID-19 数据集分组在一起,而两个 Dex COVID-19 数据集彼此分组并与健康对照数据集区分开,表明地塞米松可能有助于恢复健康表型(图 5d)。胶原蛋白和膜联蛋白通路在 NoDex 患者中的活性更高,并且这些通路在 Dex 受试者中的活性与健康对照相当(图 5e)。此外,与 Dex 患者和健康对照相比,在 NoDex 患者中观察到 CD99、ICAM 和 ITGB2 升高(图 5e),这一发现可能表明地塞米松对抑制 T 细胞反应有作用,因为这些信号分子参与白细胞募集、T 细胞和抗原呈递细胞之间的免疫突触形成以及 T 细胞功能和活化。
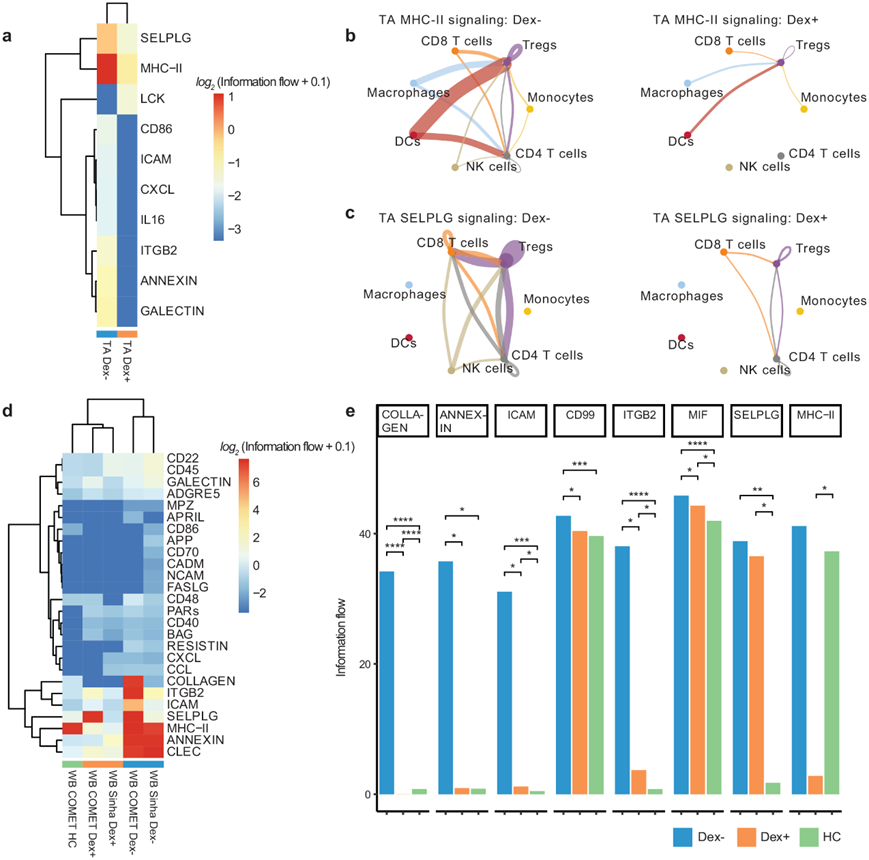
图5. 从单细胞转录组数据推断受体配体揭示了地塞米松引起的血液和肺中的炎症、抗原呈递和 T 细胞募集减少。
(a) 显示了 Dex和 NoDex患者的 TA 样本的 CellChat 结果的聚类热图。(b-c) MHC-II和 SELPLG 相互作用的细胞类型相互作用网络分析。(d) 血液样本的 CellChat 结果的聚类热图。(e) 在COMET 数据集中,Dex、NoDex 和健康对照者之间比较了一组显著检测到的受体-配体相互作用。
+ + + + + + + + + + +
结 论
本项研究发现地塞米松与 T 细胞活化相关的基因表达下降有关,包括TNFSFR4和IL21R,还发现几种免疫通路的表达下降,包括主要组织相容性复合体-II 信号转导、选择素 P 配体信号转导以及通过细胞间粘附分子和整合素激活进行的 T 细胞募集,表明这些是类固醇在 COVID-19 中治疗益处的潜在机制。本项研究确定了地塞米松作用的其他区域和细胞特异性差异,这些差异在公开可用的数据集中可重现,包括呼吸道中抗类固醇干扰素通路的表达,这可能是潜在的治疗靶点。
+ + + + +



 English
English


