文献解读|Sci Adv(13.6):转录和表观基因组分析确定 YAP 信号是肠上皮成熟的关键调节因子
✦ +
+
论文ID
原名:Transcriptional and epigenomic profiling identifies YAP signaling as a key regulator of intestinal epithelium maturation
译名:转录和表观基因组分析确定 YAP 信号是肠上皮成熟的关键调节因子
期刊:Science Advances
影响因子:13.6
发表时间:2023.07.12
DOI号:10.1126/sciadv.adf9460
背 景
胎儿肠道经历巨大的扩张和重塑,导致发育过程中形成初级绒毛和连续的绒毛间隙。绒毛形成后,上皮祖细胞产生功能明确的成体干细胞。尽管从胎儿肠道到成体肠道的转变过程中的组织学和形态学变化已有大量研究,这个过程如何在分子水平上协调仍然是未知的。
实验设计

结 果
01
胎儿和成体肠道类器官在转录上是不同的
在体外生长允许的条件下[即表皮生长因子(EGF)、Noggin 和 R-spondin1(ENR)],成体肠上皮干细胞自组织形成出芽类器官,而源自胎儿上皮的祖细胞则生长为囊性球体。为了表征胎儿祖细胞和成体干细胞之间的差异,研究者团队从胎儿 [胚胎日 (E)16.5] 和成体小鼠小肠近端部分获得 3D 培养物, 分别称为胎儿肠球(FEnS)和成体类器官(aOrg)(图1A)。建立的培养物用含有 CHIR99021 和烟酰胺 (ENR+ChNic) 的培养基进行短暂处理,以减少 aOrg 培养物中终末分化细胞类型的比例(图 1A)。
随后,他们使用基因表达帽分析 (CAGE) 研究了两个系统中转录起始位点 (TSS) 的全基因组活性,该技术允许同时分析 mRNA 和增强子 RNA (eRNA) 表达。根据 mRNA 水平,他们发现所有表达基因(11386 个基因)的 35% 在两个系统之间存在差异表达(图1B)。成体细胞中显著上调的基因包括成体肠干细胞的已知标记物,例如Olfm4、Ascl2、Cdx2、Gata4、Tcf4/Tcf7l2、Smoc2和Hopx,而胎儿特异性基因包括Sox17、Clu、Trop2 /Tacstd2、Cnx43/Gja1、Anxa1、Anxa3和Anxa6(图 1B)。
GO分析表明,FEnS中上调的mRNA在细胞表面受体信号传导、运动、发育和粘附通路中富集(图1C),而aOrg 中上调的基因大多富集于与代谢过程相关的通路中(图 1C)。
他们观察到体内和体外 E16.5 胎儿上皮和 FEnS以及成体隐窝细胞和 aOrg之间的基因表达存在显著相关性(图 1D)。此外,体内胎儿和成体特异性基因集分别在 FEnS 和 aOrg 特异性基因中显著富集(图 1E-F)。总之,这些表明,尽管培养条件和形态相似,但源自胎儿和成体上皮的 3D 培养物显示出不同的转录程序,反映了其原始发育状态。
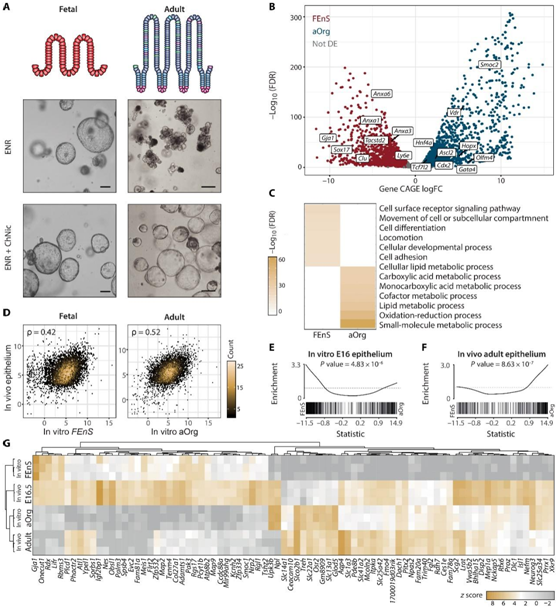
图1. 胎儿和成体肠道类器官培养物在转录上是不同的,并且概括了它们的体内对应物。
( A ) 胎儿 (E16.5) 和成体小肠上皮(顶部)及其各自的体外衍生物 (FEnS 和 aOrg) 维持在 ENR 和 ENR + ChNic (底部)中的示意图。(B) CAGE 差异表达分析的火山图聚合到 ENR+ ChNic 中维持的培养物的基因水平。(C) 与所有表达基因相比,FEnS 和 aOrg 特异性基因之间的富集分析。(D) 体内 E16.5 上皮与 E16.5 衍生的 FEnS(左)以及体内成体隐窝与体外 aOrg(右)的基因表达密度图。( E ) CAGE 数据中体内 E16.5 基因的基因集富集分析 (GSEA)。(F) CAGE 数据中体内成体隐窝基因的 GSEA,按 aOrg 与 FEnS 倍数差异排序。(G) 基因表达热图(前 50 个最可变基因),具有体内 E16.5 和成体上皮以及体外 FEnS 和 aOrg 的层次聚类。
02
胎儿和成体状态具有离散的增强子和启动子景观
为了探索转录差异背后的机制,他们接下来将 CAGE 测序数据与转座酶可及染色质分析和染色质可及性测序 (ATAC-seq) 相结合,来表征 FEnS 和 aOrg 中的增强子和启动子景观。
通过将开放染色质 ATAC 峰与活性 eRNA 或 mRNA CAGE 峰相交,定义了 13064 个候选增强子和 13325 个活性基因启动子(图 2A)。与没有 CAGE 信号的 ATAC-seq 峰相比,ENCODE 染色质免疫沉淀测序转录因子 (TF) 峰在增强子候选区域富集,表明这些是功能性元素。
FEnS 和 aOrg 之间注释启动子的差异表达分析显示,13325 个活性启动子中有 2374 个在 FEnS 中显著上调,在 aOrg 中显著上调 2597 个(图2B)。就eRNA表达而言,3240个已识别的增强子候选者在FEnS中上调,在aOrg中上调4063个(图2B)。
他们假设状态特异性增强子和启动子活性将反映染色质可及性的差异。增强子和启动子的 5'-C-磷酸-G-3' (CpG) 含量不同,这会影响染色质结构。启动子 CpG 密度的双峰分布,其中 CpG 稀疏启动子的峰值较小,其密度与增强子相当,而增强子的 CpG 密度往往较低(图 2C)。根据这一观察,他们将启动子分类为“CpG 稀疏”和“CpG 密集”。 值得注意的是,大多数 CpG 稀疏启动子在 FEnS 和 aOrg 之间差异表达,而只有 32%的 CpG 密集启动子显示差异表达(图 2D)。值得注意的是,CpG 稀疏启动子以及增强子的染色质可及性(ATAC 信号)的变化与基因表达 (CAGE) 的变化密切相关。相反,在 CpG 密集启动子处仅观察到弱相关性。并且在两种状态下的差异表达启动子处观察到高 ATAC 信号,与表达无关(图 2E)。具体而言,22% 的 FEnS 增强子和 29% 的成体特异性增强子在各自状态下表现出激活水平差异。
接下来,他们使用全基因组亚硫酸氢盐测序 (WGBS) 分析了 FEnS 和 aOrg 培养物之间 CpG 胞嘧啶甲基化的差异。他们观察到增强子和CpG稀疏启动子的表达与甲基化之间存在很强的负相关,而在富含CpG的启动子的表达与甲基化之间存在弱的负相关,这些启动子组成性低甲基化(图2F)。差异甲基化区域 (DMR) 分析显示,aOrg 中 155 个CpG 稀疏 aOrg 特异性启动子低甲基化,FEnS 中 288 个 FEnS 特异性启动子低甲基化。相比之下,在胎儿和成体状态下,分别只有 346 个和 264 个FEnS 和 aOrg 特异性 CpG 致密启动子是低甲基化。这些结果发现与 eRNA 表达状态相关的染色质可及性和 DNA 甲基化变化定义了每个发育阶段。
他们将原位脱氧核糖核酸酶 (DNase) Hi-C 与 DNA 甲基化分析结合起来进行研究这些大规模的染色质变化。在 500 kb 基因组上使用基于特征向量的方法,定义了 A 和 B 区室,并观察到总体染色质结构在两种状态之间基本保持不变(图 2G)。
虽然整体染色质结构基本没有变化(图2G),但某些区域确实在胎儿细胞和成体细胞之间转换了区室。具体来说,73 个区域从活跃区室移动到不活跃区室 (A FEnS → B aOrg),81 个区域显示出相反模式 (B FEnS → A aOrg),而其余 4787 个区域保持静止(FEnS 和 aOrg 中的 A 或 B)。值得注意的是,通过将 Hi-C 数据与 ATAC、WGBS 和 CAGE 表达数据集叠加,他们观察到这些少数大区室转变伴随着 CpG 甲基化水平和转录活性的变化(图 2H)。总的来说,A 区室中的 CpG 甲基化水平高于 B 区室,并且区室转变与甲基化水平的相应变化一致。
他们还发现A FEnS → B aOrg 过渡区域富集了FEnS 上调基因和增强子候选物,而aOrg 上调基因和增强子候选物富集在B FEnS → A aOrg 区域(图2I)。
尽管区室变化很少,但较小规模(100 kb 分辨率)的差异相互作用分析鉴定出 FEnS 和 aOrg 中相互作用强度显著不同的 3226 个区域,这与两种状态之间的启动子和增强子表达变化直接相关(图2J)。总之,这表明尽管大规模染色质结构得到保护,但较小规模的染色质重组与胎儿和成体状态下特定调控元件驱动的转录活性相关。
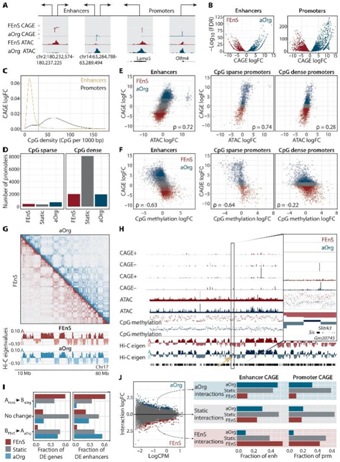
图2. 转录变化反映了不同水平染色质调控的差异。
(A) 定义为具有 CAGE 信号的 ATAC-seq 峰的典型增强子和启动子的示意图。(B) 增强子(左)和启动子(右)的 CAGE 差异表达。(C) 增强子中心(黄色)或启动子顶端(黑色)1-kb 窗口内 CpG 数量的分布。(D) 差异表达的 CpG 稀疏启动子和 CpG 密集启动的数量。(E)子处的 ATAC logFC 和 CAGE logFC 以及通过差异表达着色的 CpG 稀疏和密集启动子之间的相关性。(F) CpG 甲基化 logFC 和 CAGE logFC 之间的相关性。(G) 以chr17坐标为轴的代表性Hi-C相互作用热图。(H) 来自+和−链的 CAGE 信号、ATAC、CpG 甲基化、Hi-C PC1 的特征值以及沿 chr3 的 RefSeq 注释。(1) 差异表达基因和增强子在 A 或 B 区室中组成型,或 A FEnS ≥ B aOrg或 B FEnS ≥ A aOrg区室中的部分。(J) 右图:100 kb 之间的差异相互作用。左图:差异表达的增强子和启动子的分数与x轴上的差异相互作用箱重叠y轴上增强子和启动子的差异表达,按差异相互作用的方向划分。
03
不同的 TF 与特定阶段的染色质变化相关
鉴于谱系特异性转录因子作为细胞身份主要决定因素的明确作用,他们推断基因表达的差异可能与阶段特异性转录因子的活性相关,发现 FEnS 和 aOrg 中分别有 159 和 144 个 TF 显著上调(图3A),其中包括先前描述的在胎儿和成体肠道中的细胞身份中发挥作用的转录因子,分别为 SOX17 和 GATA4(图3A)。这些差异表达的 TF 的预测结合位点富含阶段特异性增强子和启动子。例如FEnS 启动子和增强子富含与激活蛋白 1 (AP1)、转录增强关联结构域 (TEAD)、SRY 相关 HMG 盒 (SOX) 和核因子 kappa B (NFKB) TF 家族相关的基序,而 aOrg增强子和启动子显示出HNF4A、PPARG、CDX2和GATA4结合位点的富集(图3B)。
通过 TFBS 富集,他们发现不同的 TFBS 在差异甲基化 (WGBS) 或 ATAC的增强子处富集。染色质相互作用和区室定位的阶段特异性增强子也显示出特定 TF 类别的富集,尽管这些增强子与差异甲基化和可及区域中富集的增强子不同(图 3C)。这一观察结果与以下观察结果一致:可及性的变化最常与甲基化的变化同时发生,但很少与相互作用或区室化的变化同时发生(图3D-E)。
无论调节模式如何,FEnS 和 aOrg 特异性增强子都显示出对不同类别 TFBS 的富集(图 3C)。值得注意的是,特定类别的 TFBS 在具有差异甲基化和可及性状态的增强子处以及在具有差异 3D 相互作用和区室定位的增强子处富集(图 3C)。TEAD(TEAD2 和 TEAD4)基序是一个例外,它们在 FEnS 特异性增强子上持续富集,显示出局部可及和甲基化的变化,以及显示出差异染色质相互作用和区室激活的增强子(即 A FEnS → B aOrg)或 B FEnS → A aOrg 区域)(图 3C)。总之,这些分析表明胎儿祖细胞和成体干细胞受到不同基因调控网络的调控,这些网络激活不同的增强子景观,并且 TEAD 介导的转录活性可能是胎儿特异性转录程序的主要决定因素。
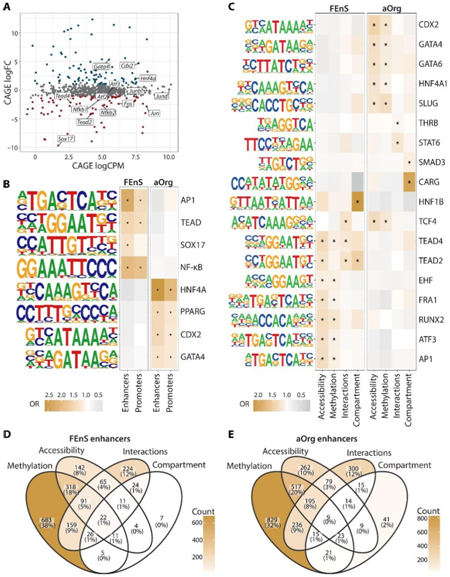
图3. 不同的转录因子网络驱动胎儿和成体状态特异性启动子和增强子活性。
(A) TF 基因水平聚合 CAGE 表达 log 2 CPM 超过 log 2 FC 的 MA 图。(B) 增强子和启动子处的转录因子结合位点 (TFBS) 富集。(C) 与所有状态特异性增强子相比,差异甲基化、可接近、相互作用或区室转换增强子的 TFBS 富集。(D-E) 维恩图描绘了 FEnS和 aOrg特异性增强子之间差异甲基化 (WGBS)、可及性 (ATAC)、相互作用 (Hi-C) 和区室状态 (Hi-C) 的重叠。
04
胎儿祖细胞由持续高水平的 YAP 活性维持
他们发现 FEnS 特异性转录组高度富集与肠上皮细胞中 YAP 激活相关的转录特征(图 4A),并表达高水平的 YAP 靶基因Ankrd1、Ctgf、Cyr61、Clu和Tnfrsf12a(图 4B)。此外,图像分析证实,与 aOrg 相比,FEnS 中的核YAP 水平(活性)较高(图 4C-D)。为了对 YAP 活性进行功能测试,他们接下来用维替泊芬(verteporfin)(一种常用的 YAP-TEAD 相互作用和介导转录抑制剂)处理胎儿和成体来源的培养物。使用重铺实验,确实观察到 FEnS 的生长受到抑制剂的影响更强烈,表明胎儿细胞比成体细胞更依赖 YAP 活性(图 4E-F)。为了排除维替泊芬的潜在脱靶,他们还测试了两种独立的、高选择性的TEAD抑制剂——MGH-CP1和TED-347,并观察到对胎儿细胞复制效率的选择性影响(图4E-F)。
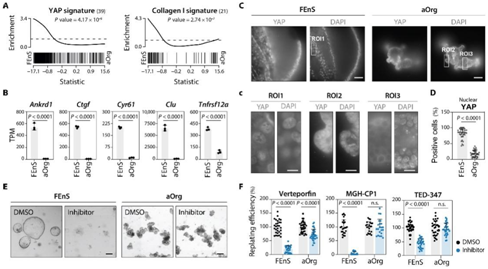
图4. 胎儿细胞是由持续高水平的YAP活性维持的。
(A) GSEA 显示活性 YAP 相关基因特征的富集。(B) 条形图描绘 FEnS 和 aOrg 培养物(ENR 培养基)中直接 YAP 靶基因的 mRNA 表达水平。(C) 免疫荧光分析显示 YAP 在 ENR 培养基中生长的 FEnS 和 aOrg 中的亚细胞定位。(D) 条形图显示具有高 YAP 核信号的细胞百分比。(E) 用 YAP 信号抑制剂处理的 FEnS 和 aOrg 培养物的代表性相差图像。(F) 条形图描绘了用所示抑制剂处理后的重新铺板效率。
为了测试高 YAP 活性是否足以诱导转化为胎儿状态,他们接下来从可诱导的 TetON-hYAP/H2B-mCherry 小鼠品系中获得成年培养物,其中添加强力霉素 (DOX) 诱导表达组成型活性(S127A 突变体)YAP 转基因。使用该系统,他们发现分裂时诱导 YAP 导致 aOrg 生长为囊状、胎儿样圆形结构,表达高水平的胎儿特异性细胞表面标记物 SCA1(图 5A-B)。在转录方面,YAP 过度表达导致各种成体干细胞和分化标记物的下调以及胎儿特异性基因特征的整体上调(图 5C-E)。然而,尽管形态和转录与FEnS相似(图5D-E),但aOrg不能在含有DOX的ENR培养基中长期维持,表明单独的YAP激活不足以驱动完全转变为自我维持的胎儿状态。
为了研究激活的 YAP aOrgs 与胎儿细胞有何不同,他们接下来将未处理和 DOX 处理的 aOrg 之间差异表达的基因与 FEnS 和 aOrg (−DOX) 之间差异表达的基因进行比较,发现,2342 个 FEnS 特异性基因中的 850 个在 DOX 诱导后在 aOrg 中上调(图 5F)。
最后,他们对胎儿和成体类器官进行了单细胞转录组分析(scRNA-seq),发现标准 ENR 培养基中胎儿培养物中的一小部分细胞自发成熟为成体样细胞(聚类 11 和 12)(图 5G)。这些“成熟”细胞聚类的总体特征是 FEnS 特异性特征下调,同时 aOrg 特征上调。虽然 YAP 相关基因在大多数胎儿细胞中高度表达,但成熟细胞聚类的特征富集度也低得多,这表明成熟过程需要 YAP 活性的降低(图 5H-h)。

图5. 在aOrg培养中,YAP的激活诱导胎儿样特征。
(A) 左图为 ENR 培养基中存在或不存在 DOX (±DOX) 的 TetON-YAP aOrg 培养物的代表性图像。右侧的条形图描绘了类器官圆形度的量化。(B) 通过流式细胞术分析 tetON-YAP aOrg 培养物中的 SCA1 蛋白表达。(C) 火山图显示 DOX 处理后差异表达的基因。(D) 根据 ENR 培养基中 FEnS 和 TetON-YAP aOrg (±DOX) 培养物的 RNA-seq 分析数据进行主成分分析 (PCA)。(E)维恩图描绘了FEnS(相对于aOrg-DOX)和aOrg+DOX(相对于aOrg-DOX)培养物中共享上调基因的分数。(F) GSEA 显示 YAP 诱导 (+DOX) 后 FEnS 相关基因特征的富集。(G) 来自 FEnS 和 aOrg 培养物的单细胞的均匀流形近似和投影 (UMAP) 可视化。(H) YAP 相关基因特征的平均表达覆盖在 UMAP 细胞类型图上。(h) 小提琴图描绘了每个细胞类型聚类中 YAP 特征的富集。
05
差异 YAP 活性水平与 ECM 基因的差异表达相关
鉴于 YAP 作为机械反应因子的作用,他们推测细胞外基质(ECM)成分的差异表达可能是其在胎儿和成体细胞中不同激活水平的基础。一致地,他们发现胎儿特异性基因在与细胞粘附和细胞表面受体相关的基因中高度富集(图1C)。在这些基因中,各种层粘连蛋白亚基、胶原蛋白和纤连蛋白在体外和体内的胎儿细胞中均以更高水平表达(图 6A-B)。胎儿培养物显示出对 FAK 和 SRC 抑制剂的敏感性增加(图 6C-D),从而证实了维持胎儿细胞所需的活性 YAP 和上游信号通路。
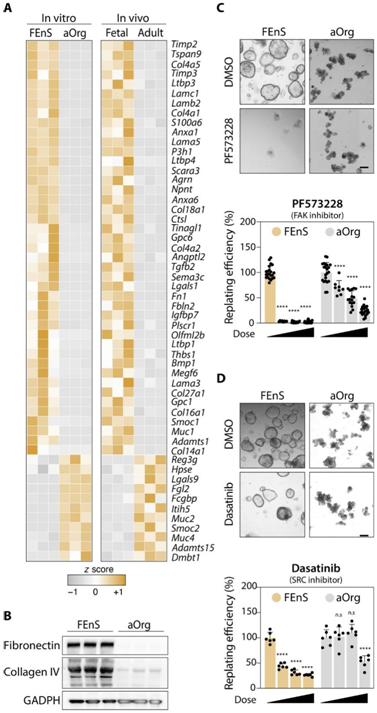
图6. FEnS 和 aOrg 表达不同的 ECM 基因。
(A) ECM 基因 (GO: 0031012 - ECM) mRNA 表达水平的热图。(B) FEnS 和 aOrg 中 ECM 蛋白纤连蛋白和 IV 型胶原蛋白的蛋白质印迹分析。(C-D) 用 FAK和 SRC激酶的抑制剂处理的 FEnS 和 aOrg 培养物的重复实验。
+ + + + + + + + + + +
结 论
本项研究利用肠道类器官培养来分析胎儿和成体上皮细胞的转录、染色质可及性、DNA 甲基化和3D染色质构象景观,观察到基因表达和增强子活性的显著差异,伴随着两种细胞状态之间 3D 组织、DNA 可及性和甲基化的局部变化。使用综合分析,他们发现持续的升高YAP转录活性是未成熟胎儿状态所必需的。YAP 相关转录网络在染色质组织的各个层面受到调节,并且可能通过细胞外基质组成的变化进行协调。总之,本项研究确定了ECM成分表达的变化和 YAP1 信号传导的激活作为胎儿到产后过渡的调节机制。
+ + + + +



 English
English


