文献解读|Nat Microbiol(28.3):生命早期多种微量营养素缺乏导致小鼠肠道微生物组和内在抗生素耐药性基因的多界改变
✦ +
+
论文ID
原名:Multiple micronutrient deficiencies in early life cause multi-kingdom alterations in the gut microbiome and intrinsic antibiotic resistance genes in mice
译名:生命早期多种微量营养素缺乏导致小鼠肠道微生物组和内在抗生素耐药性基因的多界改变
期刊:Nature Microbiology
影响因子:28.3
发表时间:2023.11.16
DOI号:10.1038/s41564-023-01519-3
背 景
在全球范围内,约3.4亿儿童患有多种微量营养素缺乏症,并伴有高致病性负担和多重耐药细菌导致的死亡。微生物组是抗菌素耐药性(AMR)的储存库,但营养不良对抵抗组的影响尚不清楚。
实验设计
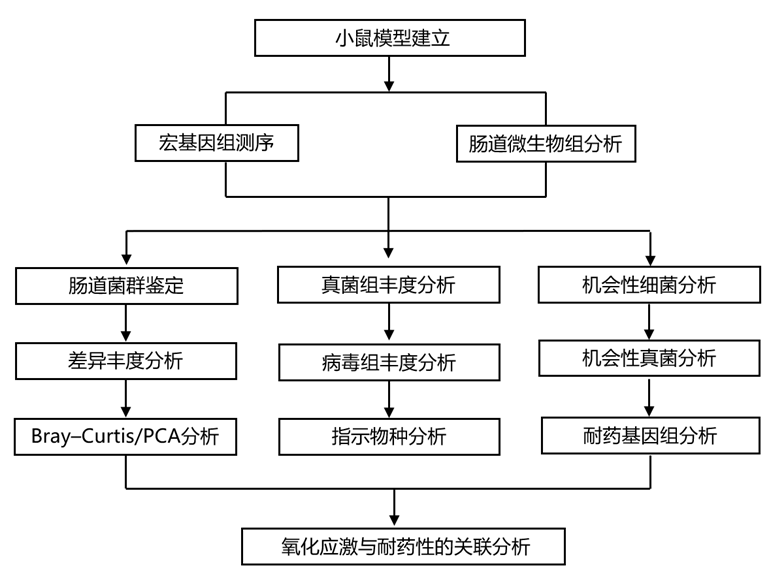
结 果
01
微量营养素缺乏会重塑肠道细菌群落
在本项研究中,断奶期C57BL/6N雄性小鼠分别饲喂等热量实验对照或多种微量营养素缺乏(即低锌、低叶酸、低铁、低维生素A和低B12)日粮28天(d)。实验结束时,与对照组(CON)相比,低微量营养素(LM)饮食组的小鼠体重增加较少,发育迟缓和贫血。食物摄取量无显著差异。研究者团队使用宏基因组测序来表征饮食治疗前后的肠道微生物组。通过MaAsLin2平台进行的差异丰度分析显示,在低微量营养素饮食的影响下,早期肠道微生物群落结构存在显著差异。在第28天,观察到LM小鼠的变形菌门、肠杆菌科和Tannerellaceae 的增加,而CON组的厚壁菌和丹毒杆菌的增加(图S1a,图1a-b)。在第28天,他们观察到LM小鼠中克雷伯氏菌、粪杆菌属、丹毒杆菌属、副杆菌属、肠杆菌属和蓝杆菌属的相对丰度较高,而Lachnoclostridium、Muribaculum和liilactobacillus属的相对丰度下降。他们还观察到Faecalibaculum属的增加,而liilactobacillus和Lachnoclostridium在小鼠中减少;相反,克雷伯氏菌、肠闭菌、Muribaculum和Blautia减少(图S1b)。在第28天,LM小鼠中克雷伯氏菌、粪杆菌属、丹毒杆菌属、副杆菌属、肠杆菌属和蓝杆菌属的相对丰度较高,而Lachnoclostridium、Muribaculum和liilactobacillus属的相对丰度下降。物种水平的分辨率显示,LM小鼠中粪足杆菌(Faecalibaculum rodentium)的丰度增加,而黏液芽胞杆菌(liilactobacillus murinus)、Muribaculum gordoncarteri、和其他未分类的芽胞杆菌(Lachnoclostridium sp. YL32)的丰度减少。无毒梭菌(Clostridium)、Enterocloster bolteae、金斯坦副杆菌(Parabobacterides goldstein)和Blautia producta在LM中也明显富集,而Lachnoclostridium sp. YL32在CON小鼠中丰度较高,Enterocloster boltae和Muribaculum gordoncarteri丰度减少(图S1c)。
在两个组中,每只小鼠在所有水平上的这些分类学变化是一致的(图1c)。实验结束时,LM小鼠的Shannon α多样性较高(图1d)。基于Bray -Curtis的主成分分析(PCA)图显示CON和LM小鼠在基线(第0天)时的微生物群聚集,但在饮食处理后观察到组间存在明显差异(图1e)。实验结束时,LM组每克肠杆菌科菌落形成单位(cfu)增加,第0天各组间无差异(图1f)。
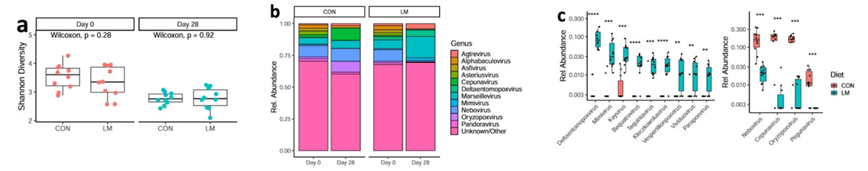
图S1.肠道病毒组在生命早期会因微量营养素缺乏而发生改变。
(a)第0天和第28天各时间点病毒体Shannon α多样性。(b)第0天和第28天各组间在属水平上的柱状图。(c)在饮食处理后,病毒/噬菌体在属水平上发生改变。
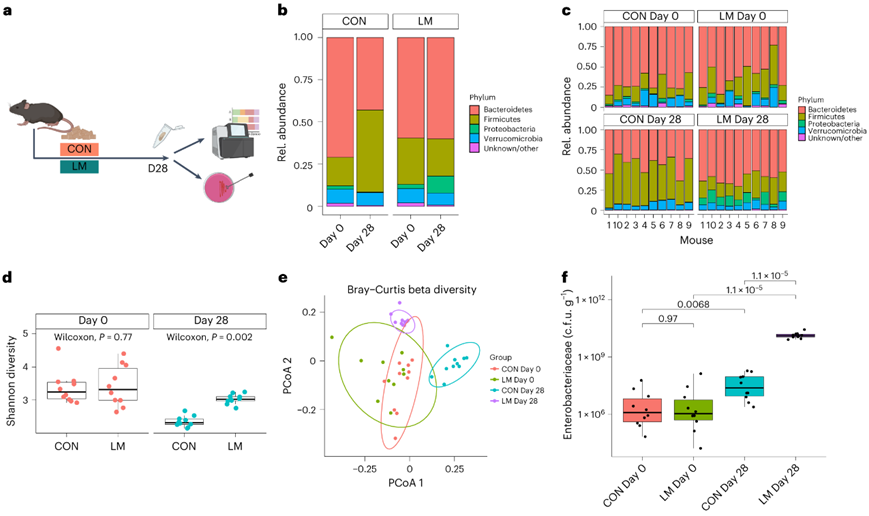
图1. 微量营养素缺乏重塑肠道细菌群落。
(a) 宏基因组测序的实验流程。 (b-c) 按组和个体小鼠在门水平上绘制的条形图。条形代表平均相对丰度。(d) 第0天和第28天的细菌Shannon α多样性。 (e) 按日常和饮食治疗划分的 Bray-Curtis β细菌多样性。 (f) 肠杆菌 cfu 计数。
02
微量营养素缺乏改变菌群和病毒群
在属水平上的真菌组分析显示,第28天的LM组的真菌组成发生了变化。结果表明,在LM组中,Nectriaceae、Pyricariaceae和Trichomaceae的相对丰度显著增加,而Saccharomycetaceae、Pichiaceae和Dipodascaceae的相对丰度较低(图2a)。第28天的组成变化显示,LM小鼠体内富集了Fusarium、Candida 、Pyricularia、 Nakaseomyces、Eremothecium 和Talaromyces等多种真菌属。在对照组中,他们观察到Torulaspora、Tetrapispora、Pichia、Debaryomyces和Yarrowia的富集(图2b)。真菌α多样性没有发现差异(图2c)。然而,在第28天,真菌种类的组成发生了改变(图2d)。他们观察到两个组在科水平上的病毒/噬菌体组成发生了变化,LM小鼠中Marseilleviridae、 Herelleviridae和Microvirdae的丰度较高,CON小鼠中Mypviridae 、Podoviridae和Caliciviridae的丰度较高(图2e)。两组在第28天均显示出不同的病毒种类分组,LM组在此时间点的β多样性与CON组有显著差异(图2f)。
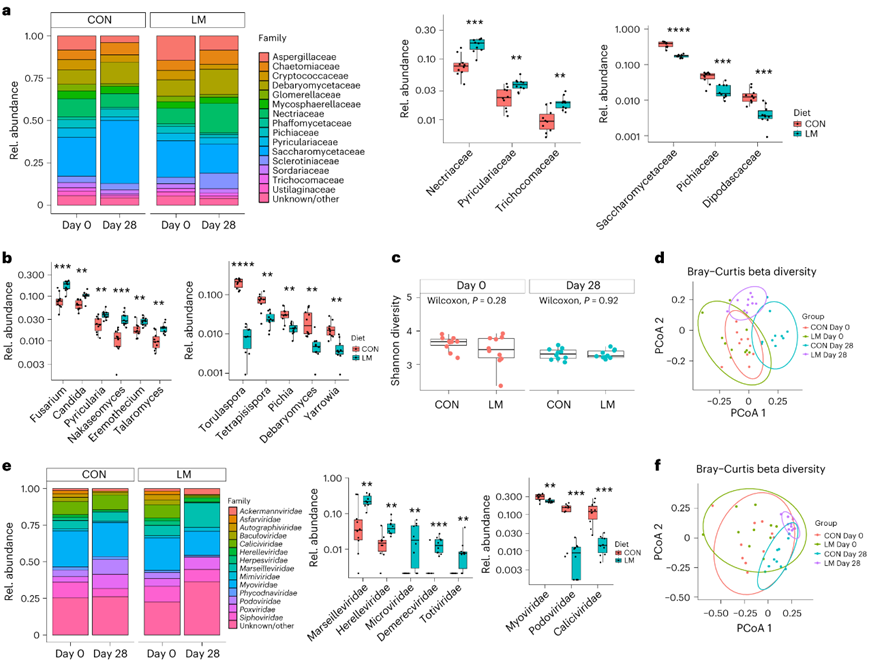
图2. 微量营养素缺乏会改变真菌组和病毒组。
(a) 真菌生物组家族水平的条形图和差异丰度家族的箱线图。 (b) 差异丰度的真菌属。(c) 第 0 天和第 28 天的 Shannon α 多样性。(d) 真菌生物组的 Bray-Curtis β 多样性对日常和饮食的响应。(e) 差异丰度家族的病毒组家族水平条形图和箱线图。(f) 按天数和饮食分组的病毒的 Bray-Curtis β 多样性分析。
03
指示物种分析确定了驱动变化的关键微生物
指标物种分析确定了每个群体高度流行和特异性的微生物。他们发现了14种指示细菌:Pseudoalteromonas spongiae、Klebsiella sp.P1CD1、Klebsiella sp. BDA-134-6、Klebsiella quasivariicola、Klebsiella grimontii、Kaistella jeonii、Enterobacter cloacae complex sp. FDA-CDC_AR_0164、Corynebacterium stationiis、Comamonas aquatica、Candidatus Synthrocurvum alkaliphilum、Candidatus Arthromitus sp. SFB-mouse-NL、Candidatus Arthromitus sp. SFB-mouse, Bacillus sp. 1 NLA3E 和Acinetobacter equine构成CON和LM组的微生物群的主要细菌种(图3a)。相对丰度图显示,与CON组相比,LM小鼠在第28天的肠道菌群中出现了明显的杆状杆菌种类的减少(图3b),而LM小鼠在第28天的肠道菌群中出现了几种Klebsiella和Enterobacter cloacae(图3c-d)。在第28天,CON和LM小鼠也观察到小鼠相关的Candidatus Arthromitus的普遍缺失。在真菌组和病毒组中,他们关注的是MaAsLin2鉴定的不同组之间的显著变化(即富集和缺失)。与CON组相比,LM组的Aspergillus fumigatus、Fusarium venenatum和Zygotorulaspora mrakii的相对丰度显著增加。相比之下,在28 天时,CON小鼠体内的Brettanomyces nanmaleae 、Encephalitzoon romaleae、Kazachstania africana、Naumovozyma castellii和Torulaspora delbrueckii 丰度高于LM小鼠(图3f)。只有Cepunavirus streptococcus的丰度在CON组小鼠中较LM组小鼠有所增加。然而,他们在LM小鼠中观察到几种噬菌体的富集:Acinetobacter phage phiAC-1、Bacillus phage vB_BboD-125、Gordonia phage GTE8和Kayvirus Staphylococcus virus G1(图3e-f)。
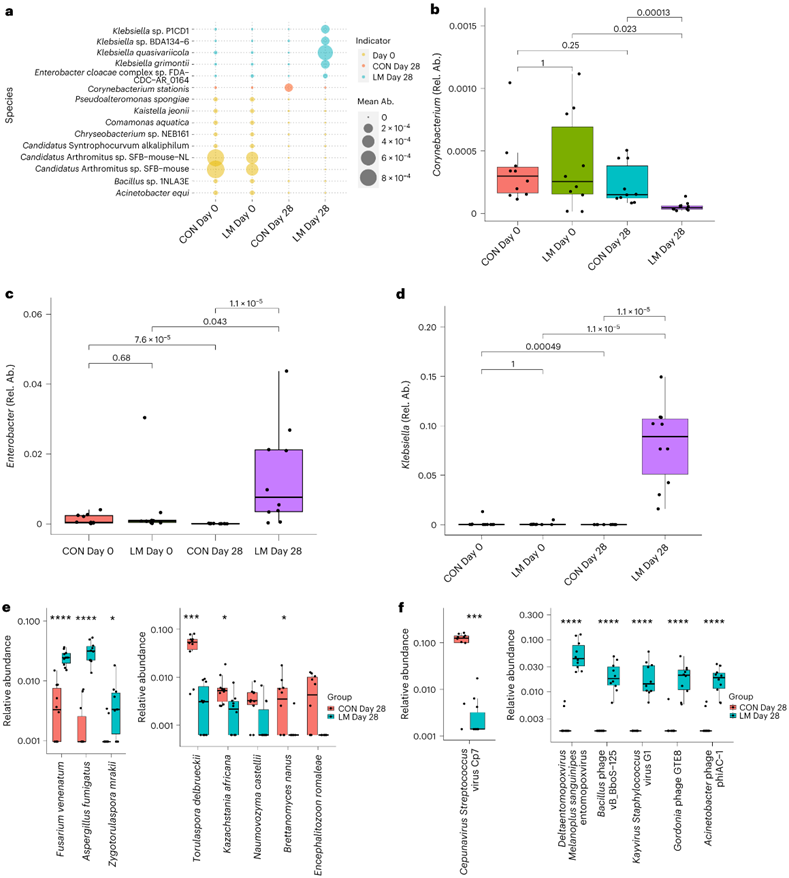
图3. 指示物种分析确定了推动变化的关键微生物。
(a) 导致微生物组组成变化的指示细菌种类。 (b-d) 关键指示物种的属的相对丰度。 (e-f) 真菌和病毒/噬菌体指示物种驱动饮食处理后的变化。
04
微量营养素含量低会导致机会性细菌和真菌的繁殖
机会性细菌(在有害环境下可引起伤害的微生物)的增加是儿童肠道营养不良的常见表型。因此,他们将本研究模型中的机会细菌与营养不良儿童中常见的细菌进行比较。在属或种水平上共检测了1种已知的与营养不良相关的机会性细菌:拟杆菌、弯曲杆菌、肠球菌、埃希菌、嗜血杆菌、克雷伯氏菌、Phocaeicola vulgatus、Prevotella copri、志贺氏菌、葡萄球菌和链球菌(图4a)。与CON小鼠相比,LM小鼠在第28天的总机会菌相对丰度总体上有所增加(图4b)。LM组在第28天有7个分类群的相对丰度显著增加:克雷伯氏菌、肠球菌、Phocaeicola vulgatus、埃希氏菌、弯曲杆菌、嗜血杆菌和志贺氏菌。脆弱拟杆菌呈上升趋势,但未达到显著水平。LM组有三种细菌丰度降低:链球菌、葡萄球菌和Prevotella copri(图4c-d)。
高水平胃肠道真菌是营养不良儿童的常见表型。因此,他们同样检测了样本中的真菌病原体。在第28天,与CON小鼠相比,LM小鼠中真菌病原体念珠菌的数量显著增加(图4e)。在CON小鼠中,白色念珠菌从第0天到第28天增加,而在LM组没有变化。在LM小鼠菌群中,从第0天到第28天,杜氏假丝酵母(Candida dubliniensis)的相对丰度较高,随着时间的推移,Candida orthopsilosis在CON组略有下降,但在LM组没有(图4f)。
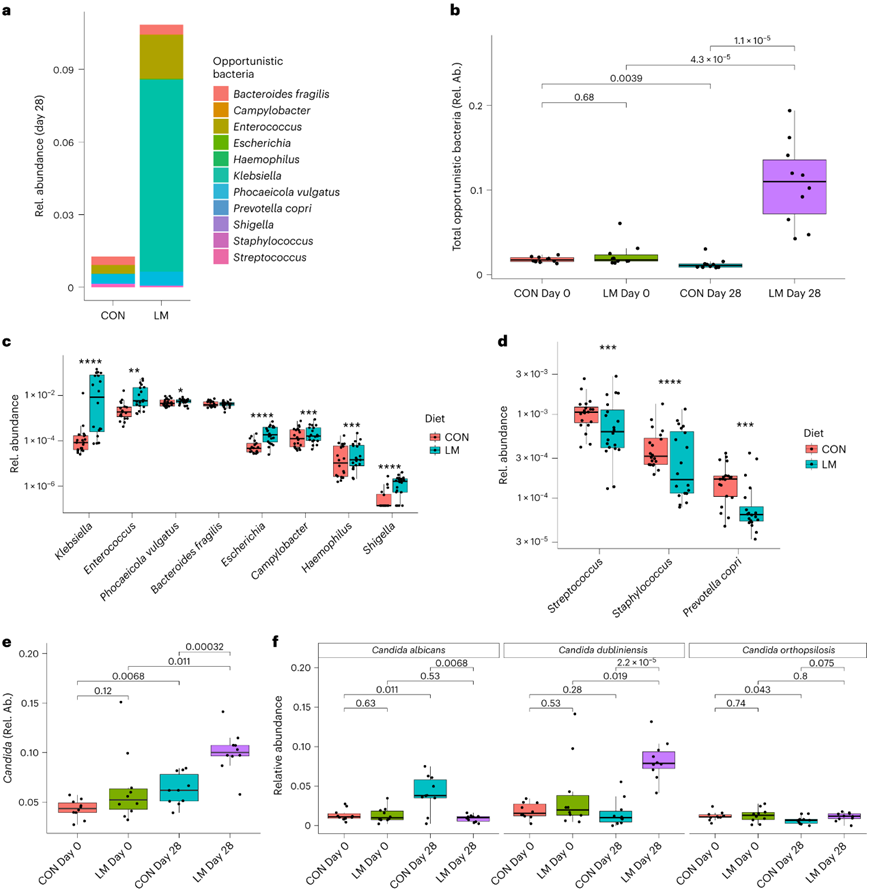
图4. 微量营养素含量低会导致机会性细菌和真菌的繁殖。
(a) 在其他营养不良样本中鉴定了 11 种机会性细菌的物种。条形代表平均相对丰度。(b) 第 28 天,LM 处理的小鼠中机会性细菌总数增加。(c) 第 28 天,LM 小鼠体内富集了 8 种机会性细菌。 (d) 第 28 天,LM 组中三种机会性细菌链球菌、葡萄球菌和普氏菌显著减少。(e) 念珠菌在第28天显著增加,特别是在LM小鼠中。 (f) 物种水平分辨率显示CON和 LM小鼠中的C. alibicans和C. dubliniensis 分别增加。
05
机会性细菌与耐药性基因组扩增相关
抗生素耐药性,无论是内在的还是获得性的,都是由几个关键机制驱动的(图5a)。使用综合抗生素耐药性数据库(CARD)分析,显示肠道耐药基因组的相对丰度增加(图5b)。随后的分析表明,抗生素外排和抗生素失活是最常见的内在耐药机制改变。与抗生素外排、抗生素失活、抗生素通透性降低和靶点改变的基因丰富度在第28天显著增加(图5c)。在第28天,LM组的抗生素耐药性基因(ARG) α多样性显著提高(图S2a)。基于Bray–Curtis的差异分析显示,低微量营养素饮食强烈地塑造了早期肠道耐药基因组(图S2b)。对ARG的统计显示,绝大多数ARG≥30%仅在LM第28天组流行(图S2c)。ARG与真菌组或病毒组之间没有相关性(图S2d-e)。CARD数据库对药物类别的映射和分析显示,氟喹诺酮类/大环内酯类/苯胺类抗生素,其次是膦酸(即磷霉素)和二氨基嘧啶类/氟喹诺酮类/甘环素类/硝基呋喃类/四环素类药物是LM小鼠中最常见的耐药机制发生改变的药物类别(图S3a)。仅在 LM 小鼠中发现抗生素药物类别与机会细菌之间呈正相关(图S3b)。
他们观察到克雷伯氏菌、嗜血杆菌、埃希氏菌、弯曲杆菌、Phocaeicola vulgatus与LM小鼠中的几种药物类别呈正相关(图5d)。不出所料,克雷伯氏菌和埃希氏菌与ARG药物类别的相关性比其他机会性细菌更强。在个别机会菌中,克雷伯菌和弯曲菌与抗生素外排机制相关,克雷伯菌、志贺氏菌、弯曲菌和埃希氏菌与抗生素失活相关,肠球菌与外排机制相关(图5f-g)。
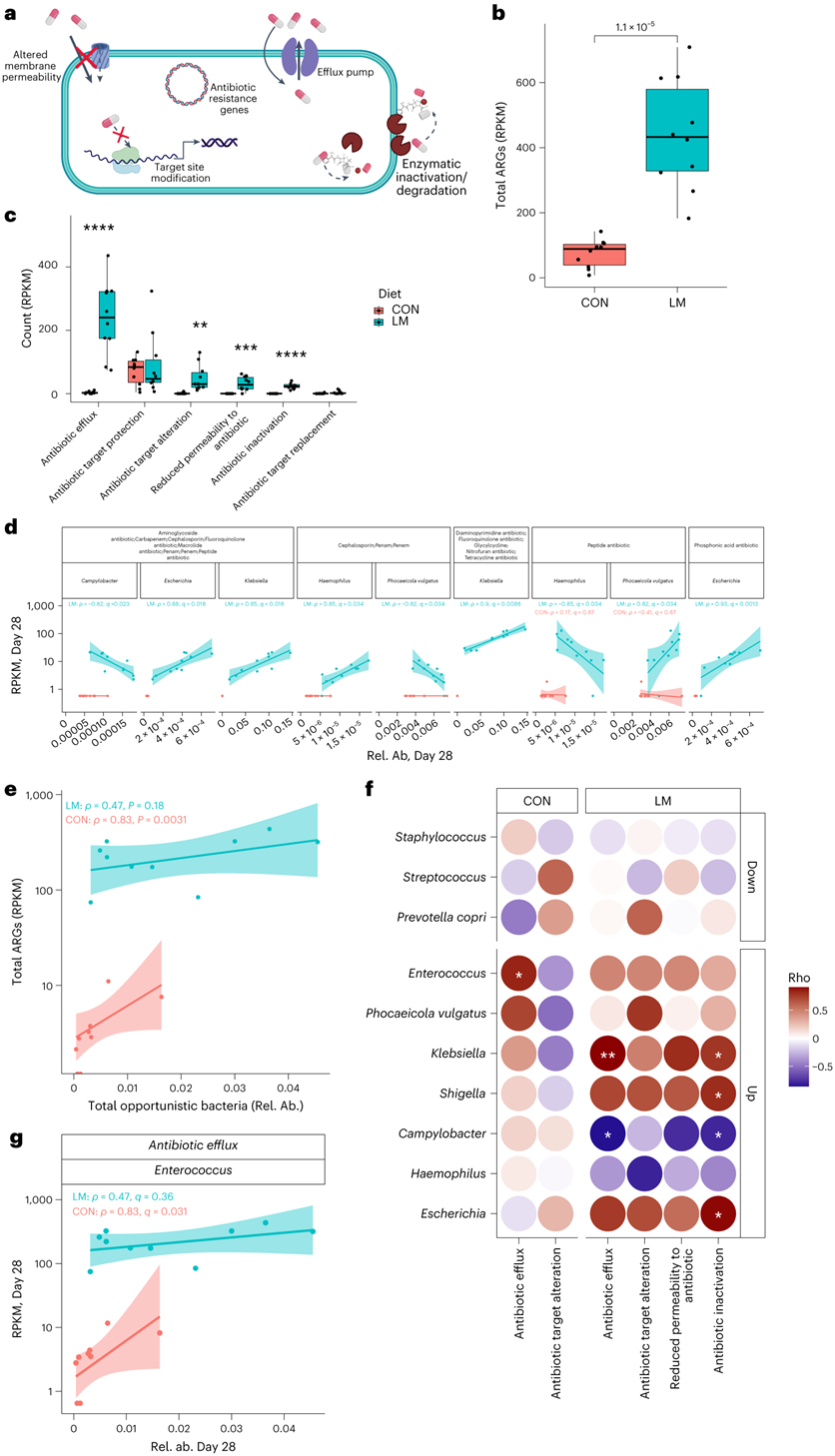
图5. 机会性细菌与耐药性增加相关。
(a) 抗生素耐药机制的图形表示。 (b) 第28天LM小鼠中抗生素耐药性基因(ARG)的总RPKM丰度增加。(c) 每组抗生素耐药机制(RPKM)。(d) 差异丰度的机会性细菌和药物类别的Spearman相关分析。 (e) 第28天按治疗类型对总ARG和总机会性细菌进行的Spearman相关分析。 (f) 点图代表差异丰度的机会性细菌和耐药机制之间的 Spearman 相关性。 (g) 肠球菌和抗生素外排(efflux)基因之间相关性的可视化。
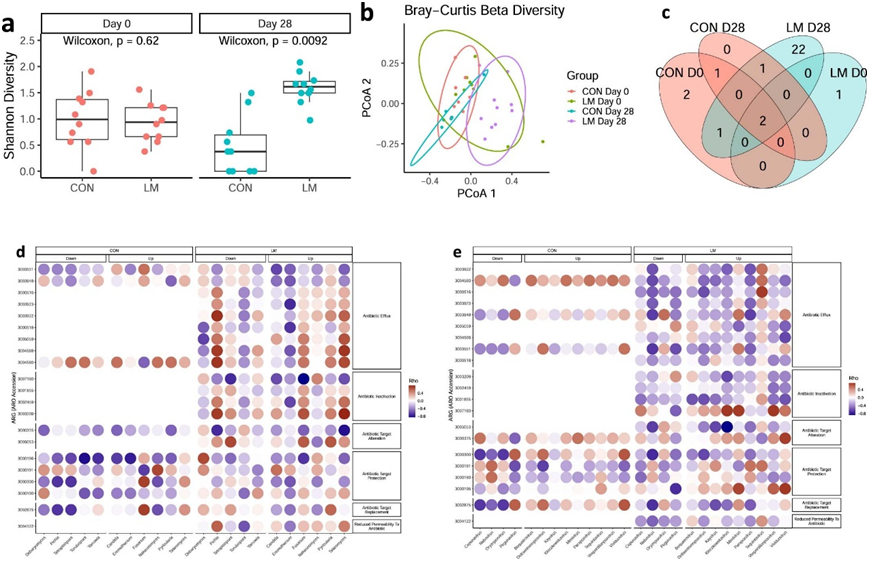
图S2. 微量营养素缺乏小鼠抗生素耐药基因组扩增。
(a)耐药基因组的Shannon α多样性。(b) 耐药基因组的Bray-Curtis β多样性分析。(c) ARG在特定群体中流行率≥30%的维恩图。(d) 抗生素耐药性与菌群的相关性。(e) 抗生素耐药性与病毒的相关性。
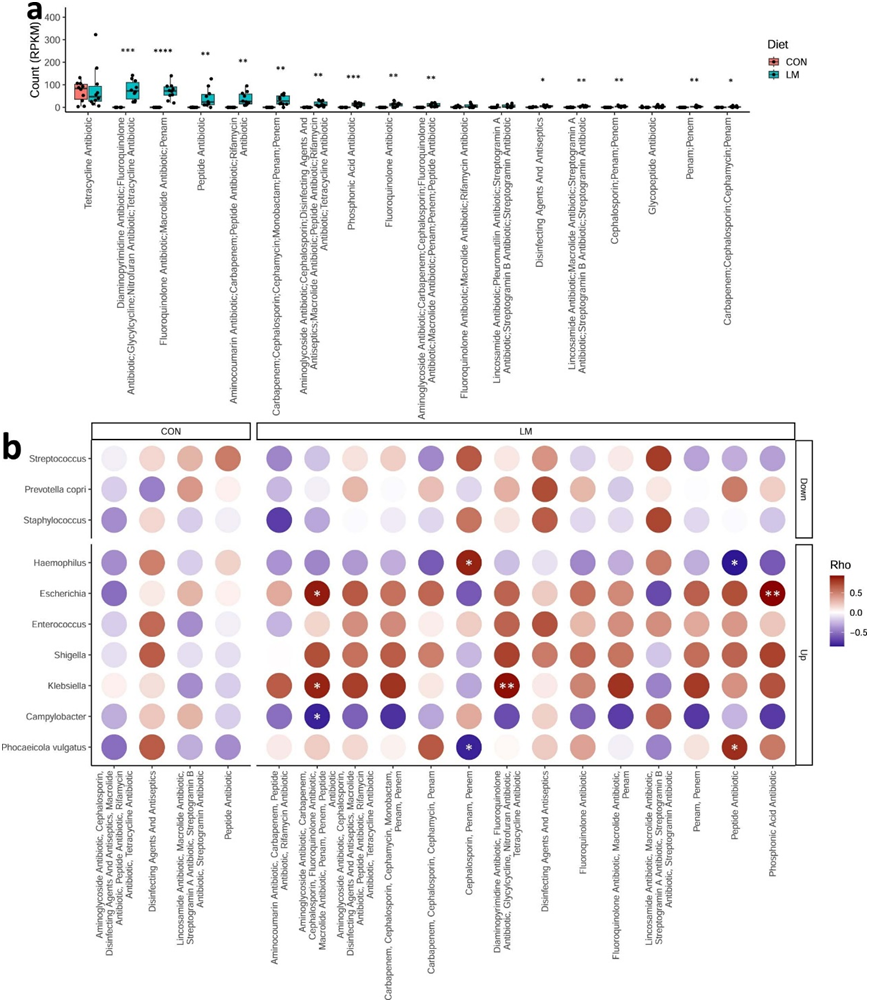
图S3. 微量营养素缺乏小鼠抗生素耐药基因组扩增。
(a)每组抗生素药物类RPKM计数。(b)机会细菌与抗生素类药物Spearman相关分析热图。
06
细菌氧化应激与内在耐药性相关
营养匮乏等环境压力源会引发细菌的应激反应,从而诱导抗生素耐药机制作为一种生存策略。在 LM 小鼠中,他们发现编码氧化应激和氧化应激反应的基因更加富集(图 6a),总 ARG 之间具有很强的相关性和氧化应激(图6b)。具体而言,他们观察到氧化应激反应与抗生素外排泵(ARO 3003551、emeA、ARO 3003948、erfA)、抗生素靶标保护(ARO 3000300、IsaA)和抗生素靶标置换(ARO 3002875,dfrE)密切相关(图6c)。在LM小鼠中,肠球菌和克雷伯氏菌、志贺氏菌、弯曲杆菌、埃希菌、肠杆菌科和变形杆菌科的氧化应激反应的调节显著增加(图6d)。
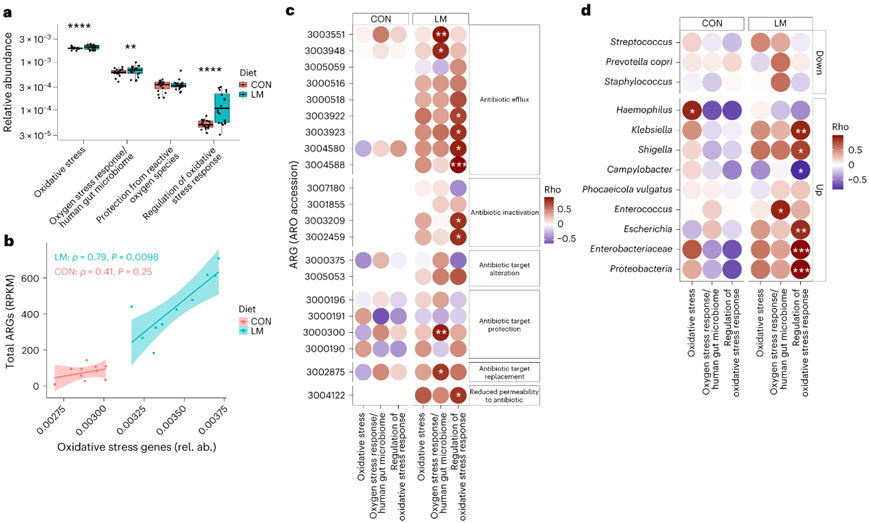
图6. 细菌氧化应激与内在耐药性相关。
(a) LM 小鼠 (MaAsLin2) 中氧化应激反应基因增加。(b) 氧化应激与第 28 天 LM 小鼠中的总 ARG 相关。(c-d) 第 28 天差异丰度氧化应激机制和 ARO 数据或机会性细菌的 Spearman 相关性。
+ + + + + + + + + + +
结 论
本项研究使用了缺乏多种微量营养素(即缺乏锌、叶酸、铁、维生素 A 和维生素 B12)的产后小鼠模型,并对粪便样本进行宏基因组测序,以表征肠道微生物组结构和功能潜力以及耐药基因组。与CON小鼠相比,微量营养素缺乏的小鼠中肠杆菌科细菌含量升高。真菌组和病毒组也因多种微量营养素缺乏而发生改变,包括真菌病原体的增加,例如Candida dubliniensis和噬菌体。尽管未使用抗生素,但微量营养素缺乏与病原菌编码的基因和基因网络的富集增加有关,而病原菌编码的基因和基因网络与内在的抗生素耐药性相关。细菌氧化应激与这些小鼠的内在抗生素耐药性相关。该分析揭示了由于同时发生多种微量营养素缺乏而导致的肠道微生物组的多界变化以及抗生素耐药性的影响。
+ + + + +



 English
English


