文献解读|Nat Commun(14.919):胃印戒细胞癌的单细胞分析揭示了细胞学和免疫微环境特征
+ 论文ID 原名:Single-cell analysis of gastric signet ring cell carcinoma reveals cytological and immune microenvironment features 译名:胃印戒细胞癌的单细胞分析揭示了细胞学和免疫微环境特征 期刊:Nature communications. 影响因子:14.919 发表时间:2023.03 DOI号:10.1038/s41467-023-38426-4
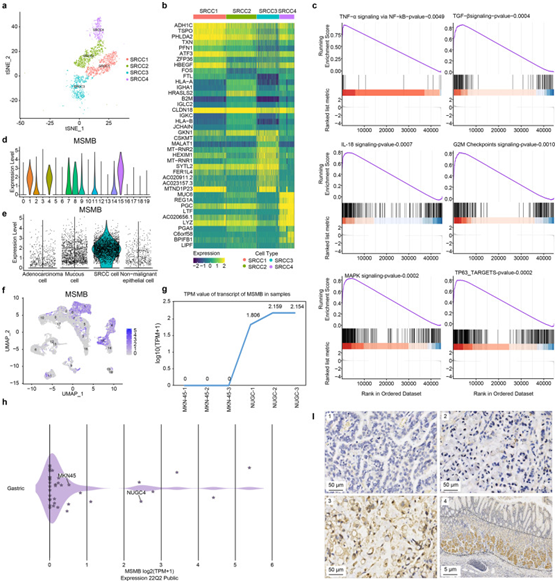
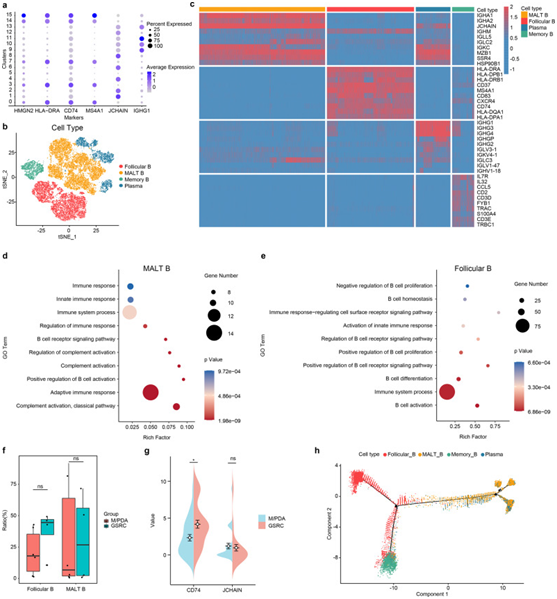
背 景 胃印戒细胞癌(GSRC)是癌症(GC)的一种特殊亚型,预后较差,但缺乏对GSRC的深入系统研究。作者进行单细胞RNA测序来评估GC样品,鉴定了印戒细胞癌(SRCC)细胞。微球蛋白β(MSMB)可作为标记基因,指导中/低分化腺癌和SRCC的鉴别。SRCC细胞中上调的差异表达基因主要富集于异常激活的癌相关信号通路和免疫反应信号通路。SRCC细胞还显著富集有丝分裂原活化蛋白激酶和雌激素信号通路,它们可以在正反馈回路中相互作用和促进。SRCC细胞被证明具有较低的细胞粘附力和较高的免疫逃逸能力以及免疫抑制微环境,这可能与GSRC相对较差的预后密切相关。总之,GSRC表现出独特的细胞学特征和独特的免疫微环境,这可能有利于准确诊断和治疗。 实验设计 结 果 01 癌旁组织和GA组织中主要细胞类型的scRNA-seq综述和鉴定 首先应用单细胞RNA测序(scRNA-seq)技术对13例GA患者的标本进行分析。在滤出低质量细胞、去除双联读数并校正批量效应后,分析了总共149782个单细胞的转录组(图1a)。使用10×Genomics的官方分析软件CellRanger,基于主成分分析(PCA)和聚类分析将细胞分为26个聚类(图1c)。Seurat软件用于分析细胞簇之间的基因表达差异,并筛选在不同细胞中上调的基因(图1d)。基于无偏细胞类型识别,最终确定了8个不同细胞簇的分布(图1e)。细胞簇根据特定标记基因命名:B细胞、内皮细胞、上皮细胞、成纤维细胞、肥大细胞、肌样细胞,平滑肌细胞和T细胞。为了进一步了解细胞聚类,从细胞来源、分组和细胞比例等方面进行了深入分析(图1f–h)。 图1癌旁组织和GA组织中主要细胞类型的scRNA-seq综述和鉴定。 a scRNA-seq过程的示意图。b scRNA-seq的实验设计和相应的验证。在发现队列中,分析了13例接受根治性胃切除术的GA患者的癌症组织(n=13)和癌旁组织(n=5)。在验证队列中,GSRC(n=30)和M/PDA(n=10)样本用于IHC验证。c癌症组织(n=13)和癌旁组织(n=5)中26种主要细胞类型的t分布随机邻嵌入(tSNE)图。d显示8种细胞类型中细胞类型标记基因表达水平的Violin图。f癌症和癌旁组织细胞的t-SNE图,按样本来源着色。g 癌症组织细胞的t-SNE图,按分化程度和印戒细胞含量分组。h癌症组织细胞比例图(n=13),按分化程度和印戒细胞含量分组。 02 恶性和非恶性上皮细胞的鉴定 通过对上皮细胞的聚类分析,获得了20个亚聚类(图2a)。根据标记基因癌症细胞、粘液细胞、主细胞、壁细胞和内分泌细胞(图2b),亚类又分为5个亚类。在低分化腺癌伴印戒细胞癌(PDSRCC)和GSRC中,粘液细胞的比例显著增加(图2e)。 图2 上皮细胞的单细胞转录组图。 a癌症组织(n=13)和癌旁组织(n=5)20个上皮细胞的t-SNE图。b细胞类型标记基因在5种细胞类型中的表达水平的点图。c癌症组织(n=13)和癌旁组织(n=5)上皮细胞的t-SNE图(按细胞类型着色)。亚簇6、11、12和13鉴定为M/PDA细胞,亚簇14和16鉴定为主细胞,亚聚类18和19鉴定为顶叶细胞,亚集群9鉴定为内分泌细胞,其他亚聚类鉴定为粘液细胞。5种细胞类型的标记基因表达水平的d-t-SNE图。e癌症组织上皮细胞比例图(n=13)。f所选细胞类型的特征基因的免疫荧光图(n=26)。胃窦粘液细胞用DAPI(蓝色)、TTF1(红色)和MUC5AC(绿色)染色。胃窦基底腺粘液细胞用MUC6(绿色)、TTF2(红色)和DAPI(蓝色)染色。g癌症组织(n=13)和癌旁组织(n=5)粘液细胞的t-SNE图(按组织来源着色)。h癌症组织(n=13)和癌旁组织(n=5)亚簇粘液细胞的t-SNE图(按组织来源分类,按细胞类型着色)。 接下来使用从癌症基因组图谱(TCGA)获得的80个癌症细胞相关基因的平均表达水平,比较非恶性上皮和M/PDA细胞之间的癌相关评分,两组之间存在显著差异(图3a)。在SRCC和粘液细胞之间也发现了相同的结果(图3b)。其次基于InferCNV的表达矩阵,M/PDA细胞的CNV显著高于非恶性上皮和粘膜细胞,而SRCC细胞的CNV低于粘膜细胞(图3c)。还进行了GSVA以表征粘液和SRCC细胞的不同来源(图3f)。 图3 鉴定后非恶性上皮和恶性上皮的验证图。 a箱线图显示了归类为非恶性上皮细胞和M/PDA细胞的细胞的癌症相关得分分布(癌症相关上皮标记基因的平均表达水平)(t检验,p<2.2×10−16)。B箱线图显示SRCC细胞和粘液细胞的癌相关得分分布(癌相关上皮标记基因的平均表达水平)(t检验,p<2.2×10−16)。c热图显示所有上皮细胞亚簇的推断CNV。d显示所有上皮细胞亚群的CNV评分图的直方图。e按细胞类型显示上皮细胞CNV评分图的箱线图。SRCC细胞的CNV评分低于M/PDA和粘液细胞,而高于非恶性上皮细胞(t检验,p<2.2×10−16)。f SRCC和粘液细胞的GSVA。SRCC细胞主要富集于肿瘤相关信号通路,如TNF-α信号通路、NF-κB信号通路和TGF-β信号通路。 03 scRNA-seq揭示了SRCC的特征 SRCC细胞被分为四个亚群(图4a)。根据热图分析,SRCC细胞之间存在显著的异质性(图4b)。根据GSEA分析结果,SRCC细胞中上调的基因主要富集在免疫反应中,包括通过NF-kB信号通路、TGF-β信号通路和IL-18信号通路的TNF-α信号通路(图4c)。重要的是,MSMB被发现是GSRC的一个潜在标记基因。MSMB的表达水平与SRCC细胞亚群的表达水平基本一致,MSMB在M/PDA细胞中基本上无/低表达(图4d,e)。scRNA-seq结果显示,MSMB在SRCC细胞中的表达水平高于粘液细胞和M/PDA细胞(图4f)。在相应的细胞系中进行验证,SRCC细胞系NUGC4表现出比低分化MKN-45腺癌细胞系更高的MSMB表达水平(图4g,h)。使用IHC进行了进一步验证(图4I)。 图4 SRCC细胞的基本特征。 a 4个SRCC细胞亚群的t-SNE图。b SRCC细胞的4个亚簇的热图。c GSEA结果表明,SRCC细胞中富含癌相关信号通路。d亚簇中MSMB表达水平的Violin图。MSMB的表达水平通常与SRCC细胞的1、4、8和15亚群中的表达水平一致。MSMB在M/PDA细胞中弱表达或根本不表达。e上皮细胞中MSMB表达水平的小提琴图(按细胞类型分类)。MSMB在SRCC细胞中的表达水平相对高于粘液细胞和M/PDA细胞。f亚群中MSMB表达水平的UMAP图。g通过细胞培养的MSMBin MKN45和NUGC4细胞的转录物的TPM值。h通过DepMap数据库测定细胞系中MSMB转录物的TPM值。i癌症组织和癌旁组织中MSMB表达水平的IHC图(n=69)。 04 M/PDA与SRCC细胞的异同 首先对M/PDA和SRCC细胞中的差异表达基因(DEG)进行了分析(图5a)。通过对上调的DEG和信号通路的富集分析,SRCC细胞中上调的基因主要富含异常活跃的癌症相关信号通路(例如,癌症中的转录调控错误、癌症中的通路和癌症中的microRNAs),并且与免疫逃逸的信号通路密切相关(例如,TNF-α信号通路、TGF-β信号通路和NF-kB信号通路)(图5b,c)。在细胞培养中进行相应的验证,并获得相同的结果(图5d,e)。M/PDA细胞具有高增殖和免疫监测能力,而SRCC细胞具有低细胞粘附和高免疫逃逸能力(图5f)。 图5 M/PDA与SRCC细胞的异同。 a M/PDA和SRCC细胞的t-SNE图(按细胞类型着色)。b M/PDA和SRCC细胞中上调的DEG的通路富集分析图。c M/PDA和SRCC细胞中DEG的热图。d MKN-45和NUGC4细胞中DEG的热图。e DEG中MKN-45和NUGC4细胞的KEGG途径富集分析。f M/PDA和SRCC细胞在细胞增殖、细胞粘附、免疫监测和免疫逃逸方面的差异。 05 M/PDA和GSRC中B细胞的浸润特性 利用标记基因将来自簇3和簇4的B细胞重新聚类为16个亚簇(图6a,b)。从B细胞的每个亚簇中提取前10个基因以形成热图后,发现MALT-B细胞主要表达IgA相关基因,而浆细胞主要表达IgG相关基因(图6c)。随后,对每个亚簇进行富集分析,发现MALT-B和浆细胞具有相似的功能,主要与免疫反应、B细胞激活和参与补体激活有关。然而,卵泡B细胞具有相对较弱的免疫反应(免疫系统过程和B细胞的调节)(图6d)。与M/PDA相比,GSRC中肿瘤浸润性卵泡B细胞(表达CD74)的IHC评分更高(图6f)。基于亚簇的定义进行了Monocle算法分析,来自不同亚簇的大多数细胞根据其基因表达的相似性进行聚类,而以假时间聚类的不同亚簇从标记点1开始显示了一个逐步的过程。B细胞分为两个分支:一个由滤泡B细胞和记忆B细胞组成;另一种由MALT-B细胞和浆细胞组成(图6g)。 图6 M/PDA与GSRC肿瘤浸润性B细胞的异同。 a显示4种细胞类型中细胞类型标记基因的表达水平的点图。b t-SNE图,显示B细胞的亚簇(按细胞类型着色)。c显示B细胞亚簇的热图。d MALT-B细胞的功能信号通路富集图。MALT-B细胞主要与免疫反应、B细胞活化和参与补体活化有关。e卵泡B细胞的功能信号通路富集图。卵泡B细胞与免疫系统和B细胞的调节有关。f M/PDA和GSRC中肿瘤过滤卵泡B和MALT-B细胞的箱线图。与M/PDA相比,肿瘤浸润卵泡B细胞在GSRC中较高,差异无统计学意义(t检验,p=0.019);类似地,M/PDA和GSRC之间的肿瘤浸润MALT-B细胞没有差异(t检验,p=1)。g通过IHC评分的M/PDA和GSRC中肿瘤过滤卵泡B和MALT-B细胞的Pod图(n=30)。与M/PDA相比,GSRC中肿瘤浸润性卵泡B细胞(表达CD74)的IHC评分更高,差异具有统计学意义(Wilcoxon秩和检验,p=0.012);GSRC中肿瘤浸润MALT-B细胞(表达JCHAIN)的IHC评分较高,但差异无统计学意义(Wilcoxon秩和检验,p=0.154)。h B细胞亚群的伪时间序列分析。 06 M/PDA和GSRC中T细胞的浸润特性 来自0、1、13和14簇的T细胞被重新聚类成14个独立的亚簇(图7a )。利用标记基因(图7b )将亚簇细分为10个细胞亚簇(图7c ):来自簇0的亚簇为CD4-Th17细胞;来自簇1的亚簇为CD4-Tn或中央记忆型T(Tcm)细胞;来自簇2、3、4和10的亚簇为CD8-Teff细胞;来自簇5的亚簇为CD8-Tex细胞;来自簇6的亚簇为CD4-Treg细胞;来自簇7的亚簇为初始T细胞;来自簇8的亚簇为CD8-Tem细胞;来自簇9的亚簇为祖T细胞;来自簇11的亚簇为自然杀伤(NK)细胞,而来自簇12的亚簇则为其他细胞。 通过对样品的分析,发现CD4-Th17、CD4-Tn或Tcm和CD8-Teff细胞主要浸润癌旁组织,并主要表现出免疫功能。CD4-T调节细胞在癌症组织中的浸润率明显高于癌旁组织,尤其是在GSRC中。同时,GSRC具有比M/PDA更少的肿瘤浸润性CD8-Teff细胞(图7d)。 图7 M/PDA与GSRC肿瘤浸润性T细胞的异同。 a显示T细胞亚簇的t-SNE图。b显示10种细胞类型中细胞类型标记基因表达水平的点图。c显示T细胞亚簇的t-SNE图(按细胞类型着色)。d T细胞亚群的比例图(n=13)。e显示t细胞亚簇的t-SNE图(按组着色)。f M/PDA和GSRC中肿瘤浸润CD4-Treg和CD8-Teff细胞的箱线图。g通过IHC评分的M/PDA和GSRC中肿瘤浸润CD4-Treg和CD8-Teff细胞的差异图(n=30)。 + + + + + + + + + + + 结 论 总之,本研究用scRNA-seq分析了5例患者癌旁组织中的32456个单细胞和13例患者癌症组织中的117326个单个细胞,已经鉴定出SRCC细胞。MSMB可以作为一种标记物来指导SRCC和M/PDA细胞的鉴定。SRCC中上调的DEG主要富集于异常激活的癌相关信号通路和免疫反应信号通路。SRCC还可以在MAPK和雌激素信号通路中显著富集,这两种信号通路可以相互作用和促进,并继续放大彼此的作用。SRCC细胞表现出较低的细胞粘附力和较高的免疫逃逸能力,以及免疫抑制微环境,这可能与GSRC相对较差的预后密切相关。本研究的一个局限性是难以收集足够的样本,并且缺乏多组分的分析方法。总体而言,与M/PDA细胞相比,GSRC细胞具有独特的细胞学特征和独特的免疫微环境,这可能有利于GSRC的准确诊断和治疗。







 English
English


