文献解读|Bone Res(13.362):神经元到血管信号传导是软组织创伤后异常干细胞定型的必要特征
+ 论文ID 原名:Neuron-to-vessel signaling is a required feature of aberrant stem cell commitment after soft tissue trauma 译名:神经元到血管信号传导是软组织创伤后异常干细胞定型的必要特征 期刊:Bone Research 影响因子:13.362 发表时间:2022.6.1 DOI号:10.1038/s41368-021-00140-6
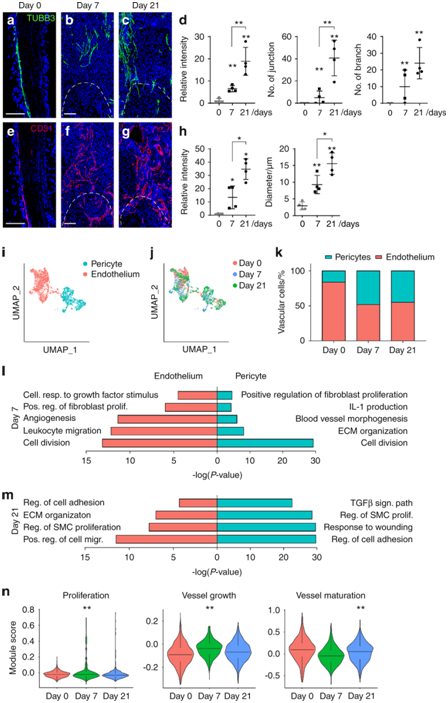
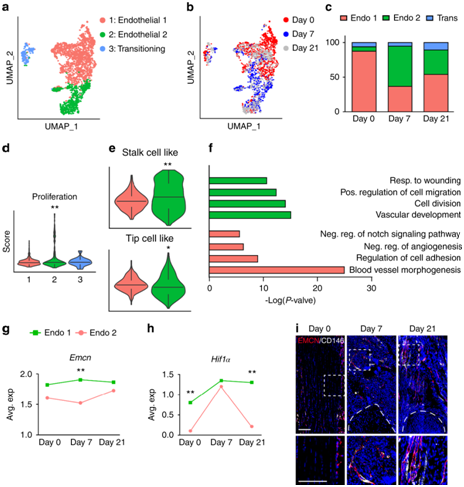
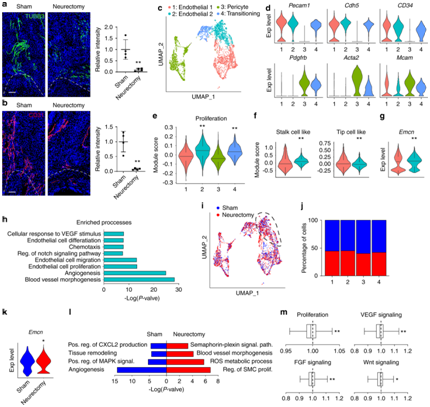
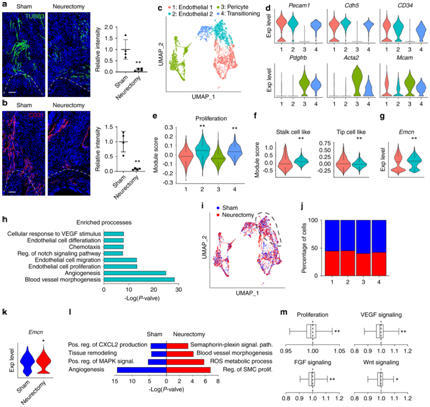
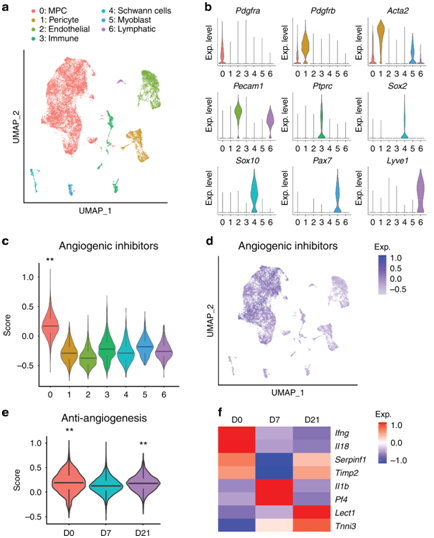
背 景 神经和血管的功能相互依赖性是组织形态发生过程中的一个既定概念,然而神经元到血管信号传导在适当和异常组织修复中的作用是一个新兴的兴趣领域。 实验设计 结 果 01 软组织创伤后的神经血管向内生长伴随血管细胞内的转录变化 研究者团队使用异位骨化(HO)诱导模型,发现在异位骨的发育过程中发生神经元萌芽,他们将轴突向内生长与血管增殖和成熟联系起来(图1a-d)。未受伤肌腱的神经支配是有限的,并且局限于腹膜,如 Beta III 微管蛋白免疫荧光染色所示(图1a)。在HO诱导的肌腱切断术中,在第7天发现肌腱相关神经快速向内生长(损伤纤维增殖期)(图1b),并在第 21 天出现进展(图1c)。TUBB3+ 轴突的定量证实了整体染色强度的增加,但神经元投射的复杂性也随着连接和分支点的增加而增加(图1d)。他们进行CD31免疫荧光染色以在相同的时间过程中突出血管生成(图1e–g)。观察到类似的血管生长空间模式,其中内皮主要局限于未受伤肌腱(图1e),并且在HO诱导后7天和21天发现CD31+血管通道的逐渐增加(图1f-g)。与神经元组织形态计量学的变化并行,血管分布的量化显示了类似的动力学,即CD31内皮的总体进行性增加,以及血管通道平均直径的增加,反映了更成熟的血管网络(图1h)。 接下来在这段时间内检查HO诱导位点的单细胞RNA测序(scRNA-seq)谱(图1i-m)。22902 个总细胞中的4043 个细胞鉴定为内皮细胞(Pecam1high、Cdh5 high)或周细胞(Acta2 high、Pdgfrb high)用于进一步分析(图1i)。这两个细胞聚类在所有时间点都有表现(图1j),损伤后周细胞频率相对富集(图1k)。 GO 分析显示,损伤后 7 天,两种血管细胞类型都显示出与细胞增殖、血管生成和炎症调节相关通路的富集(图1l)。21天后,血管细胞类型显示出与平滑肌细胞增殖、细胞粘附和迁移、基质组织和TGFβ信号传导相关通路的富集(图1m)。观察到这些随时间的动态变化后,他们接下来使用与细胞增殖、血管生长和成熟相关的基因模块检测了内皮细胞的变化(图 1n)。损伤后 1 周,增殖和血管生长的模块评分急剧增加,3 周后重新近似未损伤内皮的状态。相比之下,“血管成熟”模块评分显示出相反的趋势,其中在损伤后 1 周观察到急剧下降,与损伤后3周未损伤内皮细胞评分相近。因此,神经血管生长和网络成熟伴随着创伤诱导的 HO,并且损伤后 1 至 3 周之间的时期是在转录和组织学水平上检测这一过程的动态时间范围。 图1. 软组织创伤后的神经血管向内生长和转录谱 02 内皮细胞亚聚类突出了HO诱导后H型血管的增加 在证明损伤后内皮细胞表型发生变化后,接下来进行内皮细胞亚聚类(图2)。在重新聚类后,鉴定出Pecam1high、Cdh5high细胞的三个亚聚类:内皮细胞1、内皮细胞2和小的“过渡”细胞群(图2a),后者表达内皮和周细胞标记物的组合(例如Mcam、Pdgfrb、Acta2)。所有群体在HO诱导前后都有代表性,但与基线未损伤样本相比,内皮细胞2在第7天和第21天的代表性大大过高(图2b-c)。内皮细胞2亚聚类的表征显示了高增殖表型,这是通过与其他细胞聚类相关的模块评分确定的(图2d)。 尖端细胞和柄细胞代表了新生血管芽中两种不同的内皮细胞表型,一种引导生长的血管(尖端),另一种增殖并跟随(柄)。进一步的转录组学表征揭示了内皮2亚聚类中的柄状细胞表型,而内皮细胞1使用模块评分证明了尖端细胞样表型的富集(图2e)。GO分析证明,在内皮2亚聚类中,与增殖、血管生成和对肢体损伤的反应相关的通路相对富集,而内皮聚类1显示出调节表型(图2f),证明了尖端和柄细胞表型的特征。 参与骨-血管生成耦合的内皮亚型受到了很多关注,包括以高表达内膜蛋白(Emcn)为特征的H型血管。与内皮细胞1亚聚类相比,内皮细胞2亚聚类表达更高水平的Emcn(图2g)。此外,内皮细胞2亚聚类在基线时显示出缺氧诱导因子1亚基α(Hif1α)的更高表达,并且在HO诱导时,Hif1α的高表达先前与H型血管表型有关(图2h)。 接下来,他们使用全血管标记物CD146的联合免疫组织化学,对与未受伤对照相关的损伤部位进行了Emcn的免疫荧光染色(图2i)。结果显示,在未受伤的肌腱内很少有Emcnhigh血管,主要局限于肌腱周围。在HO诱导损伤后7天和21天观察到Emcnhigh血管的逐渐增加。这些数据表明,在创伤性HO进化的早期时间点,具有H型表型的内皮细胞有所增加。 图2. 内皮细胞亚聚类揭示软组织创伤后的不同细胞群 03 去神经支配可防止软组织创伤后血管向内生长并改变内皮表型 坐骨神经切除术导致 HO 部位的神经纤维频率减少了 90.1%(图3a),CD31免疫荧光染色显示坐骨神经切除术后血管的明显减少(图3b)。接下来他们对scRNA-seq数据重新分析,在总共 16823 个细胞中,捕获了 3616 个血管细胞,并将其分布在 4 个子聚类中,包括内皮细胞 1、内皮细胞 2、周细胞,以及一个具有共享标记的“过渡”聚类,内皮细胞和周细胞(图3c-d)。内皮细胞 2 亚群通过模块评分显示出最高的增殖指数(图3e),表达与茎细胞样表型更一致(图3f),以及高Emcn表达(图3g)。GO分析显示,内皮细胞2亚聚类的内皮增殖、迁移和血管生成等生物过程的相对富集(图3h)。 接下来,对假手术条件和神经切除条件进行比较(图3i-m)。每个血管亚聚类都存在于假手术和神经切除条件下(图3i),并且与神经切除样品相比,假手术中总体频率略有增加(图3j),内皮细胞2亚聚类在神经切除术后Emcn表达减少(图3k-l),与血管生成、组织重塑和MAPK信号相关的通路在对照(假手术)条件下富集(图3m)。在神经切除术条件下,增殖指数降低。也观察到信号通路的改变,包括神经切除小鼠内皮细胞中VEGF、FGF和WNT信号通路评分的降低(图3m)。因此,手术去神经抑制HO相关的血管生成,伴随着内皮细胞转录表型的改变,这可能是HO形成的必要特征,并为可能靶向的分子途径提供了新的见解。 图3. 神经切除术会损害软组织创伤后的血管浸润 04 TrkA 信号传导的药物遗传学或药理学抑制会损害创伤部位的血管生成 接下来,他们评估两种已建立的模型在HO诱导损伤的情况下特异性抑制表达Trka的神经(图4)。表达TrkA的神经向内生长首先使用化学-遗传方法进行抑制,其中TrkA的点突变(TrkAF592A)使突变小鼠容易受到小分子1NMPP1介导的TrkA催化活性抑制(图4a)。TrkAF592A突变小鼠的HO位点神经分布明显减少(图4b-d)。 接下来使用CD31免疫荧光染色评估TrkAF592A突变动物的损伤部位血管。结果显示,在TrkA抑制的情况下,HO部位的血管生成明显受损(图4e-f),总体染色强度降低65.1%(图4g)。随后进行Emcn和CD146共免疫荧光染色和定量(图4h-j)。在TrkA突变小鼠中观察到类似的损伤部位血管的减少,包括Emcnhigh血管数量的显著减少(损伤后21天减少84.8%),以及CD146(损伤后21天减少85.9%)。接下来,在形成HO期间,通过口服小分子抑制剂AR786给野生型小鼠实现TrkA抑制(图4k)。 已有的研究证明,AR786导致HO诱导后软骨数量显著减少(损伤后21天减少69.3%)。AR786处理后抑制TrkA导致损伤部位神经支配显著减少(图4l-n),同时也导致了血管密度的显著降低(图4o-q)。因此,抑制表达 TrkA 的感觉神经向内生长的三种方法导致四肢损伤相关血管生成的显著缺陷,进一步支持肌肉骨骼创伤后神经元到内皮信号传导。 图4. TrkA信号传导的遗传和药理学抑制损害了软组织损伤后的血管向内生长 05 创伤性HO在感觉神经元中激发促血管生成基因谱 接下来,他们尝试确定在感觉神经群中丰富的潜在血管生长因子。首先,对小鼠(8-12周龄C57BL/6 J小鼠)背根神经节(DRG)细胞的scRNA-Seq数据集进行重新分析。根据特异性标志物的表达,鉴定出神经丝细胞(NF)、肽能伤害感受器(PEP)、非肽能伤害感受器(NP)和酪氨酸羟化酶(TH)4种主要细胞聚类(图5a-b)。Ntrk1(编码TrkA)在肽能细胞中发现,在NF细胞中发现较少(图5b)。接下来,在此数据集中检测候选分泌的促血管生成因子,热图演示显示了跨细胞聚类的独特的血管生成基因谱(图5c)。在Ntrk1low的NF神经元中,Sema5a、Fgf18、Fgf1、Vegfc和Wnt5a表现出富集。在Ntrk1high PEP神经元中,Vegfa和Pdgfa等均有富集。通过模块评分分析证实了表达Ntrk1的神经元高表达血管生成调控基因的印象,其中NF和PEP神经元聚类与不表达Ntrk1的细胞聚类相比,具有较高的相对血管生成相关基因(图5d)。 建立了一组在小鼠感觉神经元中原位表达的分泌的促血管生成因子,他们接下来检测了HO诱导后这些因子在多大程度上通过支配感觉神经过度表达(图5e-h)。与未受伤的对照动物相比,HO诱导3天后采集同侧腰椎DRG(图5e)。通过qRT-PCR对15个促血管生成基因的分析显示,大多数候选基因是动态调节的,15个基因中有7个发生了显著变化(图5f)。HO诱导后相对表达量增加最多的基因包括Fgf18、Pdgfc、Vegfa和Vegfd(图5)。为了证实这些转录变化,在同侧腰椎水平的DRG中对这些因子的免疫荧光染色。结果证实,在支配DRG的HO部位,所有四种促血管生成蛋白的免疫染色均相对增加(图5h)。 图5. TrkA+ 周围神经在软组织创伤后表达关键的血管生成基因 06 HO诱导导致抗血管生成环境的丧失 为了更好地了解局部组织中存在的神经源性血管生成因子和潜在抗血管生成因子之间的潜在平衡,他们继续汇总HO诱导位点的scRNA-Seq数据集,在损伤后0、7和21天进行分析(图6)。通过特征基因标记鉴定出七个基本细胞聚类,包括间充质祖细胞(MPC)、内皮细胞、周细胞、雪旺细胞、免疫细胞、骨骼肌细胞和淋巴内皮细胞(图6a-b),确定了MPC 的整体转录富集(图6c-d)。他们接下来研究了损伤后随时间的因子表达变化(图6e-f)。对MPC聚类的进一步分析显示,损伤后第7天,总体抗血管生成分子表达显著降低,并在第21天开始恢复到基础水平(图6e)。在所分析的8个基因中,基因Ifng和Il18在未损伤组织的MPC中表达上调最多,而基因Serinf1和Timp2在基线和第21天均表达较高。最后,在第21天,Lect1和Tnni3上调,这可能表明在愈合和肌腱再生的解决中具有特定作用(图6f)。 图6. HO诱导抑制抗血管生成表型,损伤后0、7和21天获得的损伤部位汇总细胞的单细胞RNA测序分析 + + + + + + + + + + + 结 论 本项研究发现在四肢损伤相关的异位骨化中存在高度的神经血管一致性。通过单细胞 RNA 测序评估,血管和血管周围细胞表现出对损伤的特征性反应。这种血管对损伤的反应在神经切除小鼠中减弱,包括内皮增殖和 H 型血管形成的减少,以及与血管生成相关的关键转录网络的下调。化学或遗传抑制轴突向内生长的独立机制导致 HO 位点血管生成的类似缺陷、H 型血管的减少和异位骨形成。最后,背根神经节内单细胞转录组学方法的组合确定了可能介导 HO 中神经元至血管信号传导的关键神经源性血管生成旁分泌因子。这些数据提供了对受伤软组织中神经与血管相互作用的进一步了解,这可能反映了损伤后间充质祖细胞命运的关键决定因素。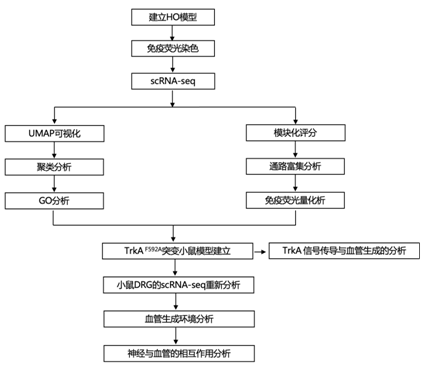



 English
English


