文献解读|Cell(45.5):持续的染色体碎裂是骨肉瘤基因组复杂性和克隆进化的基础
✦ +
+
论文ID
原名:Ongoing chromothripsis underpins osteosarcoma genome complexity and clonal evolution
译名:持续的染色体碎裂是骨肉瘤基因组复杂性和克隆进化的基础
期刊:Cell
影响因子:45.5
发表时间:2025.01.23
DOI号:10.1016/j.cell.2024.12.005
背 景
肿瘤全基因组测序 (WGS) 研究表明,大多数人类癌症都充满了复杂的结构变异形式。驱动癌症基因组复杂性的主要突变过程是染色体碎裂,染色体碎裂是指由于微核中的染色体碎裂 或在后期桥分解过程中双着丝粒染色体的碎片而导致一条或几条染色体获得数十到数百个聚集重排。染色体碎裂在各种癌症类型中普遍存在,并且常常介导恶性转化和耐药性。以染色体碎裂为特征的癌症的一个显著例子是骨肉瘤,它是最常见的骨原发性恶性肿瘤,四十多年来其治疗选择和存活率一直未得到改善。虽然骨肉瘤的核型复杂性早已确定,但骨肉瘤基因组复杂性的根本机制以及染色体碎裂对肿瘤进展过程中癌症基因组进化和克隆异质性的影响仍然不清楚。
实验设计
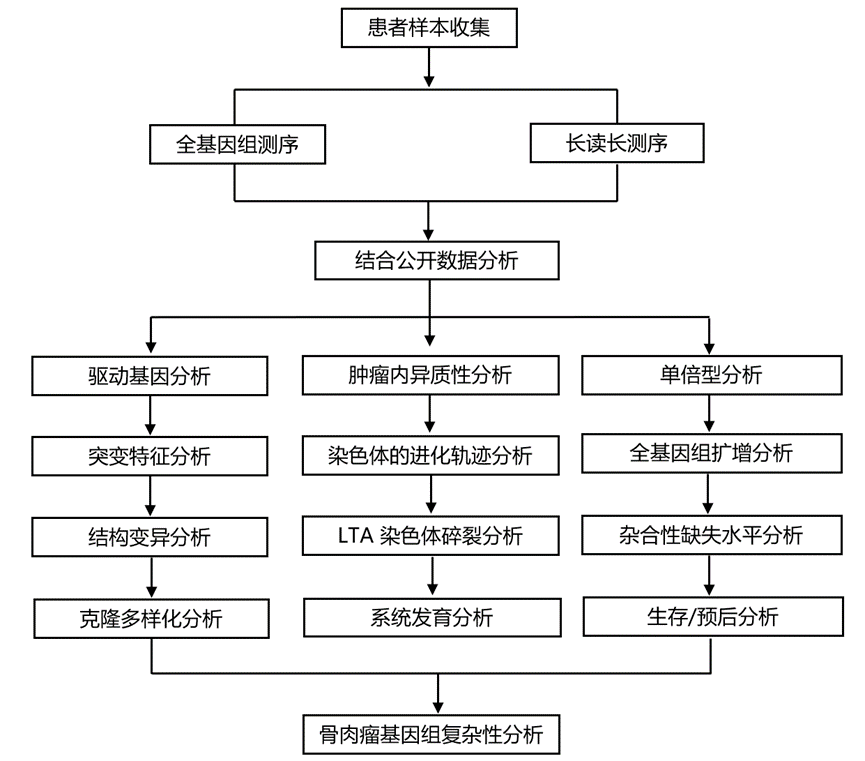
结 果
01
骨肉瘤的克隆进化是由复杂的基因组重排驱动的
研究团队对来自 197 位患者的 356 个原发性和转移性骨肉瘤样本进行了统一的 WGS 数据处理,包括 128 个肿瘤样本的已发表数据(图1 A),该数据包括85 位骨肉瘤患者的 228 个肿瘤区域的高深度多区域 Illumina WGS(每个肿瘤 2-8 个区域;中位数 4 个区域),以及来自原发性骨肉瘤不常见组织学变体的 13 个样本。最终数据集包括 246 例高级别传统 (HGOS)、43 例骨旁骨肉瘤、15 例骨膜骨肉瘤、9 例低级别中心骨肉瘤和 30 例软组织骨外骨肉瘤,以及 13 例富含破骨细胞的原发性高级别骨肉瘤。此外,他们对 6 例 HGOS 病例的 23 个区域进行了多区域纳米孔 WGS分析,并对另外 12 例 HGOS 病例进行了单区域纳米孔 WGS分析。患者平均年龄为 30 岁(范围 4-89 岁;40% 的患者年龄在 18 岁以下),40% 的样本来自用 MAP 化疗方案(甲氨蝶呤、阿霉素和顺铂)或其变体治疗的肿瘤。
驱动基因分析确定了已知与骨肉瘤进化有关的基因,包括TP53(在 136/197 个肿瘤中发生改变,69%,主要由于内含子 1 的重排)、RB1(58/197,29%)和CDKN2A(32/197,16%)(图1 B)。他们估计平均负担为每 Mb 1.85 个单核苷酸变异(SNV),这与之前报道的骨肉瘤点突变负担较低相一致。然而,在74 % 的肿瘤(145/197)中检测到了 kataegis 事件,表明突变积累存在间断爆发(图 1 C)。他们在 53% (104/197) 的肿瘤中检测到与激活端粒替代延长 (ALT) 途径相关的基因组特征,表明该途径在驱动骨肉瘤的复制中起主要作用。在 HGOS 病例中,15% 没有TP53途径基因(即TP53和MDM2)的改变。与TP53突变的 HGOS相比,这些病例没有显示其他驱动改变的突变富集,但显示出染色体外环状 DNA (ecDNA)、kataegis 和复杂 SV 聚类的发生率显著降低,统称为复杂基因组重排 (CGR)。平均而言,55% 的 SNV 是亚克隆的(中位数为 53%),这表明肿瘤内异质性水平很高。然而,大多数驱动突变都是克隆的,没有检测到亚克隆突变中的正向选择,这表明在点突变水平上亚克隆进化是中性的。单碱基替换 (SBS) 的从头突变特征分析显示,除与铂类疗法相关的特征(SBS31 和 SBS35)外,所有检测到的特征都显示出对克隆和亚克隆突变的贡献。铂类相关特征揭示了复发和转移样本中由单个化学耐药克隆驱动的克隆以及治疗后原发性肿瘤中多个亚克隆的存活和生长。
与 SNV 相反,结构变异(SV)负担很高,每个肿瘤的中位数为 414 个 SV。然而,只有 11% (54/502) 的 CGR 归类为典型染色体碎裂事件。其余的与其他事件(例如 ecDNA 和片段扩增)共定位(图 1C),掩盖了典型染色体碎裂特有的振荡拷贝数模式。HGOS 肿瘤显示出较高的全基因组加倍 (WGD) 率(99/141 个肿瘤;70%)和 CGR 率(131/141 个肿瘤;93%),高水平致癌基因扩增常发生在 CGR 的背景下(图1 C)。在骨旁骨肉瘤中,所有病例中MDM2和CDK4的共同扩增都映射到 ecDNA 事件。在 HGOS 中,57% ( 81/141) 的肿瘤至少有一个高水平致癌基因扩增;这些在具有 CGR 的染色体臂中显著富集并与折回倒位相关,表明 HGOS 中的致癌基因扩增是由断裂-融合-桥 (BFB) 循环驱动的(图 1 C)。
为了表征染色体碎裂对骨肉瘤克隆和基因组进化的贡献,他们利用来自 46 个肿瘤的多区域 WGS 数据和来自 10 个个体的多个肿瘤样本的 WGS 数据构建了肿瘤系统发育树(图 1 D),根据 SV 是在全部、子集还是仅在所分析的其中一个肿瘤区域中检测到,将 SV 分为主干性(truncal)、共有性(shared)和特有性 (private)。他们发现 62% (130/210) 的肿瘤区域和 74% (40/54) 的肿瘤显示共有或特有染色体碎裂事件,通常导致高度不同的核型(图 1 E,图2A-D)。因此,这些结果表明染色体碎裂是一种常见的亚克隆突变过程,它塑造了骨肉瘤的克隆和癌症基因组进化。
先前的研究表明,染色体碎裂可以先于或随后发生,并且重排的染色体容易受到持续的基因组不稳定性的影响。然而,研究重排染色体的进化轨迹一直具有挑战性,因为在批量 WGS 数据中亚克隆 SV 检测的灵敏度有限,并且缺乏人类肿瘤的多区域或单细胞 WGS 数据。在这里,为了研究受 CGR 影响的染色体的进化轨迹,他们使用多区域 WGS 数据绘制了整个基因组中的 SV 速率。该分析显示,具有主干 CGR 的基因组区域在共有和特有 SV 中显著富集,表明 CGR 为癌症基因组的持续染色体不稳定性做好了准备(图 1F-G)。典型染色体碎裂事件不会获得共有和特有 SV(图 1 H)。然而,他们在受主干染色体碎裂影响的基因组区域中检测到数百个共有和特有 SV,并伴有节段性扩增,即使主干染色体碎裂事件仅影响基因组的一小部分(图 1 E-F)。高水平扩增显示出由共有和特有重排引起的显著异质性,包括向多个染色体的易位。
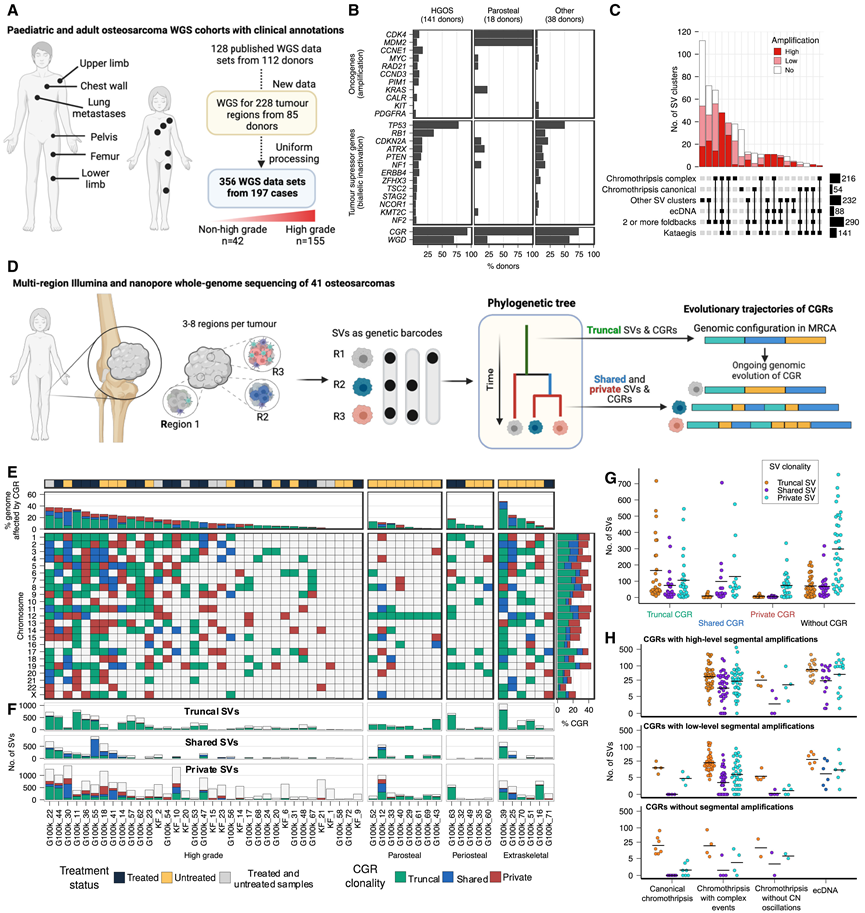
图1. 肿瘤内异质性和染色体碎裂的进化轨迹。
(A) 本研究分析的骨肉瘤样本的数据集和类型概述。(B) 高级别骨肉瘤 (HGOS)、骨旁骨肉瘤和其他骨肉瘤亚型中致癌基因扩增、肿瘤抑制基因双等位基因失活、复杂基因组重排 (CGR) 和全基因组加倍 (WGD) 的频率。(C) 翻转图显示 ShatterSeek 检测到的 SV 聚类中不同类型的复杂重排模式在队列中所有骨肉瘤中的重叠。(D) 基于多区域全基因组测序的实验设计示意图,用于表征骨肉瘤肿瘤内异质性和克隆进化的模式。(E) CGR 在常染色体和 X 染色体上的分布。(F) CGR 的基因组区域的SV 数量。(G) 映射到受CGR 影响的区域以及受 CGR 影响的SV 的数量。(H)映射到具有典型染色体碎裂、具有其他复杂事件的染色体碎裂、没有拷贝数振荡的染色体碎裂事件的区域的SV 的数量,以及基于 SV 聚类中存在高水平、低水平或无节段扩增而分层的 ecDNA。
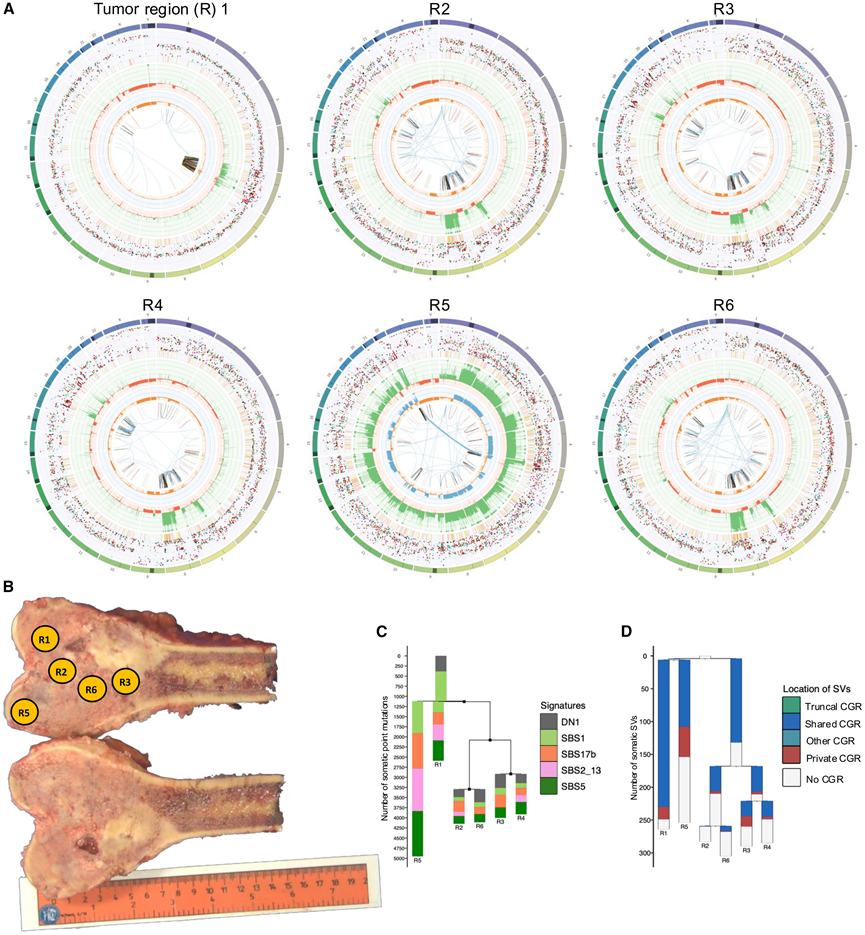
图2. 染色体碎裂导致骨肉瘤的克隆多样化和核型异质性。
(A) Circos 图表示在病例 G100k_41 的六个肿瘤区域 (R) 的 WGS 数据中检测到的体细胞畸变状况。(B) 病例 G100k_41 的原发性肿瘤宏观图像。(C-D) 使用在病例 G100k_41 的多区域 WGS 数据中检测到的体细胞 SNV 或 SV 构建的系统发育树。
02
重排染色体的进化轨迹
为了进一步研究除骨肉瘤外,染色体碎裂是否是肿瘤进化过程中的持续过程,他们对 43 种软组织和其他骨肉瘤亚型的 136 个区域进行了多区域 WGS,这些亚型的特点是基因组复杂程度各异(每个肿瘤中位数 3 个区域)。具体来说,他们对非融合驱动的肉瘤进行了 WGS,包括 16 个粘液纤维肉瘤的 43 个区域、10 个软骨肉瘤的 29 个区域和 10 个恶性周围神经鞘瘤 (MPNST) 的 39 个区域。利用该数据集,证实了染色体碎裂在亚克隆中发生率很高(图 S3 A-C)。他们发现 74% (32/43) 的肿瘤出现共有和特有染色体碎裂事件。此外,他们在 66% (90/136) 的肿瘤区域中检测到了共有和特有的染色体碎裂事件。总之,这些结果表明染色体碎裂在组织学上多样化的软组织和骨肉瘤中在亚克隆水平上塑造了癌症基因组的进化。
接下来,他们研究了由最近的共同祖先 (MRCA) 中的染色体碎裂事件产生的衍生染色体在基因组上不稳定的现象是否也发生在骨肉瘤以外的软组织和骨肉瘤中。为此,他们以与多区域骨肉瘤 WGS 数据集相同的方式分析了来自软组织肉瘤的多区域 WGS 数据。他们发现数十到数百个共有和特有 SV 映射到受主干染色体碎裂影响的基因组区域(图 3A-G)。这些结果表明,染色体碎裂事件为各种软组织和骨肉瘤中的癌症基因组持续的基因组不稳定性做好了准备。总之,这些结果表明,由染色体碎裂事件产生的衍生染色体是不稳定的,并通过复杂的重排过程进化,从而驱动肿瘤内异质性和克隆多样化。
接下来,他们试图研究由染色体碎裂事件产生的衍生染色体在肉瘤以外的癌症类型中是否具有基因组不稳定性。为此,他们统一分析了来自癌症基因组图谱 (TCGA) 的 5239 个肿瘤-正常的配对 WGS 数据,涵盖了不同的癌症类型。首先,他们使用 ShatterSeek技术在整个队列中检测了 CGR,包括染色体碎裂事件。在 60%的肿瘤中检测到了染色体碎裂或其他 CGR。他们发现 17% 的肿瘤存在典型的染色体碎裂事件,33% 存在伴有其他复杂重排的染色体碎裂,44%的 CGR 不存在拷贝数振荡而归类为染色体碎裂(图 S3 D)。接下来,通过识别受染色体碎裂或 CGR 影响的基因组区域中的晚期发生和亚克隆 SV 来调查是否存在持续的基因组不稳定性。在泛癌症水平上,他们观察到 47%的伴有其他复杂事件的染色体碎裂、5% 的典型染色体碎裂事件和 31% 的其他 CGR 中存在持续基因组不稳定性。与在骨肉瘤中的结果一致,典型染色体碎裂区域的持续不稳定率较低,这些区域仅占癌症基因组中检测到的染色体碎裂事件的少数(图 S3 E)。相比之下,在表现出节段性扩增的染色体碎裂事件中,衍生染色体容易持续获得重排。综上所述,这些结果表明衍生染色体中持续的基因组不稳定性普遍存在于各种癌症类型中(图 S3 E)。此外,这些发现表明,在染色体碎裂事件中观察到的复杂的节段性扩增模式无法通过当前的染色体碎裂模型完全解释,是由衍生染色体持续的基因组不稳定性产生的。
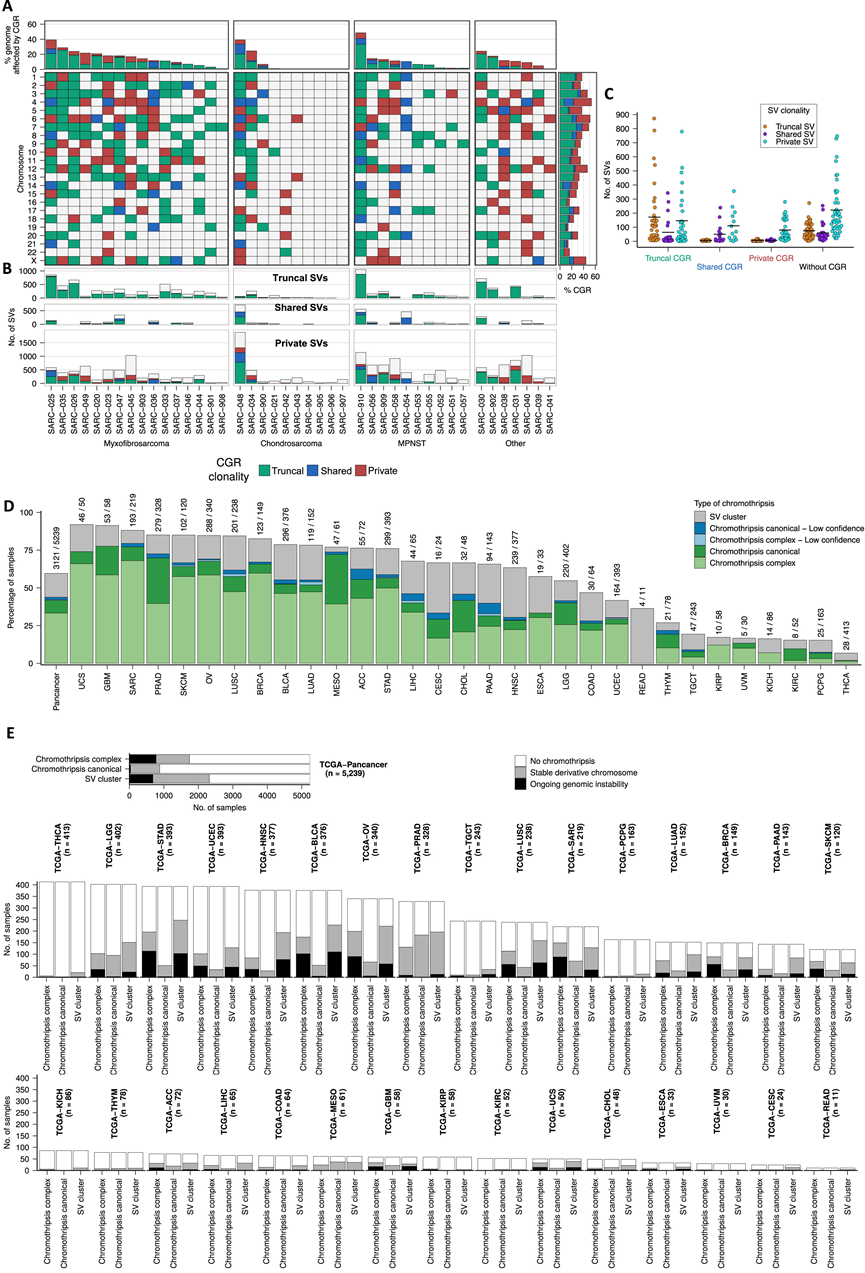
图S3. 除骨肉瘤外的软组织和骨肉瘤中受主干 CGR 影响的肿瘤内异质性和染色体的进化轨迹。
(A) CGR 在常染色体和 X 染色体上的分布。(B) SV 数量分析。(C) 映射到受CGR 影响的区域以及受 CGR 影响的SV数量。(D) 涵盖 31 种癌症类型的 5239 个 TCGA 肿瘤的染色体碎裂和复杂基因组重排的发生率。(E) 涵盖 31 种癌症类型的 5239 个 TCGA 肿瘤的染色体碎裂和复杂基因组重排(包括低置信事件)的发生率。
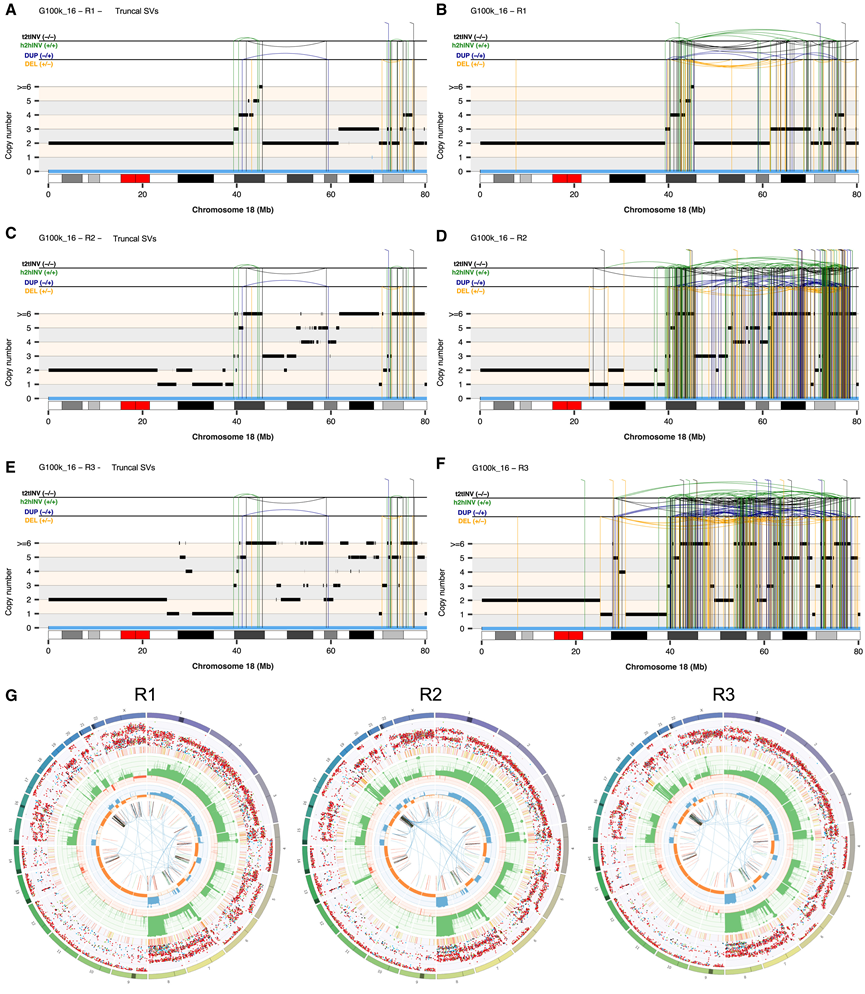
图3. 骨肉瘤G100k_16中CGR影响的染色体进化轨迹。
(A-F) 使用病例 G100k_16 的肿瘤区域 R1、R2 和 R3 的体细胞 SV 和拷贝数信息计算的 18 号染色体重排图谱。(G) Circos 图表示在区域 R1、R2 和 R3 的 WGS 数据中检测到的体细胞畸变状况。
03
缺失-易位-扩增 (LTA) 染色体碎裂引发间断性肿瘤演变
鉴于 HGOS 中 SV 的负担很高,他们接下来试图识别受断点反复影响的基因组区域。与之前的研究一致,TP53基因座在成人和儿童 HGOS 的重排断点中均富集(图 4 A)。对 17 号染色体重排谱的调查显示,17p 末端丢失(包括TP53基因座)和TP53下游 17p 中大小不等的基因组区域片段性扩增频繁同时发生,同时还跨越一条或多条染色体上的其他基因组区域(图 4 A)。使用在多区域 WGS 数据中检测到的 SNV 和 SV 重建的肿瘤系统发育分析表明,17p 染色体上的单个双链断裂(常见于TP53的内含子 1 中)会产生一个不受保护的末端,该末端在有丝分裂期间易位到另一条染色体或其姊妹染色单体以形成双着丝粒染色体,该染色体的分解会触发一系列 BFB 循环,从而产生节段性扩增(图 4 B)。因此,来自多个染色体的基因组区域和致癌基因可以在多次细胞分裂中作为此过程的一部分进行扩增。他们在 48% (68/141) 的 HGOS(包括所分析的所有队列中的儿童和成人 HGOS)中检测到了这种重排模式,他们将其称为丢失-易位-扩增 (LTA) 染色体碎裂(图 4 A-B)。具体而言,他们在 48% (48/99) 的患有 WGD 的 HGOS 病例和 48% 的不患有 WGD 的 HGOS 病例(20/42)中检测到了 LTA 染色体碎裂。值得注意的是,在 LTA 染色体碎裂病例中,SV 负担和涉及染色体碎裂的染色体数量明显较高(图 4 C-D),这表明骨肉瘤中最复杂的染色体碎裂事件是由 LTA 染色体碎裂引起的。在 66% (45/68) 出现 LTA 染色体碎裂的 HGOS 中(占所有 HGOS 的 32%),扩增区域包含致癌基因,通常以 ecDNA 的形式出现,这表明 LTA 染色体碎裂是 HGOS 中致癌基因扩增的常见机制(图 4 G-E)。在另外 23 例中,衍生染色体的复杂性相当,但 LTA 引起的节段性扩增不包括反复扩增的致癌基因。LTA 染色体碎裂发生在一个TP53等位基因已因体细胞点突变(24%)、体细胞重排(71%)和种系致病变异(6%)而失活的细胞中。
与其他人类染色体相比,17p 染色体的端粒长度最短。因此,他们假设,TP53内或下游的初始双链断裂(引发 LTA 染色体碎裂)可能是由端粒危机背景下 17p 染色体的两个姐妹染色单体融合导致双着丝粒染色体分解所致。为了验证这一假设,他们使用来自肿瘤和匹配的血液样本的WGS数据定量了端粒长度。无论是使用肿瘤还是匹配的正常 WGS数据量化端粒长度,他们均未发现有和无 LTA 病例之间的端粒长度存在显著差异。因此,虽然不能完全排除某些 LTA 事件可能是由端粒磨损导致的双着丝粒染色体分解引发的可能性,但这些结果表明,由 17 号染色体的野生型拷贝与其姐妹染色单体的端到端染色体融合引起的双着丝粒染色体分解可能不是 LTA 染色体碎裂的唯一诱因。
从肿瘤系统发生推断出 LTA 染色体碎裂的 HGOS 中的克隆动态模式与间断进化模型一致。具体而言,宏观上相距几厘米的肿瘤区域仅共有一小部分点突变和引发 LTA 染色体碎裂的重排,这些重排显示出较高的等位基因分数值(图4G,图5A-E)。除主干SNV 之外的区域之间缺乏共有突变,随后出现多个亚克隆,中间分支很少或没有,这与快速的克隆多样化相一致。因此,TP53基因座中单个双链断裂后由 LTA 染色体碎裂引发的基因组不稳定性级联促使克隆快速多样化和肿瘤内异质性。
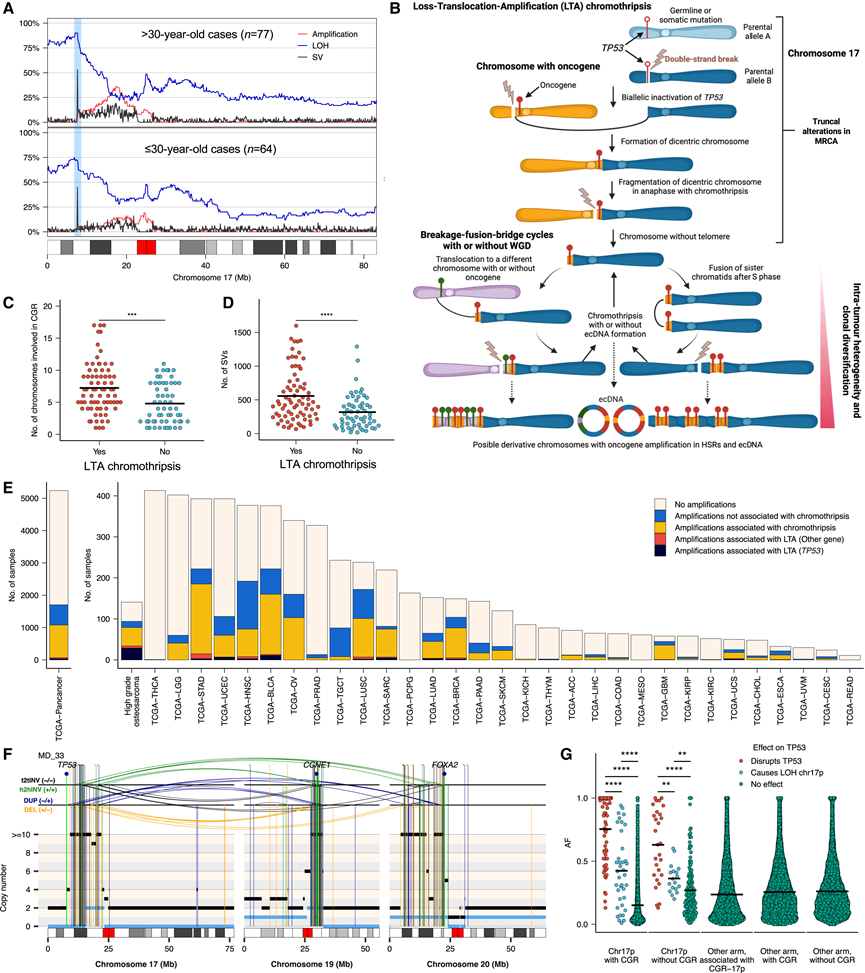
图4. 高级别骨肉瘤中LTA染色体碎裂的机制。
(A) 分析 17 号染色体上出现扩增(红色)、杂合性缺失 (LOH)(蓝色)和 SV(黑色)的儿童和成人骨肉瘤比例。(B) 导致TP53缺失的事件和在高级别骨肉瘤中观察到的致癌基因扩增的示意图。(C) 高级别骨肉瘤中 CGR 所涉及的染色体数量,根据TP53基因座断点触发的 17p 染色体上 CGR 的存在进行分层。(D) 根据TP53基因座断点触发的 17p 染色体上 CGR 的存在情况,对高级别骨肉瘤中整个基因组中检测到的 SV 数量进行分层。(E) 涵盖 31 种癌症类型的 5239 个 TCGA 肿瘤的致癌基因扩增和 LTA 染色体碎裂事件的发生率。(F) 骨肉瘤的代表性重排谱,其中双链断裂导致TP53失活,从而通过 LTA 染色体碎裂导致多个致癌基因扩增。(G) 检测到的映射到 CGR 的重排的等位基因分数 (AF) 。
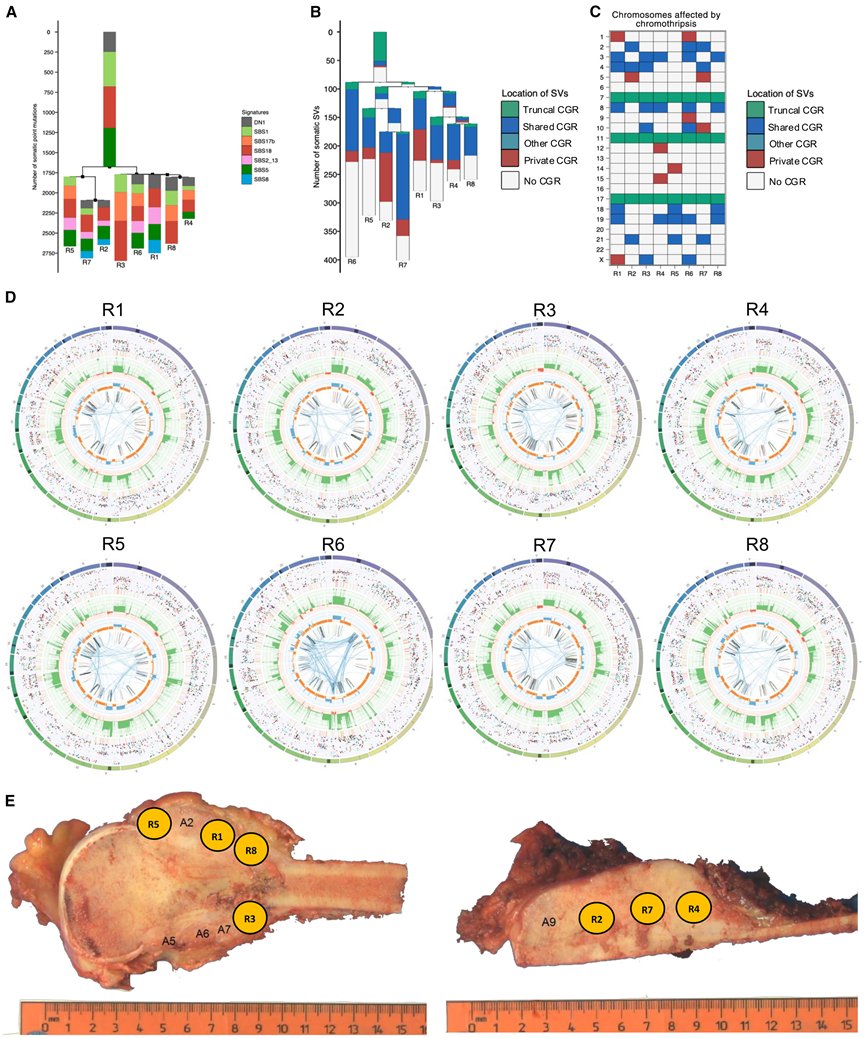
图5. 高级别骨肉瘤G100k_30的肿瘤内异质性及系统发育分析。
(A-B) 使用在病例 G100k_30 的多区域 WGS 数据中检测到的体细胞 SNV(A)或 SV(B)构建的系统发育树。(C) CGR 在染色体和肿瘤区域的分布。(D) Circos 图表示在病例 G100k_30 的八个肿瘤区域 (R) 的 WGS 数据中检测到的体细胞畸变状况。(E) 病例 G100k_30 的原发性肿瘤宏观图像。
04
使用长读测序对 LTA 染色体碎裂进行单倍型分析
为了进一步评估染色体碎裂事件是否会使癌症基因组陷入持续的基因组不稳定性,他们对 SV 进行了单倍型分析。通过 SAVANA 检测到的单倍型解析 SV,确认了只有一个等位基因受到 MRCA 中的 LTA 染色体碎裂的影响,因为映射到主干染色体碎裂区域的大多数 SV 都分配到相同的亲本等位基因。接下来,他们利用读取定相信息来测试在肿瘤进化后期积累的 SV(即共有或特有 SV)是在受主干染色体碎裂影响的染色体拷贝中获得的还是在两个亲本等位基因中获得的。在受主干染色体碎裂影响的亲本等位基因中检测到的 SV 率明显较高,这与染色体碎裂为正在进行的基因组进化准备衍生染色体的现象相一致。大多数私有和特有 SV 都映射到受主干染色体碎裂影响的亲本等位基因(图 6A-F)。此外,使用多区域长读测序数据对衍生染色体进行单倍型分析基因组组装表明,主干和非主干 SV 都会改变相同的亲本等位基因(图 6 A-D)。总之,这些结果表明,MRCA 中主干染色体碎裂产生的衍生染色体为持续的基因组不稳定性做好了准备,从而导致获得数十到数百个晚发生的 SV。
接下来使用长读数据来评估作为 LTA 染色体碎裂过程的一部分,在 17 号染色体以外的染色体中扩增的基因组区域是否整合在 17 号染色体内。分别使用单倍型分析基因组组装和 CoRAL 45对衍生染色体和高度扩增区域进行重建,结果显示,参与 LTA 过程的染色体的基因组区域与 17 号染色体的基因组区域交错在一起(图6C-F),这与 LTA 染色体碎裂模型一致(图 4B)。
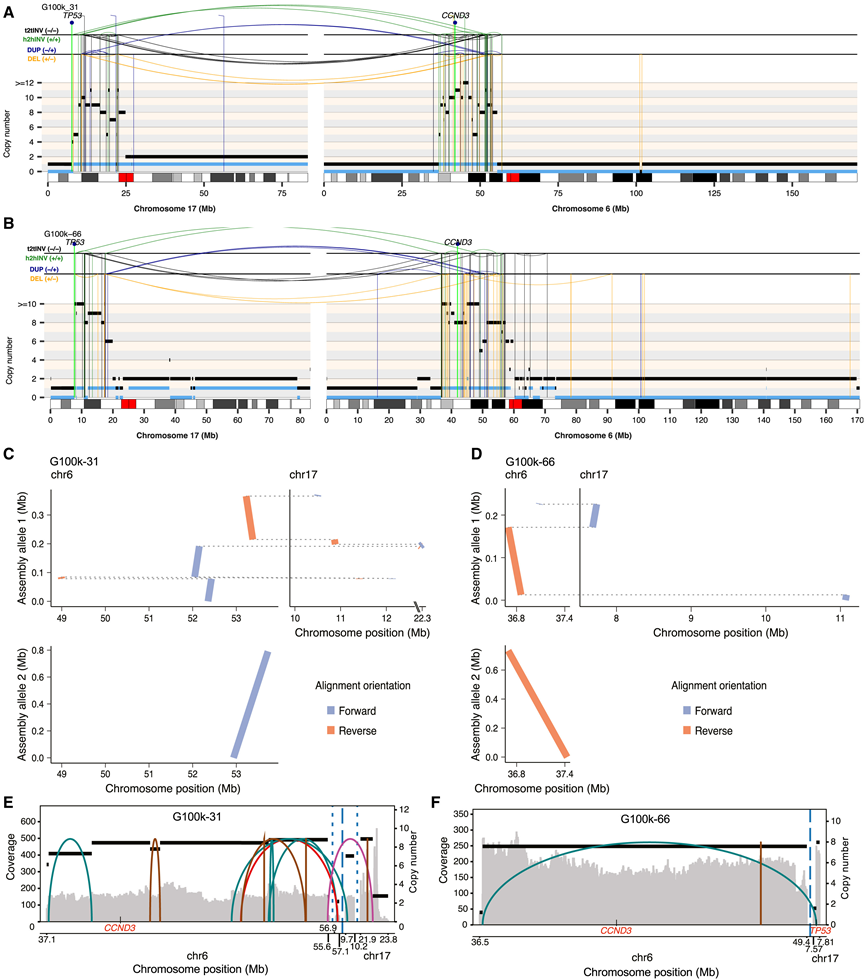
图6. 高级别骨肉瘤中多染色体LTA染色体碎裂事件的重建和组装。
(A-D) 使用来自高级别骨肉瘤 G100-31和 G100-66 的 Illumina WGS 数据重建的 LTA 染色体碎裂事件中 6 号和 17 号染色体的体细胞 SV 和体细胞拷贝数谱。使用纳米孔全基因组测序数据对 G100-31和 G100-66中检测到的 LTA 染色体碎裂事件进行单倍型解析组装。(E-F) 使用 CoRAL 重建G100-31和 G100-66 中CCND3扩增子的结构。
05
WGD是引发基因组不稳定性的晚期克隆事件
受骨肉瘤中 WGD 高频率影响(图 1B),他们接下来试图确定骨肉瘤进化过程中获得的基因组畸变的时间和相对顺序,通过计算和实验确定的 WGD在 96% (53/55) 的肿瘤中是晚期事件,WGD 平均发生在突变时间的 80%(图 7 A)。HGOS 和其他骨肉瘤亚型之间的 WGD 时间没有显著差异(图 7 B)。然而,儿童和成人 HGOS 病例的 WGD 时间以及 WGD 与 MRCA 扩张之间的潜伏期均有显著差异(图 7 C-D)。他们估计 40 岁以下患者的 WGD 与 MRCA 扩张之间的平均潜伏期为 0.6 年,而 40 岁以上患者的潜伏期为 1.7 年(图 7 A)。这些结果与全基因组泛癌分析 (PCAWG) 项目的结果一致,与其他癌症类型相比,WGD 和 MRCA 出现之间的时间间隔相对较短。在 LTA 染色体碎裂的肿瘤中,他们在 17p 的末端区域(包括TP53基因座)检测到了杂合性缺失 (LOH) ,这表明 LTA 可能先于 WGD,否则需要发生两次独立的 LTA 事件才能导致 17p 的两个末端拷贝缺失。因此,在这些肿瘤中,WGD 发生在 LTA 染色体碎裂的初始步骤和 MRCA 扩增之间的短暂间隔内。
接下来,他们根据重排和拷贝数信息定义了一个评分系统,以确定介导致癌基因扩增的 CGR 是发生在全基因组扩增之前还是之后。总体而言,在 99% (815/825) 的 CGR 中,每个染色体臂的大多数断点发生在全基因组扩增之后。在其中 11% 的事件中,至少 5 个断点发生在全基因组扩增之前,这表明存在初始的全基因组扩增前重排事件。在重排水平上,预测只有 0.4%的与致癌基因扩增相关的折回倒位会在全基因组扩增之前发生(图7E-H)。这些结果与体外研究一致,表明全基因组扩增会导致染色质重塑和基因组不稳定性以及在全基因组扩增肿瘤中观察到的更高染色体碎裂率。相比之下,与肿瘤抑制基因丢失相关的 SV 始终发生在全基因组重排之前。总之,这些结果表明全基因组重排是一个晚期克隆事件,可导致染色体不稳定和致癌基因扩增。
鉴定出可靠的生物标志物以便进行准确预测从而为临床决策提供信息仍然是骨肉瘤的迫切临床需求。先前基于 SNP 阵列的研究发现了高全基因组水平的 LOH 与预后之间的关联。然而,这种生物标志物和其他生物标志物尚未在大型队列中得到风险分层的验证。为了评估基因组畸变的预后能力,他们使用多种基因组和临床协变量对 HGOS 进行了生存分析。在校正已知影响生存的协变量(例如诊断时的转移)的单变量和多变量分析中,全基因组 LOH 水平是唯一与疾病进展显著相关的基因组事件(图 7 I-K)。
据报道,在胰腺导管腺癌小鼠模型中,TP53失活后染色体丢失先于全基因组缺失。50使用多区域全基因组测序数据,他们估计 60%(95% CI:52%-68%)的 LOH 基因组区域在肿瘤的所有区域都是共同的,这表明 LOH 是全基因组缺失之前的早期事件。HGOS 肿瘤的 LOH 水平明显高于低级别病例(平均分别为 32% vs. 14%;p < 0.001,Wilcoxon 秩和检验)。与其他癌症类型相比,他们检测到了与全基因组缺失状态无关的高水平 LOH(图 7 K)。他们发现 LOH 区域必需基因失活突变的消耗,提示存在负选择。
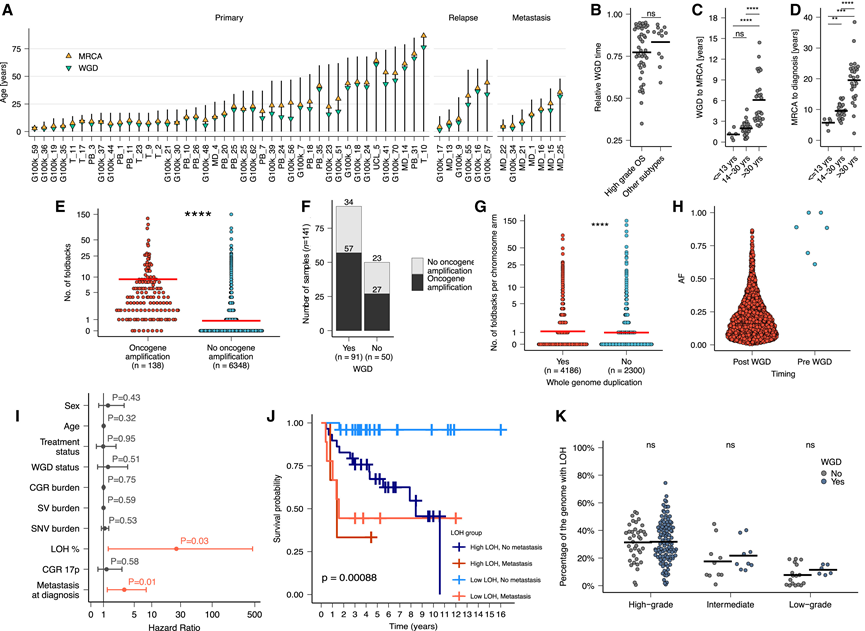
图7. 高级别骨肉瘤的全基因组加倍、致癌基因扩增和全基因组LOH分析。
(A) 儿童和成人高级别骨肉瘤进化过程中最近共同祖先 (MRCA) 和 WGD 出现的时间估计。(B) 高级别骨肉瘤和其他亚型(骨旁、骨外、骨膜和低级别中心)的 WGD 事件的相对时间估计。(C) 儿童和成人骨肉瘤中 WGD 与 MRCA 出现之间的年数。(D) 儿童和成人骨肉瘤 MRCA 出现与诊断之间的年数。(E) 根据同一染色体臂中是否存在致癌基因扩增事件进行分层的每个染色体臂的折返倒位次数。(F) 根据 WGD 状态分层的显示致癌基因扩增的 HGOS 肿瘤部分。(G) 根据 WGD 状态分层的 HGOS 肿瘤中每个染色体臂的折回倒位数量。(H) 折返反转的 AF 根据其估计发生在全地大爆发之前还是之后进行分层。(I) 多变量生存分析。(J) 全基因组杂合性缺失 (LOH) 可预测 HGOS 患者的总体生存率。(K) G100k 和 TARGET 队列中高、中、低级别骨肉瘤中显示 LOH 的基因组百分比,根据 WGD 的存在进行分层。
+ + + + + + + + + + +
结 论
通过多区域全基因组测序,本研究发现染色体碎裂是一个持续的突变过程,74% 的骨肉瘤以亚克隆方式发生。染色体碎裂会产生高度不稳定的衍生染色体,染色体的持续进化会驱动致癌突变的获得、克隆多样化以及不同肉瘤和癌的肿瘤内异质性。此外,本研究描述了一种LTA染色体碎裂的新机制,该机制介导大约一半的儿童和成人高级别骨肉瘤的间断进化。当单个双链断裂通过断裂-融合-桥循环触发同时发生的TP53失活和致癌基因扩增时,就会发生 LTA 染色体碎裂。它在骨肉瘤中尤其常见,在由TP53突变驱动的其他癌症中未检测到。最后,本研究确定全基因组杂合性缺失水平是高级别骨肉瘤的有力预后指标。
+ + + + +



 English
English


