文献解读|Nat Commun(14.7):人类和小鼠蛋白质组学揭示了阿尔茨海默病和淀粉样蛋白组中蛋白质周转延迟的共同途径
✦ +
+
论文ID
原名:Human and mouse proteomics reveals the shared pathways in Alzheimer’s disease and delayed protein turnover in the amyloidome
译名:人类和小鼠蛋白质组学揭示了阿尔茨海默病和淀粉样蛋白组中蛋白质周转延迟的共同途径
期刊:Nature Communications
影响因子:14.7
发表时间:2025.02.11
DOI号:10.1038/s41467-025-56853-3
背 景
阿尔茨海默病 (AD) 是一种进行性神经退行性疾病,是导致痴呆的最常见原因,影响着 600 多万美国人。AD 病理在出现明显行为症状前几十年就已开始,主要表现为 β-淀粉样肽 (Aβ) 在细胞外斑块中聚集,以及 tau 蛋白过度磷酸化形成细胞内神经原纤维缠结。除 Aβ 和 tau 外,其他共存的分子变化,如 α-突触核蛋白、TDP-43和 U1 snRNP,可能在疾病进展中发挥重要作用。 AD 和对照病例的基因分析已阐明了三种致病基因(APP、PSEN1和PSEN2)、高风险基因(APOE4和TREM2)以及大约 100 个低风险基因和位点。然而,这些蛋白质/基因在 AD 发展中的分子机制尚未完全了解,通常是由于缺乏合适的细胞或动物模型。
实验设计
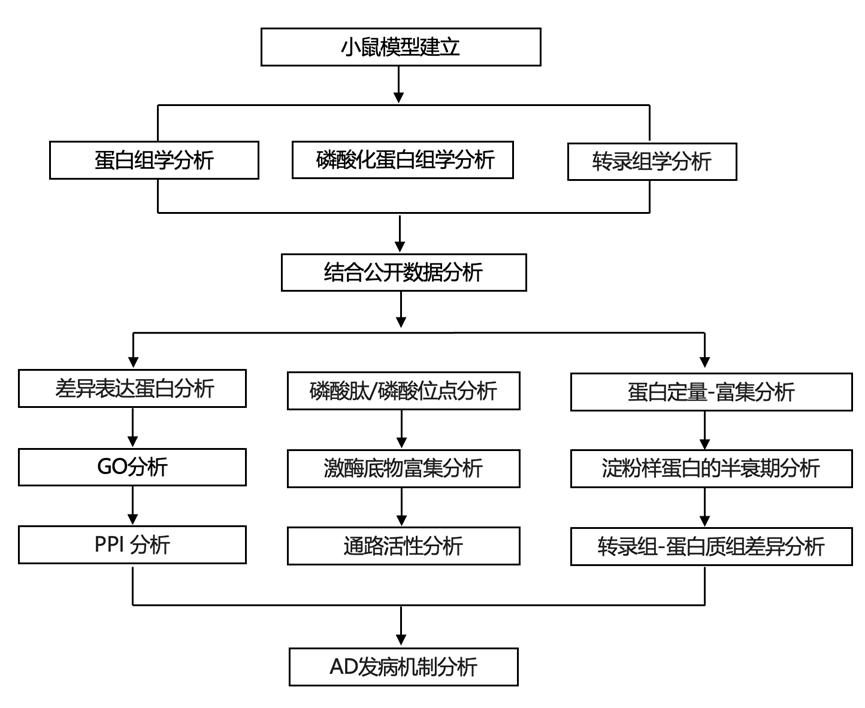
结 果
01
多种 AD 淀粉样变性模型的蛋白质组分析揭示了共同的通路
研究团队建立了三种不同年龄的淀粉样变性小鼠模型,这些模型具有早期和晚期症状(图 1a):(i) 5xFAD模型(3、6、12 个月大),过表达人类APP和PSEN1基因,在Thy1启动子下携带总共五种人类疾病突变,促进淀粉样蛋白病理的快速发生;(ii) NLF模型(3、12 个月大,病理较弱)和 NLGF模型(3、6、12、18 个月大,病理较强),他们还分析了每种小鼠系的年龄匹配的野生型 (WT) 对照小鼠。
利用优化的串联质谱标签(TMT)方法,结合广泛的二维液相色谱(LC/LC)和高分辨率串联质谱(MS/MS),他们对总共 66 个小鼠大脑(皮质)进行了蛋白组学分析,并进行了深度蛋白质组覆盖,鉴定了超过900000个肽谱匹配(PSM)、330000 个肽和 10369 个独特蛋白质(10331 个基因),这些蛋白质在所有动物中都是共有的,蛋白质错误发现率(FDR)低于 0.01(图 1b)。如预期的那样,Aβ 胰蛋白酶肽 (R.HDSGYEVHHQK.L) 在所有 AD 小鼠中均表现出年龄依赖性增加,5xFAD 和 NLGF 中的水平高于 NLF,这与这些小鼠中报告的病理一致(图 1c)。
他们将 3 个月大的小鼠与任何其他年龄的小鼠进行比较时,差异表达 (DE) 分析确定了 183 种年龄依赖性蛋白质,其中 129 种蛋白质随年龄增长而上调,54 种蛋白质下调。这些年龄依赖性蛋白质主要与细胞外基质重塑、溶酶体活性和突触信号传导等过程有关。上调蛋白富集于含胶原的细胞外基质、神经元周围网络、溶酶体、谷胱甘肽代谢过程等。相反,下调蛋白则富集于细胞周围、细胞连接和神经元成分,包括突触、轴突、树突棘等。
然后,他们使用 WT 对照对每种基因型在不同年龄进行 DE 分析,排除人类 Aβ 肽,因为 WT 小鼠中不存在该肽。NLF 表现出少量差异表达蛋白(DEP),与其弱病理相符(图 1d)。相反,5xFAD 和 NLGF 模型显示出显著的蛋白质改变,并且两种模型的改变都随着年龄的增长而增加(图 1d)。例如,与 WT 相比,火山曲线显示 12 个月大的 NLGF 小鼠有 605 个 DEP(图 1e),反映了其强烈的淀粉样蛋白表型。当将不同年龄的 DEP 相加时,5xFAD 中有1382个 DEP,NLF 中有 7 个,NLGF 中有 1142 个。此外,他们发现在所有测试模型中,DEP 的数量与 Aβ 的积累高度相关。
虽然 5xFAD 和 NLGF 模型之间存在遗传差异,但他们在这两种模型中观察到了相似的蛋白质组学特征。在 5xFAD 和 NLGF 中的 1914 个 DEP 中,有 610 个 (32%) 重叠,其中 98% (597/610) 表现出一致的方向性变化(上调或下调)。其余的 DEP,5xFAD 中的 772 个 (40%) 和 NLGF 中的 532 个 (28%),是基因型特异性的,但在两种 AD 模型中显示出相似的年龄依赖性趋势(图 1f)。差异似乎主要是由统计阈值而不是不同的生物学驱动的。总体而言,5xFAD 和 NLGF 的蛋白质组学谱表现出大致相似的模式。
他们对 597 个重叠的 DEP 进行了GO分析,发现在细胞外基质、溶酶体/内吞作用、免疫反应、突触信号传导以及与 Aβ、整合素、脂质、钙离子等的结合中富集(图 1g)。重叠的 DEP 映射到蛋白质-蛋白质相互作用 (PPI) 网络中,揭示了免疫反应、补体、脂质代谢、蛋白水解/自噬和淀粉样蛋白结合细胞外基质蛋白网络(淀粉样蛋白基质体)的重要相互作用模块(图 1h)。这些发现表明 5xFAD 和 NLGF 之间共有的蛋白质和通路对于淀粉样变性发病机制和免疫反应至关重要,这与人类 AD 中的先前报告一致。
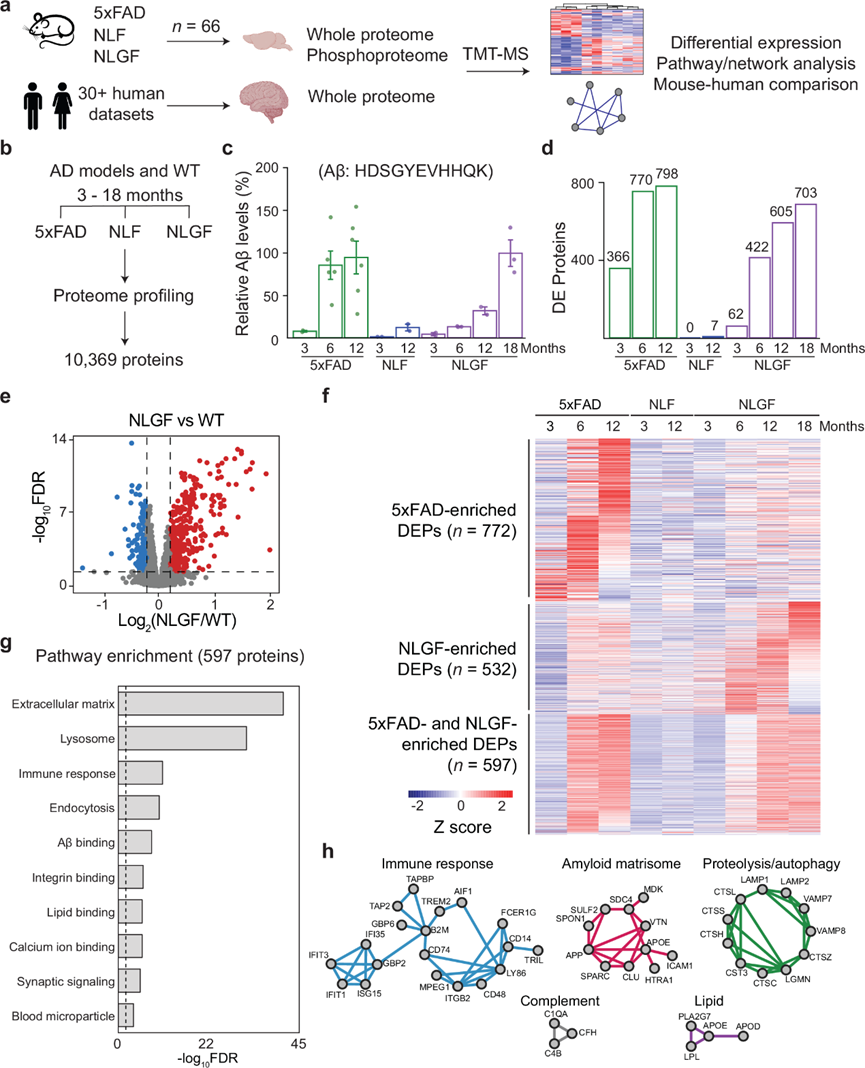
图1. 脑 MS 分析揭示了 AD 小鼠模型中共有的蛋白质组变化。
(a) 研究示意图。(b) 在不同年龄(3-18 个月)定量的蛋白质。(c)使用肽 HDSGYEVHHQK 通过 MS 定量的 Aβ 水平。(d)差异表达蛋白。(e) NLGF-WT 比较的代表性火山图。(f) 在任何年龄或基因型的 AD 小鼠中鉴定的 DEP 热图。(g)通路分析。(h) 富集的 PPI 模块。
02
AD 模型的磷酸化蛋白质组分析突出了独立于蛋白质水平的改变
由于已知蛋白质磷酸化是 AD 发病机制中的一个因素,他们在同一组 NLGF(3、6、12、18 个月大)小鼠和 5xFAD(12 个月大)小鼠及其年龄匹配的 WT 对照中分析了磷酸化蛋白质组数据。在对 NLGF 小鼠的年龄依赖性磷酸化蛋白质组进行全面发现分析后,他们使用单一年龄的 5xFAD 小鼠作为验证模型。还使用 TMT-LC/LC-MS/MS 方法进行分析,并附加了磷酸肽富集步骤以提高磷酸化蛋白质组覆盖率。当结合所有 TMT 批次的磷酸化蛋白质组数据时,他们定量了 129,906 个独特的磷酸肽(10502 个蛋白质上的 82261 个磷酸位点)。由于单个 TMT 批次的磷酸化蛋白质组覆盖不完整,不同 TMT 批次之间的重叠通常较低。当他们提取所有 36 只小鼠共有的磷酸肽时,数量下降到 12096 个磷酸肽(2814 个蛋白质上的 10532 个磷酸位点(图 2a)。这些共有的磷酸肽含有 8665 pS(82.3%)、1625 pT(15.4%)和 242 pY(2.3%)位点(图 2b) ,与其他大型磷酸化蛋白质组分析中的位点分布相似。
然后,他们使用年龄匹配的 WT 对照对 5xFAD 和 NLGF 小鼠进行了成对 DE 分析,在两种小鼠模型中鉴定出 122 种一致的 DE 磷酸肽(80 种 DE 磷酸蛋白)。例如,在这两种小鼠中,PTPRC/CD45 S964 和 GFAP T299 的磷酸化水平均显著升高,分别表明小胶质细胞和星形胶质细胞发生激活(图 2c-d)。80 种 DE 磷酸蛋白在细胞骨架、质膜、突触和囊泡的几种通路和 PPI 网络中富集(图 2e-f),这些途径与人类 AD 磷酸化蛋白质组学研究揭示的途径一致。
值得注意的是,80 种 DE 磷酸化蛋白中只有 30 种 (37.5%) 在蛋白质组水平上表现出显著变化(图 2g),这表明磷酸化的差异主要是由于大脑中激酶/磷酸酶活性的改变,与蛋白质水平无关。为了定量基于这些 DE 磷酸肽的激酶活性变化,他们通过激酶底物富集分析 (KSEA) 的算法分析出激酶家族的变化。例如,可以从其 DE 底物 TOM1L2、EML4、GJA1 和 TLE3 推断出 MAPK 活性(图 2h)。分析发现两种激酶家族上调:酪蛋白激酶 (CSNK) 和丝裂原活化蛋白激酶 (MAPK)(图 2i)。因此,KSEA 分析表明与淀粉样蛋白病理相关的多种激酶失调。
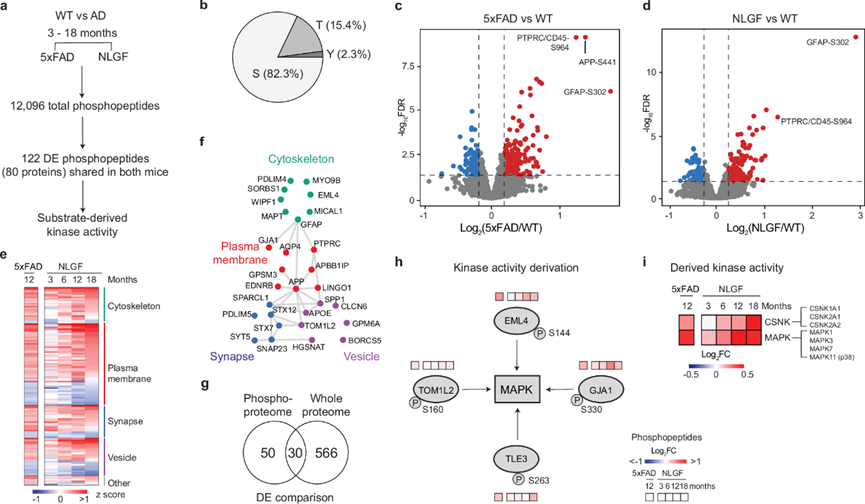
图2. 组织磷酸化蛋白质组学定义了整个蛋白质组之外的一个新的调控层。
(a) 磷酸化蛋白质组分析。(b) 已鉴定磷酸位点中磷酸化 Ser/Thr/Tyr 的分布。(c-d) 磷酸化蛋白质组数据的火山图。(e)差异磷酸化蛋白的热图。(f) PPI 模块。(g) 磷酸化蛋白质组学和全蛋白质组分析中 DEP 的重叠。(h) 用于识别改变的激酶活性的生物信息学方法。(i) 衍生激酶活性的热图。
03
人鼠对比发现共同的 AD 通路
为了研究小鼠模型的相关性,他们将 5xFAD 和 NLGF 中的 DEP 与人类宏数据进行了比较,他们重点研究了866个人类DEP,这些 DEP 在深度 AD 蛋白质组学研究中持续表现出显著变化(图 3a),其中MS在小鼠中检测到了 654 个同源蛋白。5xFAD 和 NLGF DEP 的总和相当于 30% (196/654) 的 AD DEP,并显示出年龄依赖性(图 3b)。这三个数据集共有一组 108 个 DEP 的核心数据(图 3c)。进一步分析表明,5xFAD 和 NLGF DEP 与晚期 AD的相关性比与轻度认知障碍 (MCI)的相关性更密切,尽管这两种相关性都很弱。这意味着这些小鼠模型可能更能代表晚期 AD 阶段的淀粉样变性,而不是早期无症状期的淀粉样变性(图 3d)。在一致的核心 DEP 中,大约一半表现出细胞类型特异性,其中 42% 对小胶质细胞有特异性,29% 对神经元有特异性,25% 对星形胶质细胞有特异性,2% 对内皮细胞有特异性,2% 对少突胶质细胞有特异性。这些发现强调了各种细胞类型对疾病发展的贡献,并突出了小胶质细胞的重要作用。
然后,他们检测了小鼠模型和人类 AD 中一致的 108 个 DEP(图 3e),并通过将各个组成部分与数学公式积分来得出它们的通路活性(图3f)。几种通路活性上调,包括淀粉样蛋白基质体、细胞迁移、补体和凝血、细胞骨架、免疫反应、整合素通路、脂质调节、代谢和蛋白质折叠/蛋白水解;两种通路——神经发生和突触调节——发生下调(图 3g)。
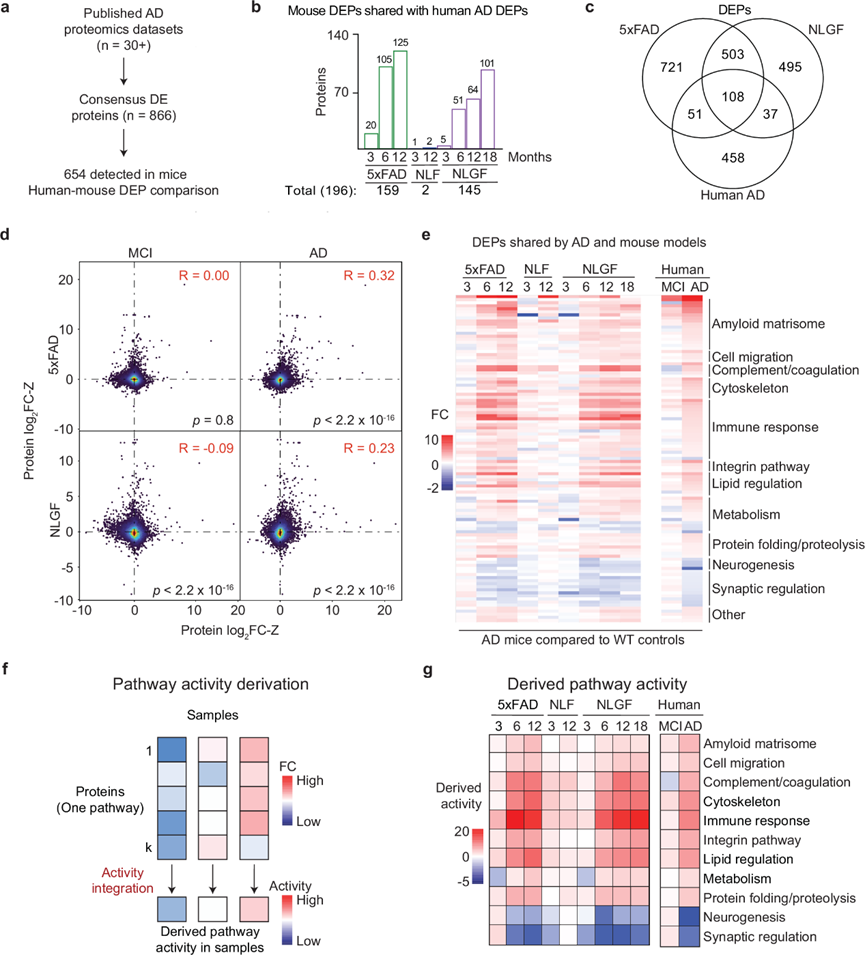
图3. 小鼠蛋白质组学与人类元数据的比较确定了共同的蛋白质组学变化。
(a) 在 30 多项人类 AD 蛋白质组学研究中鉴定了 866 种持续改变的蛋白质,其中 654 种在 AD 小鼠的蛋白质组学分析中进行了定量。(b) 人类 AD 与不同小鼠模型之间重叠的 DEP 数量。(c) 人类AD、5xFAD 和 NLGF 小鼠共有的 DEP 。(d) Z 分数之间的散点图比较。(e) 热图显示人鼠共有 AD 蛋白的log2FC值。(f) 用于推导通路活动的工作流程。(g) AD和小鼠模型中通路活动的热图。
04
小鼠中除淀粉样变性以外的其他病理与 AD 的相似性增加
5xFAD 和 NLGF 淀粉样变性小鼠模型无法捕捉到与 AD 相关的整个蛋白质组学变化范围。这种差异可能归因于缺乏在人类 AD 中发现的其他病理,例如 tauopathies和剪接功能障碍。他们进一步分析了另外两种具有其他病理的 AD 小鼠模型(图 4a):(i)3xTG,显示淀粉样斑块和 tau 缠结病理,和(ii)BiGenic (BiG) 小鼠,由 5xFAD 与 N40K 转基因小鼠杂交而产生,重现了淀粉样蛋白病理和 AD 中新发现的 U1 snRNP 剪接功能障碍。他们对两种模型和年龄匹配的对照(约 6 个月大,共计 37 个小鼠大脑)进行了分析,定量了 9780 和 10255 种蛋白质(蛋白质 FDR < 0.01)。他们分别在 3xTG 和 BiG 中鉴定出 1230 和 1564 个 DEP(图 4 b-c),其中包括大量在纯淀粉样变性模型 5xFAD 和 NLGF 中未观察到的 DEP。虽然 3xTG 与两种淀粉样变性模型之间的 DE 蛋白重叠相对较低,但 3xTG 在通路活性变化方面表现出与淀粉样变性模型相似的趋势。此外,3xTG 显示出与 tau 通路及其下游对 RNA 加工的影响有关的模型特异性 DEP(图 4d)。同样,BiG 小鼠虽然与 5xFAD 有相同的变化,但也显示出与 N40K 9类似的缺陷 U1 snRNP 剪接成分,并且独特地存在脂质和突触失调,这可能是由于淀粉样蛋白和 U1 snRNP 通路的协同作用(图 4e)。
为了评估小鼠模型和人类 AD 之间共同的分子变化,他们生成了一个突出 DE 蛋白重叠的翻转图。通过将四种小鼠模型中的所有 DEP 相加,与人类 DEP 的重叠增加到 42%(图 4f),这表明淀粉样斑块以外的其他病理也导致了小鼠蛋白质组的改变,使其更接近 AD 谱。其余 58% 的人类 AD DEP 在线粒体功能、细胞形态发生、脂质调节等途径中表现出富集,这可能是由于小鼠模型中神经元细胞死亡减少以及小鼠和人类对病理损伤的反应不同。
他们采用顺序统计方法通过整合来自小鼠和人类的 12 个可用组学数据集对这些蛋白质进行优先排序,其中包括 GWAS、转录组、蛋白质组、磷酸化蛋白质组和相互作用组(图 4g)。正如预期,APP、APOE、GFAP、TREM2、MAPT (tau) 和 CLU 等著名蛋白质排名靠前,而排名前 20 的其他蛋白质,如 MDK、NTN1、SFRP1、OLFML3、PTPRC/CD45、SMOC1、CD180 和 PTN 仍未得到充分研究(图 4h)。这些蛋白质需要进一步研究,以了解它们在 AD 发展中的作用。
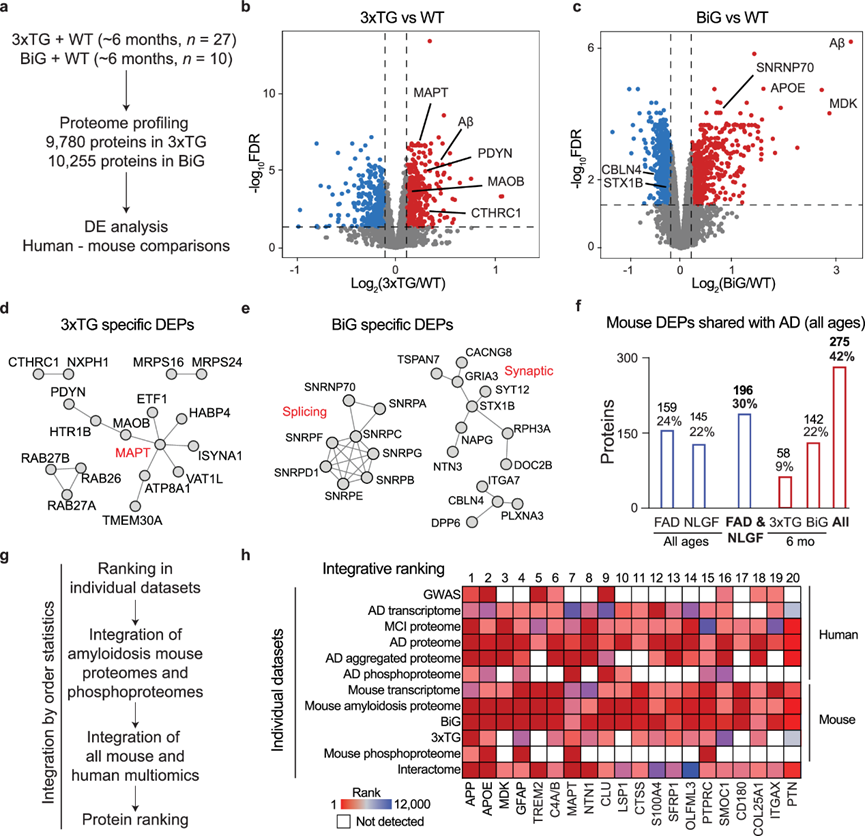
图2. 除淀粉样变性外,还存在其他病理的小鼠模型与 AD 的相似性增加。
(a) 另外两种表现出其他 AD 病理的小鼠模型的蛋白质组学分析。(b-c) 与 WT 相比,3xTG 和 BiG 小鼠的 log2FC 和 FDR火山图。(d-e) 仅在个别小鼠中发现的显著改变的 DEP 的选定蛋白质-蛋白质相互作用。(f) AD小鼠模型中在 AD 中持续改变的 DEP 数量。(g) 使用顺序统计量通过多组学对单个蛋白质进行排序的策略。(h) 通过结合 12 个数据集定义的蛋白质整合排序。
05
转录组-蛋白质组不一致出现在 AD 和 5xFAD 模型中
据报道,AD中存在转录组-蛋白质组不一致性。为了探究该问题,他们比较了人类 AD和 5xFAD 小鼠的定量转录组和蛋白质组数据集,并与对照样本进行了 Z 分数转换(图 5a)。这项比较研究主要针对 12 个月大的 5xFAD 小鼠,因为在相同的饲养条件下可以获得年龄匹配的数据。转录组-蛋白质组相关性适中,人类的 R 值为 0.40,小鼠的 R 值为 0.46(图 5b-c)。他们通过以下步骤鉴定了 RNA 独立的蛋白质变化:(i) 与对照组相比,鉴定人类 AD和 5xFAD 小鼠中 Z 分数变化的蛋白质; (ii) 根据蛋白质上调/下调和 RNA 依赖性/独立性将这些改变的蛋白质分为四类(图 5d)。值得注意的是,在这两个物种中,大约三分之一的改变蛋白质表现出 RNA 独立性(人类为 35%,小鼠为 36%)。在人类的 262 种 RNA 独立的上调蛋白质和小鼠的 295 种 RNA 独立的上调蛋白质中,有 31 种蛋白质重叠。相反,在人类的 133 种 RNA 独立的下调蛋白质和小鼠的 120 种 RNA 独立的下调蛋白质中,只有一种重叠(图 5e)。这些发现表明在 AD 小鼠模型中上调蛋白质的转录组-蛋白质组不一致性部分保留。
31 种共有的上调蛋白质中有许多存在于淀粉样斑块中,这促使他们全面表征 5xFAD 小鼠的淀粉样蛋白组(即淀粉样斑块微环境中的所有成分)。他们采用激光捕获显微切割 (LCM) 从脑组织中分离淀粉样斑块和非斑块区域 ,并使用改进的 TMT-LC/LC-MS/MS 流程对蛋白质组进行分析,该流程针对亚微克蛋白质样品进行了优化。这种方法对 5364 种蛋白质进行了定量(图 5f-g)。对斑块和非斑块区域进行定量比较,发现斑块中富集了 438 种蛋白质,非斑块中富集了 191 种蛋白质。令人惊讶的是,在人类 AD 和 5xFAD 小鼠中 31 种 RNA 独立的上调蛋白质中,有 23 种在淀粉样蛋白组分析中检测到,其中 17 种(74%)出现在 438 种斑块富集蛋白质中,而在 191 种非斑块富集蛋白质中未检测到任何蛋白质。结果表明,淀粉样斑块的形成有助于 RNA 独立的蛋白质积累。
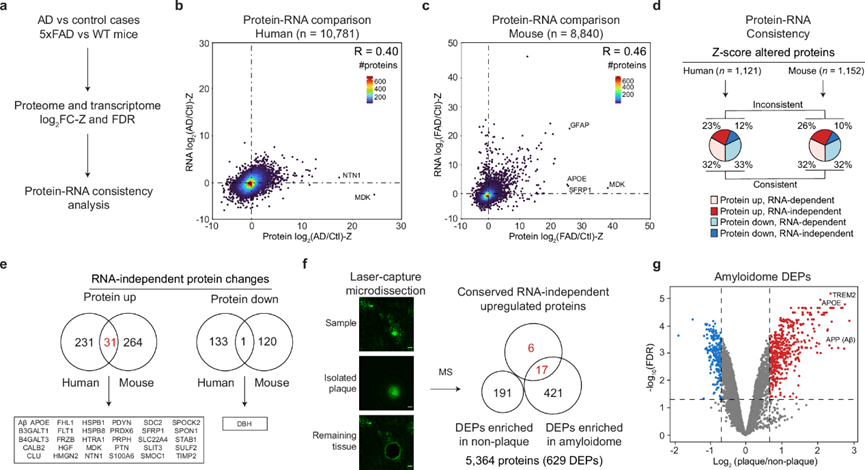
图5. AD 和小鼠模型表现出转录组-蛋白质组不一致。
(a) 比较蛋白质/RNA 数据以确定蛋白质-RNA 一致性的工作流程。(b-c) 人类 ( n = 10781) 和 5xFAD 小鼠 ( n = 8840) 中 log2 FC-Z的蛋白质-RNA 比较散点图 。(d) 在 z 分数改变的蛋白质群体中蛋白质-RNA 一致性的百分比。(e) 人类和小鼠之间RNA独立蛋白质变化的重叠。(f) 比较斑块和非斑块区域的蛋白质组,定量 5364 种蛋白质。(g) 火山图显示在斑块或非斑块区域富集的蛋白质。
06
淀粉样蛋白组中蛋白质降解延迟导致转录组-蛋白质组不一致
他们假设 AD 中的蛋白质组-转录组差异可能是由于淀粉样蛋白组内的蛋白质周转率降低造成的。为了验证这一假设,他们采用脉冲 SILAC 标记(pSILAC)与TMT结合来测量高通量下的蛋白质周转率(图 6a)。5xFAD 小鼠和 WT小鼠在一定时间过程中(0、4、8、16 和 32 天,重复 3 次,共 30 只小鼠)喂食重赖氨酸 SILAC 食物,然后收集脑组织并进行 TMT-LC/LC-MS/MS 分析。重赖氨酸标记的动力学使他们能够确定蛋白质降解率,以蛋白质半衰期(T 50)表示。表观T50值直接通过拟合降解曲线计算得出;为了解释小鼠体内重赖氨酸的循环利用,他们使用 JUMPt 软件中的常微分方程模型得出了校正的T50值。
他们对 5xFAD 中存在的人类 APP (hAPP) 和小鼠 APP (mAPP) 蛋白中的 12 种胰蛋白酶肽进行了定量分析(图 6b)。两种肽是人类特异性的:非 Aβ 区域的肽 2(用于定量全长 hAPP),Aβ 区域的肽 10[用于定量人类 Aβ (hAβ)]。肽 10 的肽光谱匹配 (PSM) 计数(半定量指数74)明显高于肽 2,与 5xFAD 中 Aβ 的积累一致(图 6c)。事实上, 当分析表观T50(hAβ 为 132.0 天,hAPP 为 40.1 天)或校正T50 (hAβ 为 18.2 天,hAPP 为 <0.5 天)时,hAβ 显示出比 hAPP 更长的半衰期(图6d-g)。结果清楚地表明,在 5xFAD 小鼠中,hAβ 的周转率相对于 hAPP 明显延迟。
然后,他们分析了 5xFAD 和 WT 小鼠的蛋白质组周转率,计算了8492 种蛋白质的 校正T50值(图7a)。5xFAD 和 WT 之间的整体T50分布相似,平均值约为 4-5 天(图 7b)。统计分析发现 84 种蛋白质在两种基因型之间的半衰期有显著变化(图 7c)。其中 25% 的蛋白质(包括 DPP10 和 AAK1)在 5xFAD 中的T 50比在 WT 中的短(图 7d),而其余 75%在 5xFAD 中的T50更长。例如,APOE 和 VTN 分别显示 ΔT 50为 4.2 和 3.5 天(图 7e)。
通过整合来自 5xFAD 的转录组、蛋白质组、淀粉样蛋白组和蛋白质半衰期数据,他们发现淀粉样蛋白组中发现的 32 种不依赖 RNA 的上调蛋白质表现出延长的半衰期(图 7f,)。这 32 种蛋白质在淀粉样蛋白基质体、自噬/溶酶体和神经发生途径中富集。这些发现表明,AD 转录组-蛋白质组差异至少可部分归因于淀粉样蛋白组中蛋白质周转率降低。
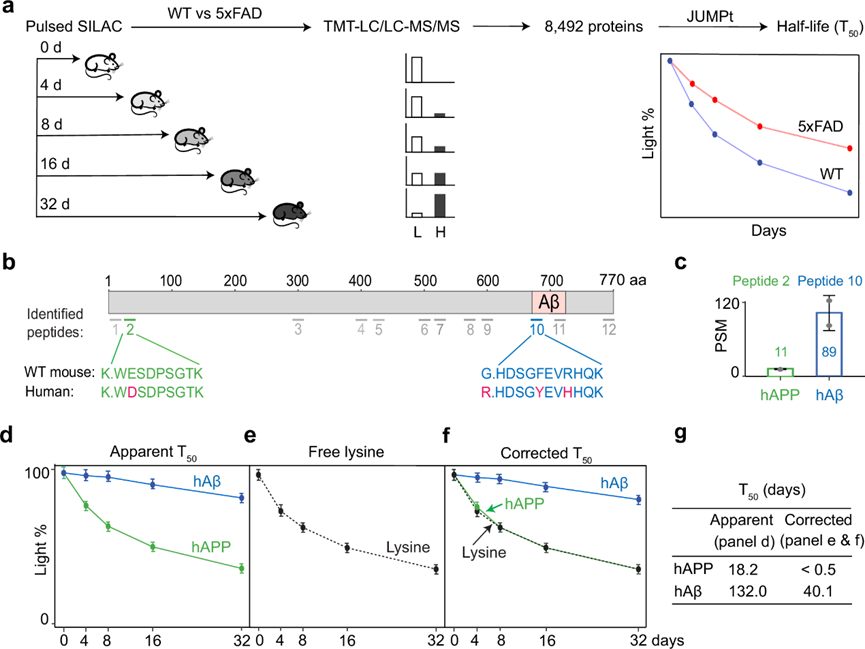
图6. AD 小鼠蛋白质组周转分析证实了人类 APP 全长蛋白和 Aβ 肽的周转率明显不同。
(a) 全蛋白质组周转分析。(b) 图表说明了人类和小鼠 APP 或 Aβ 区域中已鉴定的 12 种肽。(c) hAPP特异性肽(肽 2)和 hAβ 替代肽(肽 10)的 PSM 计数。(d) 表观T50值直接从 hAPP 或 hAβ 特异性肽的周转曲线确定。(e) 游离 Lys 氨基酸曲线。(f) 校正后的 T50值是根据蛋白质曲线和游离 Lys 曲线之间的距离计算得出的。(g) hAPP 和 hAβ T50值的汇总表。
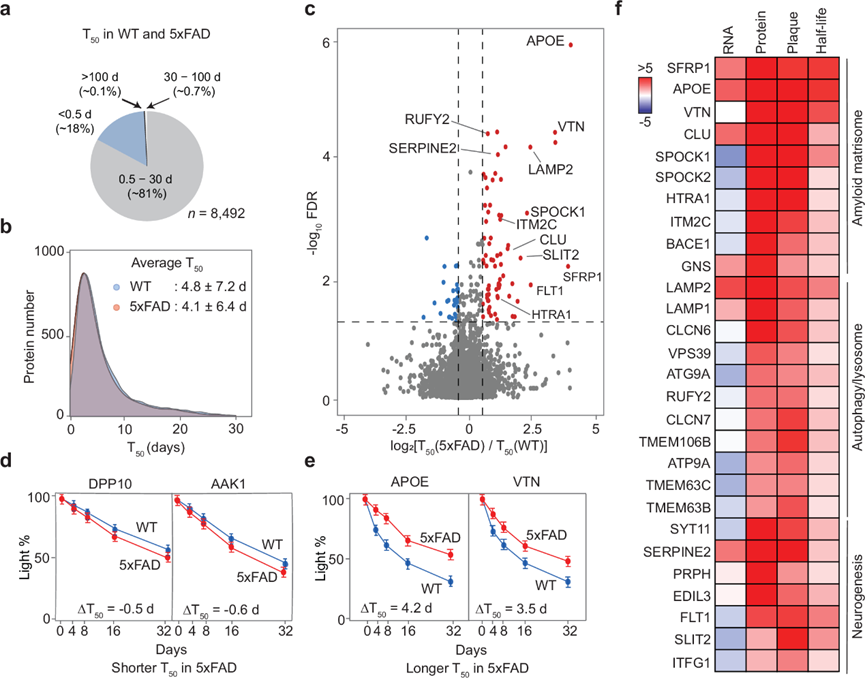
图7. 对 AD 小鼠蛋白质组周转的分析揭示了淀粉样蛋白的半衰期较慢。
(a) 饼图显示 WT 和 5xFAD 小鼠的校正蛋白质T50值的平均比例。(b) 两种基因型的T50值分布图,显示平均值和标准差。(c) 与WT相比,5xFAD 中T50的变化和 FDR 的火山图。(d-e) 5xFAD 中 T50缩短或延长的蛋白质示例。(f) 某些具有较长T50的蛋白质在斑块中的定位。
+ + + + + + + + + + +
结 论
本研究展示了多种淀粉样变性小鼠模型的全面、年龄依赖性大脑蛋白质组和磷酸化蛋白质组,通过整合人类元数据确定了共有通路,并通过多组学分析确定了优先成分。总的来说,两种常用模型(5xFAD 和 APP-KI)重现了 30% 的人类蛋白质改变;tau 和剪接病理的额外遗传整合将这种相似性提高到 42%。本研究分析了 AD 和 5xFAD 小鼠大脑中的蛋白质组-转录组不一致性,揭示了不一致的蛋白质在淀粉样斑块微环境中富集。对 5xFAD 蛋白质组周转的分析表明,淀粉样蛋白的形成会延缓淀粉样蛋白组成分的降解,包括 Aβ 结合蛋白和自噬/溶酶体蛋白。
+ + + + +



 English
English


