文献解读|Adv Sci(14.3):口腔黏膜下纤维化衍生的口腔鳞状细胞癌及其肿瘤微环境的空间转录组和代谢组学景观
✦ +
+
论文ID
原名:Spatial Transcriptomic and Metabolomic Landscapes of Oral Submucous Fibrosis-Derived Oral Squamous Cell Carcinoma and its Tumor Microenvironment
译名:口腔黏膜下纤维化衍生的口腔鳞状细胞癌及其肿瘤微环境的空间转录组和代谢组学景观
期刊:Advanced Science
影响因子:14.3
发表时间:2024.01.16
DOI号:10.1002/advs.202306515
背 景
在南亚和东南亚,咀嚼槟榔的习惯很普遍,这导致口腔黏膜下纤维化(OSF)。OSF是一种公认的癌前病变,部分OSF病例最终发展为口腔鳞状细胞癌(OSCC) 。然而,OSF恶性转化为OSCC的具体分子机制尚不清楚。
实验设计
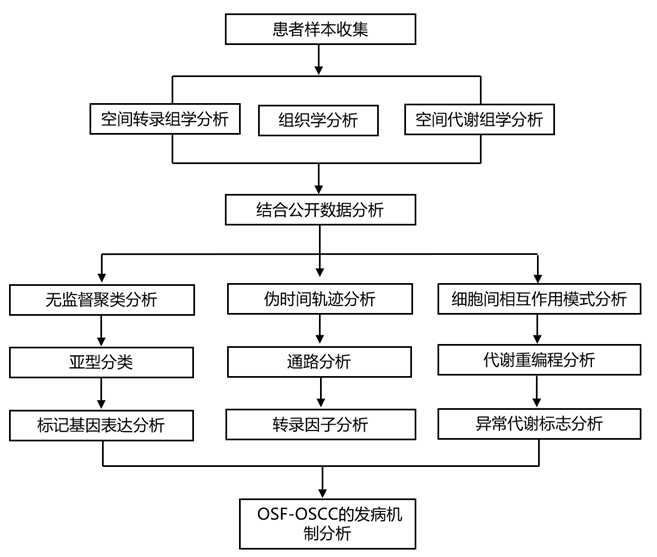
结 果
01
OSCC 的 ST 谱揭示肿瘤内异质性
为了研究 OSF 衍生的 OSCC 的空间多组学特征并揭示恶性转化过程中的关键分子事件,研究者团队从四名临床诊断为 OSF 的 OSCC 患者中收集了新鲜组织样本,并制备了冷冻切片进行苏木精和伊红 (H&E) 染色。H&E 染色显示在每个样本的邻近上皮的上皮下层均发现胶原沉积和淋巴细胞浸润,这与 OSF 的临床特征相符。在患者1(P1)和患者3(P3)中,邻近上皮中可观察到原位癌 (ISC),而在患者2(P2)和患者4(P4)中,邻近上皮中可观察到上皮发育不良。与其他样本相比,P4 的肿瘤细胞分化较差,基质细胞在肿瘤区域的分布较高(图S1A)。同时,他们还对上述四个样本进行了 Masson 染色,并以一个 OSCC 样本(男性,66 岁,吸烟 50 年,每天 2.5 包烟,饮酒 47 年,每天 250 毫升,从不咀嚼槟榔,pT3N1M0,临床分期 III)作为对照,该样本无槟榔咀嚼史,无OSF 表型。结果显示,在所有 OSF 衍生的 OSCC 样本中,OSF 区域均观察到大量胶原纤维沉积,而在对照样本中,肿瘤下方和邻近上皮组织下未观察到胶原沉积(图S1B)。
接下来,他们同时对这四个样本进行了空间转录组学(ST)和空间代谢组学 (SM)分析(图1,图S2A)。从四个 OSF 衍生的 OSCC 样本中检测到总共 17319 个斑点,平均每个斑点有 12601 个唯一分子标识符(UMI),代表 3056 个基因(图S2B)。对每个样本的斑点进行积分和归一化后,使用均匀流形近似和投影 (UMAP),进行无监督聚类分析,证实样本间没有明显的批次效应(图S2C)。来自四个样本的所有 17319 个斑点分成 11 个聚类(图 1B)。根据组织切片上每个点的空间分布,聚类1至4(C1-C4)主要位于肿瘤区域,归类为肿瘤亚型,聚类5至7(C5-C7)位于相邻上皮区域,归类为相邻上皮亚型。位于淋巴细胞浸润区域的聚类8 (C8)和聚类9 (C9)鉴定为免疫亚型;位于富含胶原蛋白、肌肉纤维和血管的基质区域内的聚类10(C10)和聚类11(C11)鉴定为基质亚型。由于主要位置(肌肉/血管/腺体区域)和点有限(仅77个点),C11排除在后续分析之外(图 1C,图S2D)。
接下来,他们根据表达显著差异的前 10 个标记基因注释了每个聚类的生物学特征,揭示了亚型之间的转录相似性(图S2E)。具体来说,髓样细胞上表达的触发受体-1 (TREM1) 和神经丝轻肽 (NEFL),肿瘤微环境的特异性标记基因,在 OSF 衍生的 OSCC 的 C1 中显著表达。C2 显示出成纤维细胞相关基因(即COL11A1、ADAM12、ITGA11 )的特异性表达,表明 C2 中可能存在上皮-间质转化 (EMT) 的表型。基质相关基因(即SPP1、MMP11、MMP28、CST1)在主要由 P4 贡献的 C3 中高表达,其肿瘤区域表现出较差的肿瘤分化程度。例如,细胞外基质相关基因SPP1(编码骨桥蛋白)在 C3 中特异表达,参与巨噬细胞的浸润和免疫抑制微环境的形成。C4 的标志基因主要与上皮细胞分化的生物功能相关(即SLURP2、DSG1、S100A7、TGM1)。有趣的是,这些分化相关的标志基因包括THEM5和GSDMA,也在邻近上皮亚型(即 C5 和 C6)中显著表达(图S2E)。邻近上皮亚型的 C7 仍然保留了正常上皮细胞特征的标志基因表达(即TMPRSS11A、KRT3、GSTA1)。在免疫亚型中,B 细胞特异性标志基因(即CD79A、PIM2、POU2AF1)和 T 细胞特异性标志基因(即GZMK、CD8B、GZMM)分别在 C8 和 C9 中显著表达。基质亚型(C10)表现出肌细胞(即XIRP2、SMPX、MYOT、LMOD2/3、SMTNL2)、成纤维细胞(即PI16),以及血管内皮细胞和红细胞(即SPTB、ATP1A2、AGT)(图 1D,图S2E)。
为了验证这 4 个样本的转录特征与组织病理学特征之间的相关性,所有斑点根据其组织分布分为不同区域类型,包括肿瘤、邻近上皮、ISC、OSF、基质和肌肉/血管/腺体区域。结果显示,聚类构成和转录组模式与每个组织区域的病理特征相一致(图 1E-F),例如肿瘤区域中的上皮细胞标志物KRT17,邻近上皮或 ISC 区域中的分化相关基因CALML5,OSF 区域中的免疫相关基因IGHG2,基质区域中的脂质代谢相关载脂蛋白APOE,以及肌肉区域中的肌细胞特征DES(图1F)。
总之,他们首次生成了长期咀嚼槟榔诱发的 OSF 的 OSCC 组织的 ST 谱及其进化动力学。该谱包括邻近上皮、ISC、OSF 和基质组织的代表性组织。同时,从 OSF 衍生的 OSCC 样本的 ST 数据中识别出 11 个不同的聚类。通过将转录组数据与空间信息和相应的组织病理学特征相结合,为进一步分析源自 OSF 的 OSCC 内的细胞类型多样性、细胞进化和细胞间通讯奠定了基础。
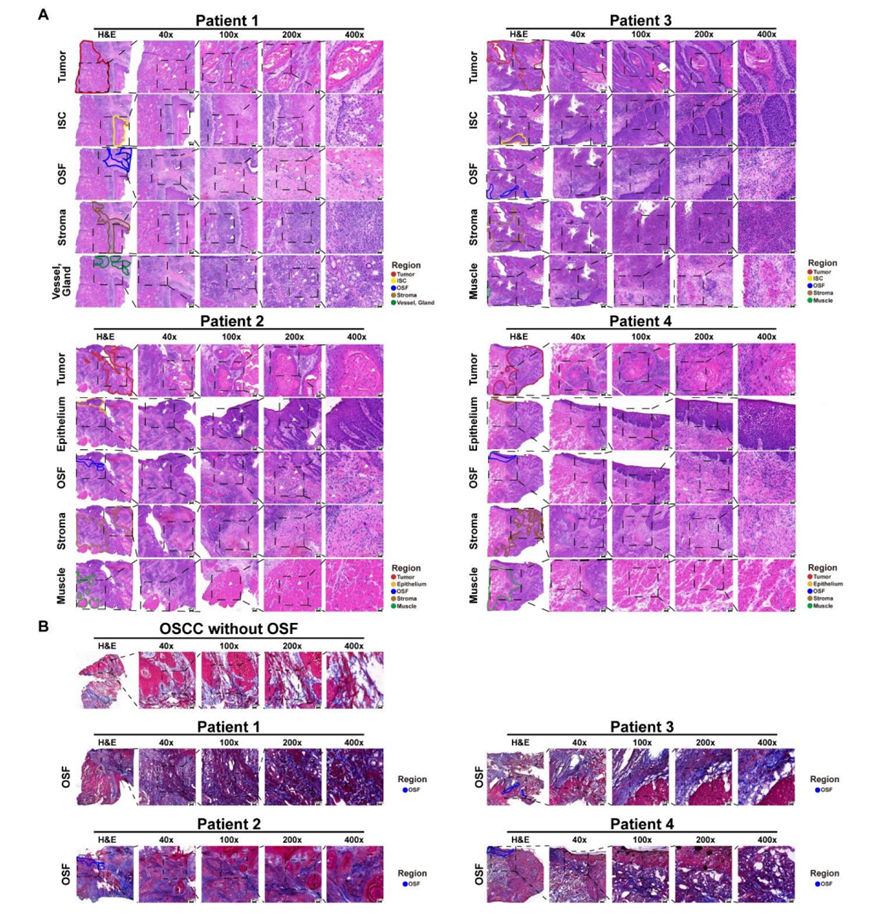
图S1. osf来源的OSCC样本的组织学分析。
(A) H&E染色后,选取4例osf源性OSCC的代表性视野(6.5 mm × 6.5 mm)进行空间转录组学(ST)和空间代谢组学 (SM)分析。 (B) Masson染色显示osf源性OSCC中胶原纤维沉积。

图S2. osf衍生的OSCC样品的ST特性。
(A) ST策略示意图。(B) 小提琴图显示了4个样本中每个点的唯一分子标识符(nUMI)和基因表达(nGene)的平均值。(C) 从ST中获得的17319个点进行无监督聚类分析UMAP 。(D) 条形图显示了11个聚类的比例。(E) 通过差异表达基因(DEG)分析,获得每个聚类10个具有代表性的标记基因。
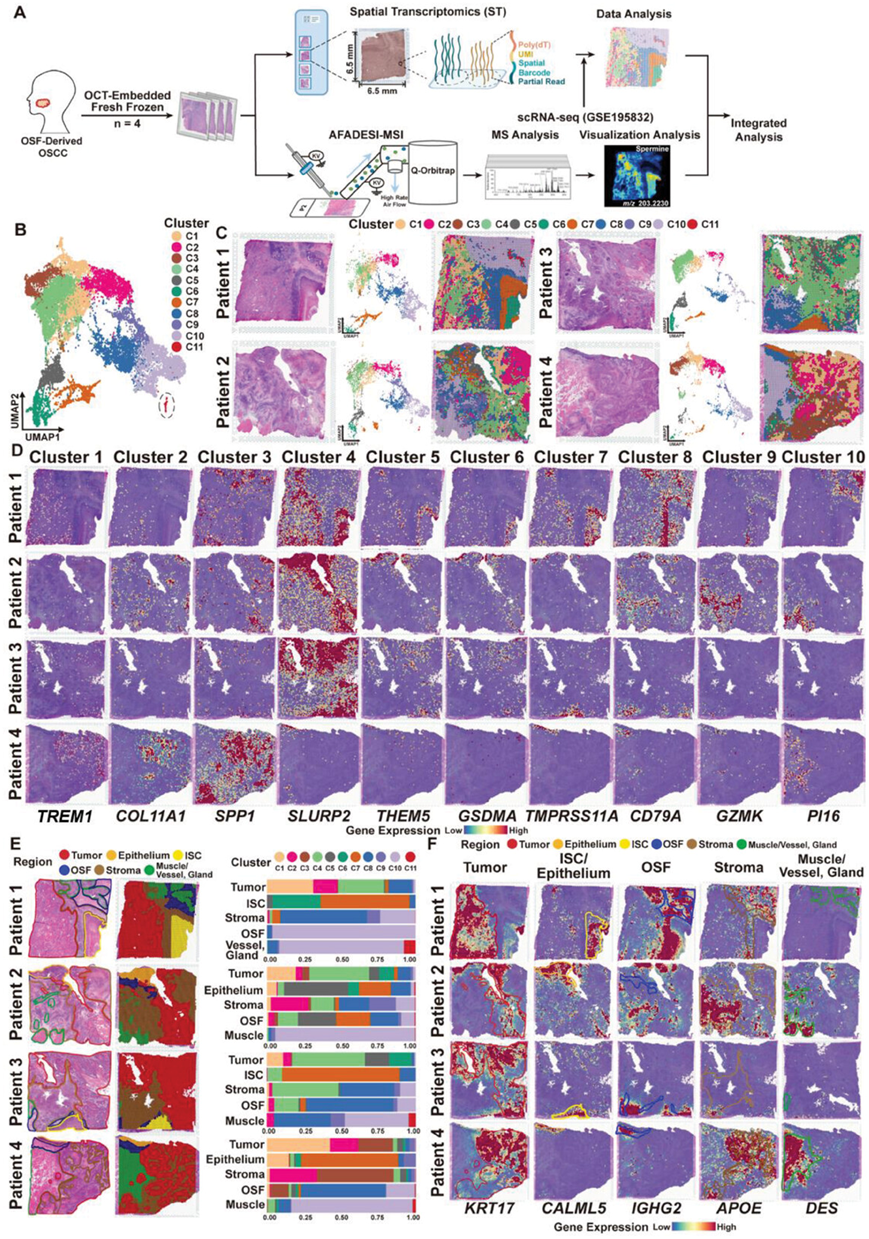
图1. OSF 衍生的 OSCC 的 ST 景观。
(A) 显示在 OSF 衍生的 OSCC 中检测和分析 ST 和 SM 的示意图。(B) 无监督聚类分析 UMAP 将四个 OSF 衍生的 OSCC 样本中的 17319 个斑点分成 11 个聚类。(C) 四个 OSF 衍生的 OSCC 样本中 11 个聚类的 H&E 染色图像(左)、UMAP 图(中)和 ST 特征图(右)。(D) ST 特征图显示四个样本中每个聚类的代表性标记基因的空间分布。(E) 根据组织病理学特征将四个样本的组织分为五个区域,包括肿瘤、邻近上皮、ISC、OSF、基质和肌肉/血管/腺体区域。(F) ST 特征图显示了不同组织区域的每个斑点中代表性标记基因的表达。
02
OSCC中ISC-pEMT-CAF的时空演化模型
为了探索OSF衍生的OSCC恶性转化过程中的时空转录组特征,他们在C1–C7中选择了总共5632个点(代表肿瘤和邻近上皮细胞),使用Monocle2进行伪时间分析,而C8–C10由于没有上皮细胞分布而排除在随后的伪时间分析之外。构建了OSCC的恶性进展轨迹(图 2A),其中OSCC的启动(前分支)发生在相邻上皮或ISC区域(来自C5–C7的点)和C4,具有显著的分化能力。随后,根据转录谱的差异,轨迹分为两个分支(分支1和分支2)。C1 和 C2 在分支 1 和分支 2 中均有分布,代表 OSF 衍生的 OSCC 中两种进化方向的潜在共同特征。此外,C3 和 C4 起着决定性作用,主要影响分支 1 和分支 2 的进化方向。
为了进一步探索OSF衍生的OSCC恶性轨迹的时间和功能差异,他们试图注释两个分支上斑点的差异表达基因。前分支主要表现出上皮细胞生长、分化和角化(例如KLK10、KLK12、KRT8、EVPL、SLURP2)的生物功能。此外,还观察到参与代谢通路(例如花生四烯酸和氨基酸代谢)的基因(例如PLA2G4E、ALOX12B、ODC1)。在分支 1 中,肿瘤细胞显示出细胞周期和翻译基因(例如,CDC20、EGFR)以及某些代谢基因(例如,甲基转移酶NNMT、载脂蛋白APOE)的显著富集,而分支 2 中的肿瘤细胞主要与干扰素反应有关(例如,ISG15、HLA-A、IFIT3、OAS2)。有趣的是,分支 1 和分支 2 都表现出与细胞外基质重塑相关的基因的突出表达(分支 1:ECM-受体相互作用,例如,FN1、COL16A1、VIM、NOTCH1;分支 2:胶原形成,例如,COL17A1、CSPG4),这表明 EMT 是 OSF 衍生的 OSCC 中分支 1 和分支 2 的共同终端表型(图 2B-C)。
公开的scRNA-seq 数据在头颈部鳞状细胞癌 (HNSCC) 中鉴定出了 6 个肿瘤细胞亚群,包括应激、分化 1 (Diff1)、分化 2 (Diff2)、缺氧、循环、上皮-间质转化 (pEMT)和两种癌症相关成纤维细胞亚群(CAF1 和 CAF)。然而,他们并没有进一步区分 CAF1 和 CAF2 的生物学功能。使用上述 8 个细胞亚群的特征基因集对本项研究 ST 数据中的所有点进行评分,发现应激、Diff1、Diff2 和缺氧亚群是恶性转化早期的主要细胞类型(C5-C7,伪时间轨迹前分支的主要成分)。他们进一步分析了上述八个细胞亚群在 OSF 衍生的 OSCC 组织切片上的空间分布,发现 CAF1 斑点主要位于肿瘤区域和侵袭前沿,与 pEMT 斑点的分布高度重叠。此外,CAF2 主要浸润 OSF 和基质区域(C10),与免疫亚型(C8 和 C9)相邻(图 2D)。
为了研究 pEMT 、CAF1 和 CAF2 细胞亚群之间的功能差异,他们采用了转录因子 (TF) 分析算法SCENIC,在三个亚群中鉴定了 104 个差异表达的 TF,而经典的 EMT TF(如Snail、Slug、Twist)未显示差异表达。他们选择了每个亚群中差异表达最多的 TF及其下游基因(图 2E-F)。FOSL1是 pEMT 亚群中表达较高的 TF,显示出对 EMT 相关基因(例如COL17A1、ANXA1、ITGA6、ID1)的潜在调控作用。一致地, CAF1 亚群中细胞外基质标志物(例如,COL1A1、COL3A1、COL12A1、MXRA5 )的高表达受TCF4调控,这表明 AP-1、TCF 家族可能是参与调节 EMT 过程和在 OSF 衍生的 OSCC 中产生 CAF1 样表型的关键 TF。但在CAF2中,免疫反应相关的TF SPI1通过调节补体和免疫检查点分子(如C1QA、C1QB、CD248、ITGB2)基因的表达,更能刺激CAF2亚群的免疫调节(图2E-F),表明免疫微环境可以刺激成纤维 细胞转化为免疫刺激细胞。随后,为了验证上述代表性TF对下游基因和“ISC-pEMT-CAF”轴进展的调控作用,他们分别在OSCC细胞系CAL27和HN30中过表达FOSL1或TCF4。qRT-PCR的结果显示下游基因的转录水平显著增加,包括COL17A1、ANXA1、COL1A1和COL3A1(图 2G),这与 ST 的结果一致。Western blot和免疫荧光分析显示 FOSL1 下游基因(COL17A1、ANXA1)、TCF4 下游基因(COL1A1、COL3A1)和间质标志物 Vimentin 显著上调,同时上皮标志物 E-Cadherin 下调(图 2H-I)。
这些结果确定了OSF衍生的OSCC从ISC到pEMT的恶性转化拟时间轨迹,并最终获得了CAF样表型,揭示了肿瘤微环境中的癌症相关成纤维细胞(CAF2)能够加剧免疫反应的激活,表明它们参与了肿瘤免疫微环境的重塑和延续。

图2. 伪时间分析揭示 OSF 衍生的 OSCC 中 ISC-pEMT-CAF 样表型演变模式。
(A) OSF 衍生的 OSCC 恶性上皮组织中上皮细胞的轨迹重建由三个分支组成:前分支(分叉前)、T1 分支(上)和 T2 分支(下)。(B) BEAM 热图显示恶性轨迹中伪时间特异基因的表达模式和相应的通路。(C) 恶性轨迹每个分支中伪时间特异基因的动态表达。(D) 根据公共 HNSCC scRNA-seq 数据,四个样本中每个细胞亚群的空间分布的 ST 特征图。 (E) 小提琴图显示与 ISC-pEMT-CAF 轨迹的三个细胞亚群中与 EMT 过程相关的代表性标记基因的表达。(F) ST 特征图展示亚群提取策略和 TF 靶基因的共表达。(G) qRT-PCR 揭示了 FOSL1 和 TCF4 在 OSCC 细胞系 CAL27 和 HN30 中上调其各自的下游靶基因(例如COL17A1、ANXA1和COL1A1、COL3A1)中的作用。(H) Western blot检测OSCC细胞中FOSL1或TCF4过表达对其下游基因和EMT标志物翻译水平的影响。 (I) 免疫荧光显示分别转染 FOSL1 和 TCF4 的 CAL27 细胞中下游基因(FOSL1:ANXA1;TCF4:COL3A1)的表达模式。
03
ST 图谱揭示 OSCC 中的免疫细胞分布和细胞间相互作用模式
OSF 和 OSCC 都以广泛的免疫细胞浸润为特征。然而,不同免疫细胞在 OSF 衍生的 OSCC 进展中的具体作用仍然不清楚。因此,他们首先表征了 OSF 衍生的 OSCC 组织中各种类型免疫细胞的 ST 特征,从免疫亚型中提取了总共 1911 个淋巴细胞(C8)和髓样细胞(C9)点(图 1B),并通过无监督聚类分析将它们分为 B 细胞、T/NK 细胞、巨噬细胞、树突状细胞和其他髓样细胞(无法归类为任何特定髓样细胞类型的细胞)(图 3A)。B 细胞(特征基因:MZB1、PIM2、CD38、CD79A)和 T/NK 细胞(CD3D、CD4、CD8A、NKG7)表现出相对独特的表达谱。相反,树突状细胞(CD14、ITGAX、CXCL10、ITGAV)、巨噬细胞(CD68、CD163、CXCL9、FCGR3A)和其他髓系细胞(LY6D、S100A7、GPX2、FABP5)具有更相似的转录谱。
接下来,他们分析了组织切片上免疫亚型的分布模式,并观察到它们在基质区域和肿瘤区域内显著聚集(图 3B)。这表明免疫细胞、肿瘤细胞和成纤维细胞之间存在相互作用。细胞表面的各种配体-受体相互作用在细胞间通讯和相互作用中起着至关重要的作用。使用配体-受体分析算法CellPhoneDB,对四种细胞类型进行了配体-受体相互作用分析:上皮细胞、免疫细胞、CAF1 细胞和 CAF2 细胞,总共确定了 739 对显著相互作用的配体-受体对(图3C)。他们在每个细胞内筛选了 12 个代表性的配体-受体对,并通过免疫荧光验证了其中四个具有显著表达,即 GRN/SORT1、COL17A1/α11β1、COL1A1/α1β1和PLA2G2A/α5β1复合物(图 3D)。结果显示,GRN 在肿瘤区域有显著分布。SORT1 也在肿瘤区域表达,并且在基质区域有显著的存在,这表明 GRN/SORT1 可能促进上皮细胞和间充质来源的成纤维细胞之间的细胞相互作用。COL17A1 在上皮基底膜和肿瘤-间充质连接处的前缘表现出特异性浸润。COL17A1 在表达邻域内与整合素受体 α11 β 1 复合物紧密相邻处表达,表明前缘的恶性上皮细胞可能通过 COL17A1/α11 β 1 复合物配体-受体对与 CAF1 型细胞相互作用,从而促进 ISC-pEMT-CAF 样恶性表型。COL1A1 在基质区域和与整合素受体 α1 β 1 复合物相邻处表现出显著表达,表明 CAF1 型细胞通过 COL1A1/α1 β 1 复合物配体-受体对与免疫细胞相互作用。PLA2G2A 在间充质组织中表现出显著表达,并且同样位于整合素受体 α5 β 1 复合物旁边。
他们进一步分析了 OSF 衍生的 OSCC 免疫微环境中不同类型免疫细胞之间的配体-受体相互作用模式。在肿瘤微环境内的巨噬细胞、树突状细胞、T/NK 细胞、CAF1/2 细胞和其他细胞中总共鉴定出 4259 对显著相互作用的配体-受体对。此外,B 细胞与其他免疫细胞(例如 T/NK 细胞、树突状细胞和巨噬细胞)之间存在多对显著的配体-受体对。考虑到 OSF 衍生的 OSCC 基质区中各种免疫细胞的集中浸润,他们推测基质区中存在三级淋巴结构 (TLS)。TLS 是异位淋巴结构,由生发中心 B 细胞(GC B 细胞)浸润,并伴有滤泡 T 辅助细胞和滤泡树突状细胞 (FDC)。肿瘤组织中高水平的 TLS 浸润通常表明抗肿瘤免疫反应更强,临床结果更好。他们在 P1 和 P2 的切片中确定了四个具有 TLS 特征的区域。此外,根据之前发布的 ST 确定的 TLS 基因组,发现在所有四个 TLS 样区域中都存在与 TLS 相关的基因(TLS 特征)的显著表达(图 3E)。他们进一步利用P1中的多重免疫荧光染色验证了TLS的存在,发现在两个TLS样结构(即TLS-1和TLS-2)中观察到T细胞(CD3)和B细胞标志(CD20)的表达特征(图 3F),这与TLS的表达特点相符。

图3. OSF 衍生的 OSCC 中的免疫细胞、上皮细胞和 CAF 之间的潜在相互作用。
(A) 提取 ST 数据中与免疫细胞相对应的点(UMAP 图中左侧为淋巴细胞和 C8 和 C9 的髓系细胞,共计 1911 个点)进行二次归约聚类分析。(B) ST 图显示组织切片中五种免疫细胞的空间分布。 (C) 点图显示在每种免疫细胞中显著表达的三种配体-受体对。 (D) ST 特征图显示 P1 中免疫细胞、上皮细胞、CAF1 和 CAF2 中代表性配体-受体对的表达水平和空间分布。(E) H&E 染色组织切片的组织学特征和TLS 特征分数。(F) 多重免疫荧光显示 P1 中 TLS 样组织结构内 T 细胞标志物 (CD3) 和 B 细胞标志物 (CD20) 的空间表达。
04
SM 图谱揭示 OSF 衍生的 OSCC 中的代谢重编程
为了探索不同组织区域内的代表性代谢物,他们使用代谢物注释对 14673 m/z信息进行了注释。采用正交偏最小二乘判别分析(OPLS-DA),他们鉴定了每个组织区域内的差异富集代谢物 (DEM),其中恶性上皮区域的代谢物水平高于其他区域(图 4A),这与恶性过程中肿瘤细胞的代谢重编程和剧烈代谢相一致。随后,根据每个样本的组织病理学注释,他们选择了每个区域内十个最显著不同的m/z信息,证实了组织区域间显著的代谢差异(图 4B)。
氨基酸代谢在代谢活动和蛋白质生物合成中起着双重作用,与正常上皮细胞相比,肿瘤细胞对氨基酸的需求和消耗要高得多。在OSF衍生的OSCC中,天冬氨酸 ( m/z 133.0303 )、瓜氨酸 (m/z 198.0850)、精氨酸 (m/z 175.1189)、亚精胺 (m/z 146.1652) 和精胺 (m/z 203.2230) 等氨基酸代谢物在恶性上皮区域明显积聚,表明OSF衍生的OSCC具有活跃的多胺代谢和代谢重编程特征(图 4C)。

图4. OSF 衍生的 OSCC 的空间代谢组学图谱。
(A) 利用 AFADESI-MSI 平台建立 OSF 衍生的 OSCC 的空间代谢组学图谱。(B) MSI 图像显示四个样本每个组织病理区域中代表性代谢物的丰度和分布以及m/z信息。(C) MSI 图像展示四个样本不同区域氨基酸代谢的代表性差异代谢物的丰度。
05
活性多胺代谢是 OSF 衍生 OSCC 的代谢标志
多胺代谢是人体重要的含氮代谢通路之一。异常的多胺代谢不仅影响肿瘤细胞代谢通量的调控,而且通过参与细胞内的表观遗传修饰,广泛影响细胞存活、增殖等各种恶性生物学过程(图5A)。通过整合ST和SM数据,他们发现在OSF衍生的OSCC的多胺代谢通量中,代谢产物腐胺、亚精胺和精胺,以及相关酶鸟氨酸脱羧酶1(ODC1)、亚精胺合酶(SRM)和精胺合酶(SMS)在肿瘤区域表现出特定的分布。这表明异常的多胺代谢是 OSF 衍生的 OSCC 中突出的代谢表型,并可能在口腔上皮的恶性进展中发挥驱动作用(图5B)。他们进一步根据代谢通路分析了OSCC中多胺的合成和降解(图 5A),尿素循环是多胺的上游合成代谢通路。ST结果显示,参与精氨酸、鸟氨酸和瓜氨酸之间直接转化的代谢酶(即ARG1/2、OTC、NOS1)表达较低。只有尿素循环中参与调节天冬氨酸的酶精氨琥珀酸裂解酶(ASL)及其代谢物精氨琥珀酸显示出相似的空间分布模式(图 5C),这表明在OSF衍生的OSCC中尿素循环的整体代谢相对较低,并且鸟氨酸可能通过其他补偿途径在肿瘤细胞中维持。例如,先前的研究表明,谷氨酸和脯氨酸代谢产生的谷氨酸-1-半醛可作为鸟氨酸的补充前体代谢物。在OSF衍生的OSCC中,前体代谢物谷氨酸-1-半醛和相应的酶鸟氨酸氨基转移酶(OAT)表现出与鸟氨酸相似的空间分布模式,这表明OSF衍生的OSCC中鸟氨酸的合成主要依赖于谷氨酸-脯氨酸代谢途径(图 5D)。在正常生理条件下,细胞内的多胺主要以乙酰化形式排泄,一部分乙酰化多胺可以氧化为精胺或亚精胺,以维持细胞内的多胺水平。OSF 衍生的 OSCC 中亚精胺/精胺 N1-乙酰转移酶 1 (SAT1) 的区域特异性表达促进了肿瘤细胞中多胺的乙酰化(图 5E)。乙酰精胺和乙酰亚精胺在 OSF 衍生的 OSCC 中的分布和丰度有显著差异,多胺氧化酶 (PAOX) 的表达水平较低,这表明乙酰精胺主要从细胞中排泄,而不是通过 PAOX 依赖的途径补充亚精胺水平。作为腐胺的前体代谢物,乙酰亚精胺表现出与腐胺相似的空间分布和丰度,但 PAOX 的表达水平可能限制腐胺的合成(图 5E)。
他们分析了多胺代谢重编程对其他氨基酸代谢途径的影响。S-腺苷甲硫氨酸 (SAM) 是蛋氨酸补救途径的重要代谢物,通过提供丙胺底物参与下游多胺产物的合成(图 5A)。在 OSF 衍生的 OSCC 恶性上皮区,SAM 与其下游代谢物(亚精胺、精胺)以及其相关酶(AMD1、SRM、SMS)的表达之间观察到相似的空间分布,这可能是由组织中低水平蛋氨酸诱导的补救途径激活所致(图 5F)。作为多胺合成的代谢产物之一,5′-甲硫腺苷 (MTA) 在蛋氨酸补救途径和 ATP 补救途径中都发挥着重要作用。在OSF衍生的OSCC中, MTA水解为腺嘌呤可由APRT、AK3和NME2等磷酸酶催化,并用于ATP的补救合成,进一步表明多胺代谢协同激活蛋氨酸补救途径,以满足OSF衍生的OSCC恶性进展过程中的能量需求(图 5F)。值得注意的是,细胞内的蛋氨酸水平也可以通过同型半胱氨酸(HCY)来补充,并且SAM、 S-腺苷-L-同型半胱氨酸(SAH)和HCY之间存在可逆的代谢平衡(图 5G)。然而,样本中蛋氨酸合酶甲基四氢叶酸-同型半胱氨酸甲基转移酶 (MTR) 的低表达水平也表明 OSF 衍生的 OSCC 中的蛋氨酸补救途径主要通过 SAM 脱羧 SAM (dcSAM) 途径而不是 SAM-SAH 途径进行补充。此外,OSF 衍生的 OSCC 中 HCY 的积累也与l-胱硫醚的转氨作用有关,而这种转氨作用受到代谢酶胱硫醚γ-裂解酶 (CTH) 表达的限制,表明对 L-半胱氨酸合成的贡献相对较小(图 5G)。
最后,他们验证了 23 种多胺代谢酶(PM 酶)的表达与 OSCC 预后之间的功能相关性。通过分析 TCGA 中 OSCC 患者的 RNA-seq数据,发现多胺代谢酶表达水平较高与患者预后较差相关(图 5H),这与之前关于多胺代谢促进肿瘤发展的报道一致。综上所述,活跃的多胺代谢是 OSF 衍生的 OSCC 的重要代谢特征,其代谢重编程可能导致 OSCC 中的不良预后事件。
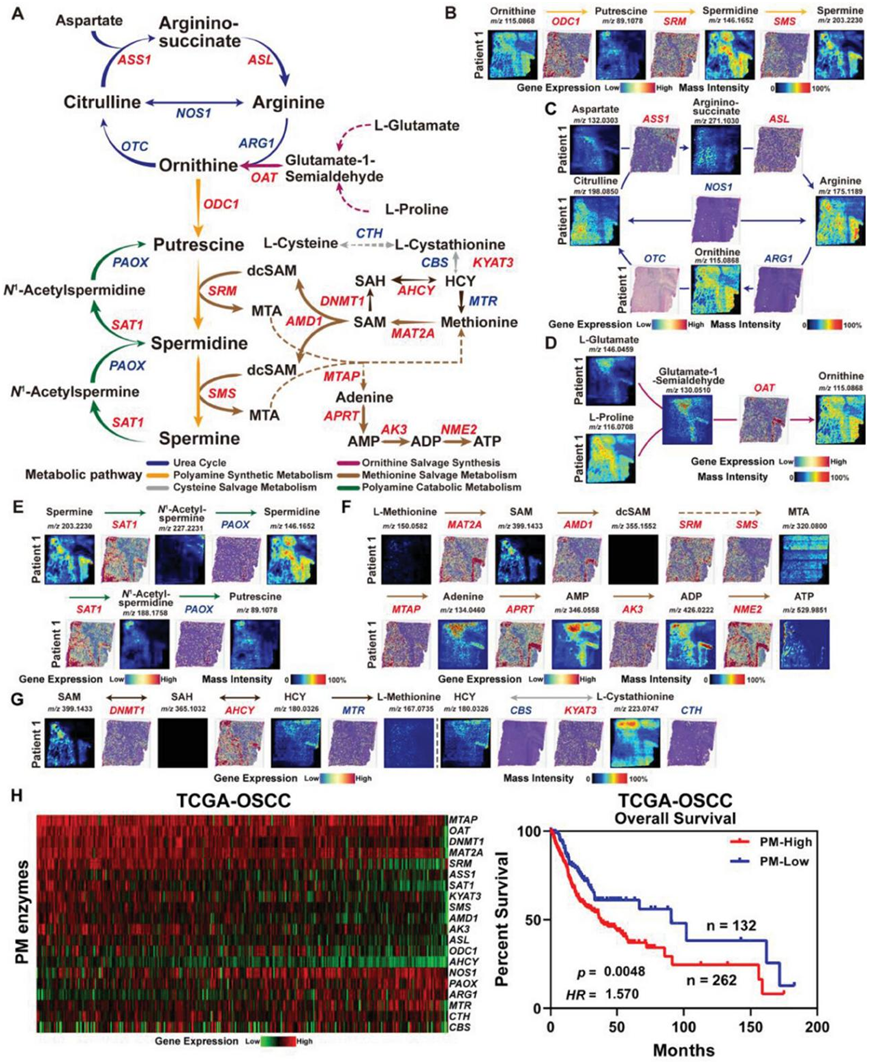
图5. OSF 来源的 OSCC 中多胺代谢的代谢重编程。
(A) 多胺代谢示意图。 (B) P1 的多胺合成代谢中必需代谢物和相关酶的空间丰度或表达。(C) P1 尿素循环中代谢产物和酶的空间分布特征。(D) P1 中鸟氨酸补救合成的 ST 和 SM 特征。(E) P1 中多胺分解代谢的空间多组学特征。(F) P1 中蛋氨酸补救代谢的空间多组学特征。(G) P1 中蛋氨酸补救合成和半胱氨酸补救合成的空间多组学特征以及不同 PM 酶表达水平的 OSCC 患者的 Kaplan-Meier 曲线。
+ + + + + + + + + + +
结 论
本项研究整合了空间转录组学和空间代谢组学的前沿技术,以获得癌细胞、成纤维细胞和免疫细胞的空间位置信息,以及OSF衍生的OSCC组织中的转录组和代谢组景观。这项工作首次揭示了一些OSF衍生的OSCC细胞在ISC区域内经历部分pEMT,最终获得成纤维细胞样表型并参与胶原沉积,证明了肿瘤微环境中上皮细胞、成纤维细胞和免疫细胞之间的复杂相互作用。最重要的是,发现 OSF 衍生的 OSCC 中存在显著的代谢重编程,包括异常的多胺代谢,可能在促进肿瘤发生和免疫逃避中发挥关键作用。本研究中的 ST 和 SM 数据为揭示 OSF 衍生的 OSCC 机制提供了新的见解。这项工作还为 OSCC 的预防和治疗提供了新的理论依据。
+ + + + +



 English
English


