文献解读|Cell Rep(7.5):血清蛋白质组揭示 H7N9 和 SARS-CoV-2 感染患者的独特分子特征
✦ +
+
论文ID
原名:Serum proteome reveals distinctive molecular features of H7N9- and SARS-CoV-2-infected patients
译名:血清蛋白质组揭示 H7N9 和 SARS-CoV-2 感染患者的独特分子特征
期刊:Cell Reports
影响因子:7.5
发表时间:2024.11.01
DOI号:10.1016/j.celrep.2024.114900
背 景
SARS-CoV-2 大流行对全球公共卫生构成了严重威胁。在 SARS-CoV-2 出现之前,甲型流感病毒是导致呼吸道疾病的主要病毒,对全球健康和经济构成了严重威胁。从 2013 年到 2017年,H7N9 流感病毒导致1000多例感染病例,511 例死亡,死亡率超过 50%。H7N9和SARS-CoV- 2有相似之处,两者都会引起咳嗽和发烧等早期症状以及肺炎、急性呼吸窘迫综合征和器官衰竭等严重症状。然而,H7N9更常导致淋巴细胞减少、腹泻和血栓,而SARS -CoV-2 可导致血小板减少。虽然两种感染的治疗策略相似,但针对其特定症状仍然具有挑战性。了解每种病毒不同的宿主反应、疾病严重程度因素和独特的生物标志物对于改善临床管理和有效预测结果至关重要。
实验设计
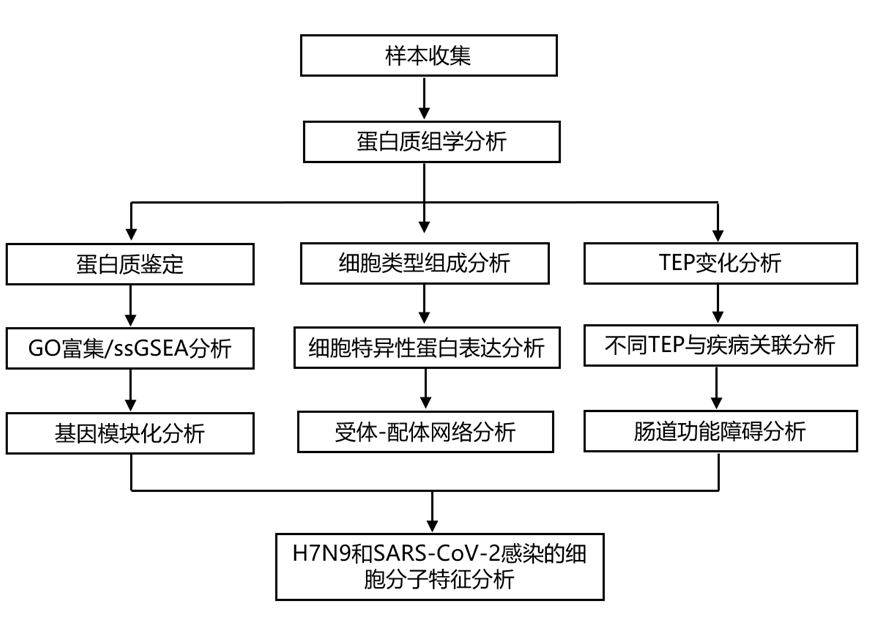
结 果
01
H7N9 病毒感染患者的血清蛋白质组改变
本项研究纳入了 2013 年 4 月 4 日至 17 日期间上海市公共卫生临床中心收治的 13 例患者、2020 年 1 月 31 日至 4 月 7 日期间上海市公共卫生临床中心收治的 37 例患者以及 12 例健康个体。病例组和健康对照者的年龄和性别相匹配。在 H7N9 病毒感染患者中,有 4 例患者诊断为中度,3 例患者诊断为中度并发展为重度,6 例患者诊断为重度,其中 3 例患者死亡,3 例患者出院。在 SARS-CoV-2 病毒感染患者中,有 15 例患者诊断为中度,6 例患者诊断为中度并发展为重度,16 例患者诊断为重度。
对 71 份血清样本(10 份 H7N9 病毒感染患者 [4 份中度症状,6 份重度症状] 的 28 份血清样本,31 份 SARS-CoV-2 病毒感染患者样本 [15 份中度症状,16 份重度症状] 的 31 份血清样本,以及 12 份健康个体血清样本)进行蛋白质组学分析(图 1 A)。对于 6 名重度 H7N9 病毒感染患者,在发病后的多个时间点 (TP) 采集样本。共鉴定出 7961 个蛋白质,平均每个样本 2300 个蛋白质。
为了确定 H7N9 感染的分子特征,他们比较了健康对照、H7N9 病毒感染患者和 SARS-CoV-2 病毒感染患者的蛋白质表达。GO富集分析显示,SARS-CoV-2 病毒感染患者 (HLA-E、CD4、CD8)中升高的蛋白质与 T 细胞受体信号传导和干扰素通路有关(图1B-G)。在 H7N9 患者中,具有 CXC 基序趋化因子受体 1 (CXCR1)、CXCR3 和 CC 基序趋化因子受体 3 (CCR3) 的蛋白质与中性粒细胞活化和趋化性有关(图 1G)。血液凝固蛋白(F2、F7、SERPINA3)在 H7N9 中升高,而 T 细胞活化标志物(CD8、CD4)在 SARS-CoV-2 中占主导地位(图1B-D)。在 SARS-CoV-2 患者样本中观察到较高的 CD8 + T 细胞数量,而在 H7N9 患者样本中的中性粒细胞数量较高(图1E-F)。通路分析证实了两种感染之间的差异(图 1G)。
为了阐明重症 H7N9 和 SARS-CoV-2 患者中独特的失调蛋白,他们使用 MCODE 算法进行了比较分析。在 H7N9 患者中,确定了七个模块,包括中性粒细胞迁移、趋化因子受体结合、凝血级联和血小板脱颗粒(图 S3 A)。在趋化因子配体和受体(配体:CCL1、CCL19/20、CXCL8;受体:CXCR3、CCR3/4/5/7/8)(模块 2)以及凝血(F2、F7)和补体因子(C1S、C1R)(模块 3)之间存在关键相互作用(图 S3 A)。在 SARS-CoV-2 患者中,发现了七个模块,包括受体酪氨酸激酶信号转导、鞘脂信号转导、干扰素信号转导、活性氧 (ROS) 解毒和适应性免疫反应(图 S3 B),其中 HLA 家族成员(模块 6)与 ROS 调节剂如谷胱甘肽过氧化物酶 2 (GPX2)、GPX3 和 GPX7 以及 PRDX6(模块 7)之间存在相互作用(图 S3 B)。
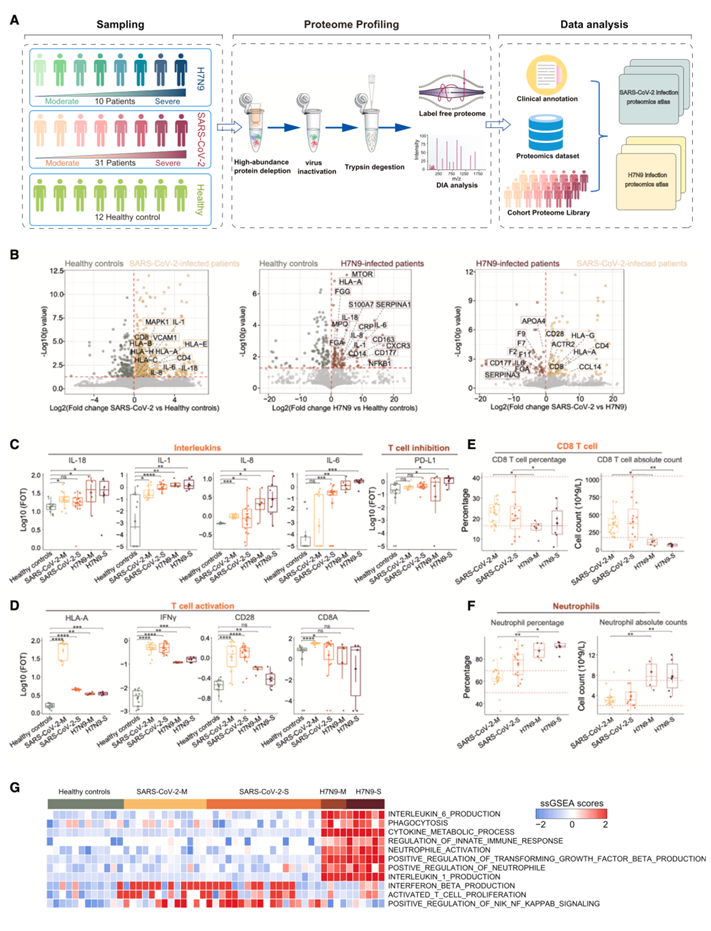
图1. 研究概况及 SARS-CoV-2 感染和 H7N9 感染疾病。
(A) 蛋白质组学实验流程示意图。(B) 火山图显示不同感染患者的蛋白质组学比较。(C-F)箱线图比较了不同样本中示例蛋白质和临床检测到的细胞的丰度。(G) 热图显示样本中示例通路的 ssGSEA 得分。
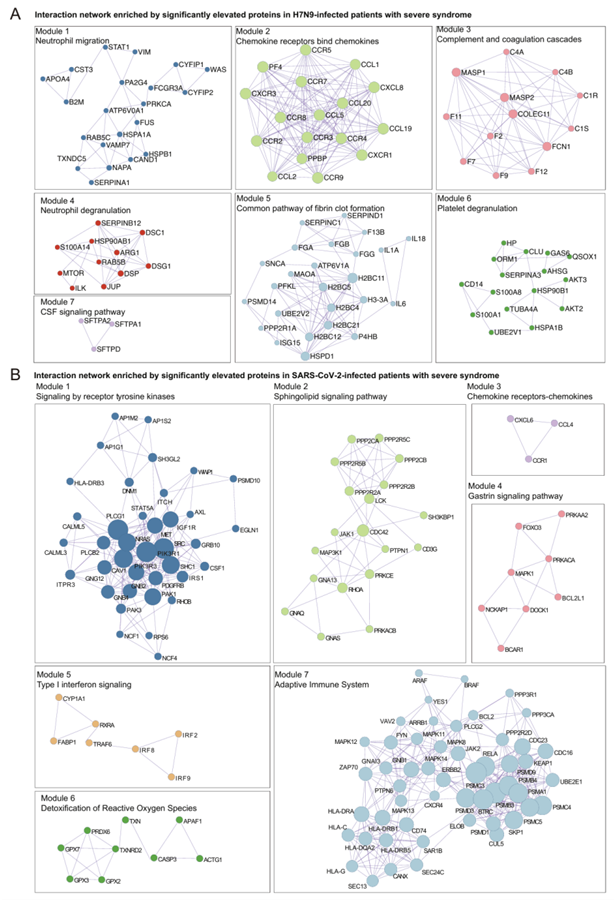
图S3. 生物学特征分析。
(A-B) 蛋白富集的相互作用网络分析。
02
中性粒细胞的积聚与 H7N9 感染的严重进展有关
然后,他们探索了与重症 H7N9 感染预后相关的蛋白质(图 2 A),其中进行了细胞类型反卷积分析以追踪具有不同结果(死亡或出院)的重症 H7N9 病毒感染患者的免疫病理学变化。在出院组中,患者的特征是沿样本采集 TPs的 CD8 + T 细胞、CD4 + T 细胞和 M1 巨噬细胞上调(图 2 B)。他们观察到细胞类型增强表达蛋白的表达持续增加(例如CD4 + /CD8 +T 细胞的 CD4、GZMB、ICD8A;中性粒细胞的 CD177、CXCR1、CSF3R)(图 2 B)。单样本基因集富集分析 (ssGSEA) 进一步显示,包括活化 T 细胞增殖、丝裂原活化蛋白激酶 (MAPK) 信号和 MAPKK 信号在内的通路表达增加,患者的预后良好(图 2 B)。相反,感染重症 H7N9 病毒并导致死亡的患者的特点是中性粒细胞中的多种蛋白活性升高(例如 CD177、FCGR3B、CXCR2)以及与先天免疫反应、中性粒细胞迁移和胞质分裂相关的通路在疾病进展过程中表达增加(图 2 B)。出院组的绝对 CD8 +和 CD4 + T 细胞数量持续上调,而死亡组的绝对中性粒细胞数量随时间推移而增加。值得注意的是,细胞特异性标志物(CD8A、CD4 和 CD177)与临床参数(CD8 + T 细胞、CD4 + T 细胞和中性粒细胞)之间存在显著的正相关性(图 2 C)。总体而言,蛋白质组学数据和临床指标均表明,不同的免疫细胞富集可能与 H7N9 感染的不同临床结果有关。
接下来,他们分析了配体-受体配对。在死亡患者中,IL-6 和 IL-8 以及中性粒细胞受体如 CCR3(与配体 CCL18 结合)均升高。相反,出院患者的 T 细胞受体 CCR2 和 CCR7(与配体 CCL2 和 CCL19 结合)增加(图2D-E)。值得注意的是,与蛋白质组学数据一致,临床检测到的血清 IL-6 和 IL-8 浓度在死亡组中也通常高于出院组(图 2F-G)。这些观察结果在公开发表的 H7N9 感染队列数据中得到了进一步证实(图 2F-I)。
重要的是,通过检测细胞因子表达与细胞反卷积算法得出的细胞类型富集之间的相关性,他们发现细胞因子 IL-6 和 IL-8 与中性粒细胞富集之间存在很强的相关性,而 T 细胞细胞因子(例如干扰素-γ、细胞毒性因子 GZMB 以及细胞因子受体 CXR3、CXCR4 和 FGFR1)与 T 细胞的富集呈正相关(图 2 J)。这表明中性粒细胞积聚和细胞因子释放导致 H7N9 预后不良,而 T 细胞募集有利于康复(图 2 K)。
这些研究结果强调了 T 细胞和中性粒细胞在决定严重 H7N9 感染结果方面的关键作用。T 细胞浸润有助于病毒消除,从而带来更好的临床结果,而中性粒细胞积聚和细胞因子过量产生与预后不良有关(图 2 K)。

图2. 中性粒细胞聚集与 H7N9 病毒感染患者的病情严重程度相关。
(A) 每个 H7N9 患者的样本采集时间表。(B) 热图显示了不同组 TP 的细胞类型组成(第一部分)、选定蛋白质的丰度(第二部分)和通路(第三部分)。(C) 细胞类型特征的蛋白质表达与临床检测到的绝对细胞计数的 Spearman 等级相关性。(D-E) 左侧的热图显示不同组中不同 TP 的配体和受体的表达模式。右侧的配体-受体接触图显示了配体与其同源受体之间的网络。(F-G) 箱线图比较了本研究队列(左)和公开队列(右)中出院组和死亡组之间的 IL-8和 IL-6浓度。 (H) 箱线图显示了 TP 中临床检测到的 IL-8(左)和 IL-6(右)浓度。(I) 蛋白质表达与临床检测到的 IL-8 和 IL-6 的 Spearman 等级相关性。(J) 火山图显示配体的蛋白质表达与中性粒细胞(左)和 T 细胞(右)的 xCell 信息细胞类型富集分数之间的相关性。(K) 图表总结了不同组中重要的蛋白质和信号变化。
03
血清中组织增强蛋白的变化揭示了 H7N9 和 SARS-CoV-2 感染对器官的不同影响
为了了解病毒感染对器官的影响,他们将 H7N9 和 SARS-CoV-2 患者的差异表达蛋白映射到人类蛋白质图谱 (https://www.proteinatlas.org/ ) 中。与健康对照相比,共有 681 种组织增强蛋白 (TEP) 的表达发生了改变:100 种 TEP 为 H7N9 独有,177 种为 SARS-CoV-2,402 种为两者共有。脑、肠、肝、肺、胰腺和睾丸蛋白受影响最严重。
进一步分析发现,虽然在H7N9病毒感染者和SARS-CoV-2病毒感染患者中都观察到了脑TEP和肝TEP的改变,但这些TEP的生物学功能表现出多样性。在H7N9病毒感染患者中,脑TEP与神经递质释放周期有关(如GABRB2、GRIA2),而在SARS-CoV-2病毒感染患者中,它们与囊泡和溶质载体(SLC)介导的运输有关(如SLC12A5、SLC17A7)。SARS-CoV-2病毒感染中的肝TEP参与代谢通路,而在H7N9病毒感染中它们与凝血有关(如F9、F2),这意味着在H7N9感染患者中参与更严重的凝血系统紊乱。有趣的是,对于 SARS-CoV-2 病毒感染,发现肺TEP的上调与氧化损伤和缺氧有关,表明 SARS-CoV-2 病毒感染患者的缺氧更为严重(图 3 A)。
此外,H7N9 病毒感染患者的肠道增强蛋白显著升高(包括 ACE2 和 APOA4 等蛋白质),这些蛋白参与中性粒细胞胞外陷阱形成、消化和吸收以及脂肪酸转运。相反,SARS-CoV-2 病毒感染患者的胰腺TEP表达增加,这些蛋白参与胰腺的基本功能,包括参与胰腺分泌(PNLPRP1、CPA2)和 G 蛋白偶联受体信号通路(PPY、GCG)的蛋白。他们发现 SARS-CoV-2 病毒感染患者的参与受精(TMPRSS12、ACR)和 HIF 信号通路(LDHAL6A、LDHC)的睾丸TEP增加(图 3 A)。
为了进一步研究 H7N9 和 SARS-CoV-2 病毒感染患者中与病情严重程度相关的组织疾病,他们分别比较了中度和重度患者的 TEP。总体而言,H7N9 病毒感染患者的 136 个 TEP 和 SARS-CoV-2 病毒感染患者的 138 个 TEP 从健康对照到轻度患者再到重度患者表现出逐渐增加的表达(图 3B)。与 H7N9 病毒感染患者相比,SARS-CoV-2 病毒感染患者中发现更多的脑TEP逐渐发生变化(图 3B)。功能富集表明,在 SARS-CoV-2 病毒感染患者中逐渐改变的脑TEP主要富集在无机阳离子转运和可溶性脂质转运通路中(图 3C)。值得注意的是,在 SARS-CoV-2 病毒感染患者中观察到调节血脑屏障和血脑脊液屏障的 SLC 转运蛋白逐渐升高,这意味着 SARS-CoV-2 病毒感染患者的血脑屏障功能障碍。在两个已发布的 COVID-19 数据集中也验证了 SLC(例如 SLC12A5、SLC17A7 和 SLC1A2)的逐渐升高(图 3D)。这些结果表明 SARS-CoV-2 更有可能突破血脑屏障,造成脑损伤(图 3E)。
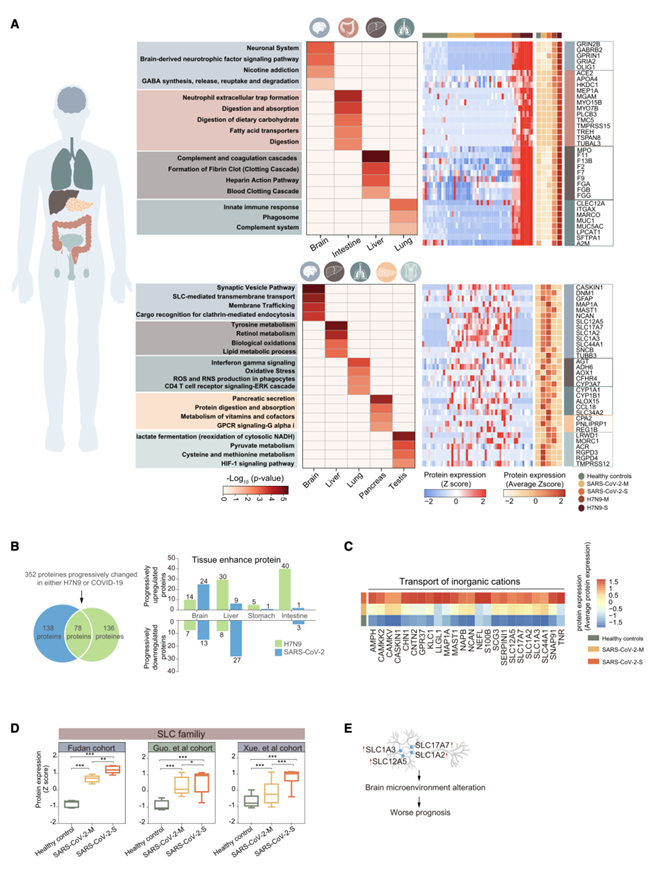
图3. H7N9病毒和SARS-CoV-2病毒对多器官的影响。
(A) 系统图总结了在不同病毒感染下显著升高的蛋白质和信号级联。(B) 维恩图和条形图显示表现出渐进性改变的组织增强蛋白质。(C) 热图展示了调节无机阳离子运输的脑增强蛋白质的表达模式。(D) 箱线图显示健康对照者和不同综合征的 SARS-CoV-2 病毒感染患者中 SLC 家族成员的蛋白质表达水平。(E) 系统图总结了血清中 SLC 蛋白的上调,表明脑环境改变和预后不良。
04
H7N9 感染者和 SARS-CoV-2 感染者的凝血系统紊乱
与 SARS-CoV-2 病毒感染患者相比,H7N9 病毒感染患者的关键补体成分(C4BPB、C8B、C8G 和 C6)和肝脏代谢酶(丙氨酸氨基转移酶 [ALT]、天冬氨酸氨基转移酶 [AST] 和 γ-谷氨酰转移酶 [GGT])的表达仅在疾病进展过程中呈现进行性升高。因此,在 H7N9 病毒感染患者中,临床检测到的作为炎症指标的 C 反应蛋白 (CRP) 以及血清 ALT、AST 和 GGT 水平也在疾病进展过程中显著升高(图 4 A-C)。这些结果表明 H7N9 感染可能导致更恶性的炎症反应和肝功能障碍。
值得注意的是,在凝血调节过程中富集的肝脏TEP在H7N9和SARS-CoV-2病毒感染患者的病情进展过程中表现出相反的表达模式。在H7N9患者中,包括F因子(FGB、F13B、F2和F7)和SERPIN蛋白(SERPINA1、SERPINA6和SERPINA7)在内的蛋白表达在伴随病情发展时增加,而在SARS-CoV-2病毒感染患者中则降低(图4D)。他们进一步结合患者的临床资料,验证两种病毒对患者凝血系统的影响。临床检测到的活化部分凝血活酶时间(APTT)随着H7N9疾病从轻度到重度的进展而下降,但在SARS-CoV-2病毒感染患者中呈现出相反的趋势(图4E)。除了这些发现之外,他们进一步观察到 F 因子、SERPIN 的表达与临床检测到的 APTT 之间存在显著的负关联(图 4 F)。
有趣的是,他们观察到血管内皮细胞随 APTT 时间的变化模式相似,即随着 COVID-19 疾病的进展而富集增强,但随着 H7N9 病毒感染患者的疾病进展而富集降低。此外,血管内皮细胞TEP(如 CD34、CLEC4M、MCMAM 和 PECAM1)的表达进一步支持了血管内皮细胞的功能障碍,这些蛋白在 COVID-19 患者的疾病进展过程中也逐渐增加,但在 H7N9 病毒感染患者的疾病进展过程中逐渐降低。这些结果表明,内皮功能障碍和肝损伤均与 H7N9 感染和 SARS-CoV-2 感染患者的凝血障碍有关,表明 H7N9 和 SARS-CoV-2 病毒对宿主凝血系统的影响不同,并强调需要对这两种感染采用不同的治疗策略(图 4 G)。
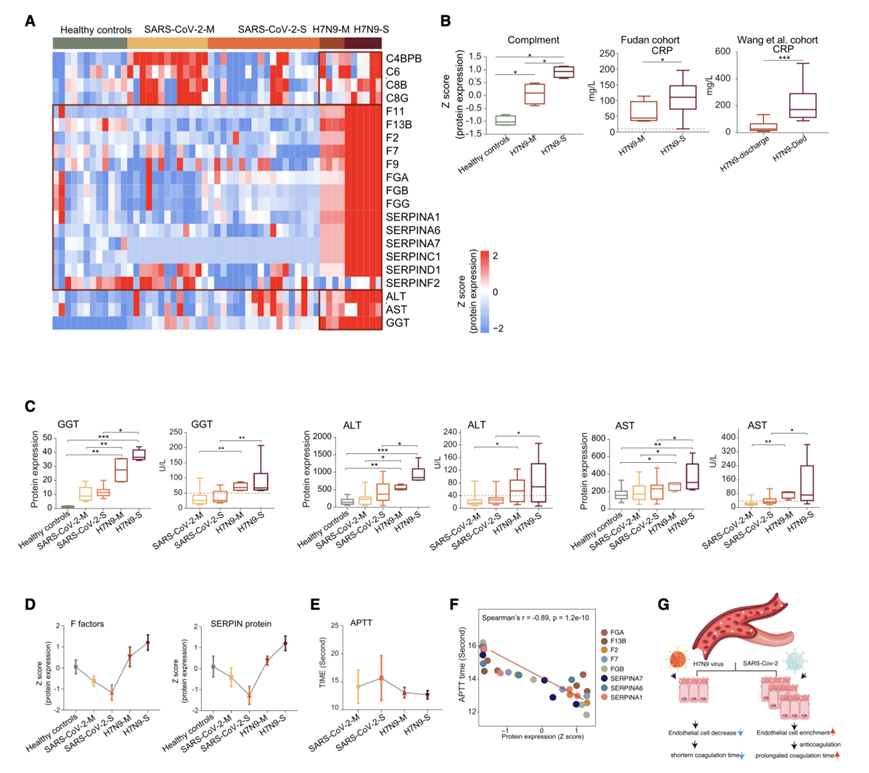
图4. SARS-CoV-2感染和H7N9感染对凝血系统的影响。
(A) 热图显示了不同感染患者肝脏增强蛋白的表达模式。(B) 箱线图显示本研究队列(中)和 公开队列(右)中样本的补体蛋白质表达水平(左)和临床检测到的 CRP。(C) 箱线图分别表示样本中的蛋白质表达水平(左)和临床检测到的 GGT、ALT 和 AST(右)。(D-E) 图表显示样本中 F 因子(左)和 SERPIN(右)的蛋白质表达水平以及临床检测到的 APTT。(F) F 因子、SERPIN(x 轴)和临床检测到的 APTT(y 轴)的蛋白质表达的 Spearman 等级相关性。(G) 系统图总结了 H7N9 和 SARS-CoV-2 病毒对宿主凝血系统的不同影响。
05
H7N9 重症患者在病情进展过程中出现多器官功能障碍
此外,肠道增强蛋白与疾病严重程度之间的关联仅在感染 H7N9 病毒的患者中观察到。更具体地说,随着感染从轻度发展到重度,富含碳水化合物消化和吸收(例如 SI、PLCB3、HKDC1)、消化和吸收(例如 MGAM、PGA3/4/5)和小分子运输(例如 APOA4、ATP4A)的肠道增强蛋白增加(图 5 A)。除了这一结果外,他们还发现临床检测到的钙卫蛋白(S100A8 和 S100A9)、连蛋白(zonulin)和 CRP(可以指示肠道疾病)在感染 H7N9 病毒的患者中均显著升高(图 5 B)。与健康对照组相比,中度和重度 H7N9 病毒感染患者的连蛋白、钙卫蛋白(S100A8 和 S100A9)和 SERPINA1(α1-抗蛋白酶)的蛋白质表达同样升高(图 5B)。他们进一步研究了 S100A 家族成员和 SERPIN 家族成员的表达,据报道它们在肠道炎症过程中发挥重要作用并调节导致炎症的炎症信号通路。结果显示,10 个 SERPINA 家族成员和 11 个 S100A 家族成员在重度 H7N9 病毒感染患者中占优势表达,进一步强调了 H7N9 感染期间的肠道功能障碍(图 5C)。
他们研究了 H7N9 病毒感染患者肠道增强蛋白升高是否与预后不良有关。时间分析显示 22 种 TEP,包括肠道、肝脏、脑和肺蛋白,这些蛋白随着时间的推移逐渐增加,与疾病恶化相关。具体而言,肠道TEP(如 ACSL5 和 APOA4)、参与凝血的肝脏增强蛋白(SERPINA10 和 C8B)和与神经元凋亡相关的脑蛋白(APLP1)以及肺粘附蛋白(如 CEACAM6)在预后不良的患者中表达升高。除此之外,两组重要的肠道TEP,S100A 家族成员和 SERPIN 家族成员,与 H7N9 病毒感染严重综合征患者的不良预后有关(图 5 D-E)。
由于观察到 H7N9 病毒感染患者的免疫病理变化与临床结果之间的关联,他们推测 H7N9 病毒感染患者的肠道功能障碍和免疫病理改变之间可能存在关联。通过进行相关性分析,他们发现 CD177(中性粒细胞标志物)与 9 种肠道增强蛋白(APOA4、ATP4A、CLCA1、HKDC1、KRT20、MUC13、MUC2、MYO15B 和 MYO1A)表现出最显著的关联,这些蛋白在预后不良的 H7N9 病毒感染患者的中增加。此外,在中性粒细胞募集中起作用的蛋白质(例如 CSF1R 和 IFTM1)以及参与 IL 和细胞因子产生的蛋白质(例如 CASP5、IL-6 和 AKT1)均与这 9 种肠道增强蛋白呈正相关。这一观察强调了中性粒细胞在驱动严重 H7N9 病毒感染患者的肠道功能障碍中的潜在作用。为了证实这一假设,他们研究了九种肠道增强蛋白与免疫细胞类型特征之间的关系。结果发现,中性粒细胞的蛋白质特征(如 HKDC1、KRT20 和 MUC13)与九种肠道增强蛋白呈正相关,而 CD4 +幼稚 T 细胞和中央记忆 T (Tcm) 细胞的蛋白质特征与九种肠道增强蛋白呈负相关(图 5 F)。除了这一发现之外,临床检测到的中性粒细胞绝对数量以及中性粒细胞富集评分也与九种肠道增强蛋白呈正相关,进一步证实中性粒细胞与重症 H7N9 感染患者的肠道功能障碍密切相关(图 5 G-H)。
为了从细胞水平上更好地理解H7N9感染期间的肠道功能障碍,他们构建了肠道特异性细胞类型和免疫细胞类型之间的共富集网络。分析显示,肠道杯状细胞、肠细胞和肠内分泌细胞与中性粒细胞、巨噬细胞和耗竭T细胞共同富集,表明它们之间存在潜在的细胞间通讯(图5 I)。中性粒细胞增强表达的细胞因子如CCL3和CCL4,以及炎症白细胞介素如IL-1、IL-6和IL-8,与肠道肠细胞中富集的受体表现出相似的表达趋势,表明增加的细胞因子分泌可能通过配体-受体介导的细胞通讯影响肠细胞(图5 J)。
总体而言,这些数据暗示了中性粒细胞的聚集和大量产生细胞因子可能导致肠道功能障碍并导致重症 H7N9 病毒感染患者的不良后果的可能机制,强调了监测中性粒细胞在 H7N9 病毒感染患者,特别是重症患者中的重要作用。
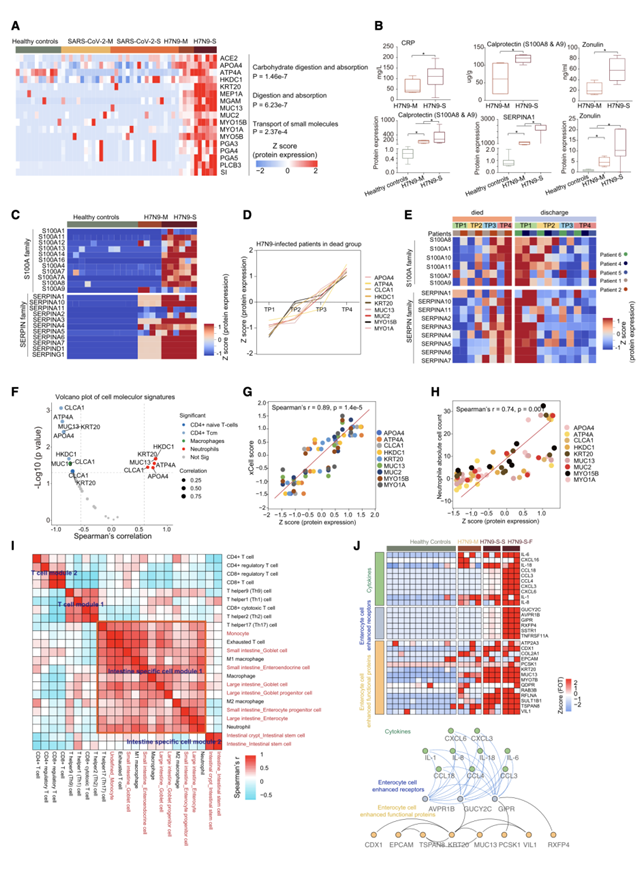
图5. H7N9病毒感染患者细胞因子大量分泌与肠道损害相关。
(A) 热图呈现了样本中肠道增强蛋白的表达模式。(B) 箱线图显示了临床检测到的 CRP、钙卫蛋白和连蛋白(上)以及样本中 S100A8/A9(钙卫蛋白)、SERPINA1 和连蛋白(下)的蛋白质表达的比较。(C) 热图呈现了不同综合征样本中 S100A 和 SERPIN 家族蛋白质的表达模式。(D) 线图显示预后不良的 H7N9 病毒感染患者中肠道增强蛋白在 TP 中的动态表达模式。(E) 热图展示了不同组 TP 中属于 S100A 和 SERPIN 家族的蛋白质的表达模式。(F) 火山图显示了肠道增强蛋白表达与细胞类型的 GSVA 评分之间的相关性。(G-H)肠道增强蛋白的蛋白质表达与 GSVA 评分和中性粒细胞绝对计数的 Spearman 等级相关性。(I) 热图显示肠道特异性细胞类型和免疫细胞类型的共同富集模块。(J) 热图显示了各组蛋白的表达情况:细胞因子(上)、肠细胞增强受体(中)和与肠细胞基本功能相关的蛋白(下)。
+ + + + + + + + + + +
结 论
本项研究对 H7N9 病毒或 SARS-CoV-2 病毒感染患者和健康对照者的血清样本进行了蛋白质组学分析。与 SARS-CoV-2 相比,H7N9 病毒感染导致中性粒细胞浓度升高、T 细胞耗竭和细胞因子/白细胞介素分泌增加。细胞类型反卷积和时间分析显示,T 细胞和中性粒细胞可以调节核心免疫轨迹并影响重症 H7N9 病毒感染患者的预后。组织增强蛋白升高与临床生化指标的改变相结合表明 H7N9 感染会在肝脏和肠道中引起更严重的炎症器官损伤和功能障碍。进一步的机制分析表明,高浓度的中性粒细胞可能通过细胞因子-受体相互作用影响肠道肠细胞,导致 H7N9 病毒感染患者的肠道损伤。
+ + + + +



 English
English


