文献解读|Nat Aging(16.6):人卵巢衰老的时空转录组变化及FOXP1的调控作用
✦ +
+
论文ID
原名:Spatiotemporal transcriptomic changes of human ovarian aging and the regulatory role of FOXP1
译名:人卵巢衰老的时空转录组变化及FOXP1的调控作用
期刊:Nature Aging
影响因子:16.6
发表时间:2024.04.09
DOI号:10.1038/s43587-024-00607-1
背 景
卵巢具有生育和分泌激素的功能,在女性的整个生殖寿命中起着至关重要的作用。卵巢功能在大约20至30岁时达到顶峰,30岁后开始衰退,然后在大约50岁时达到衰竭。随着全球预期寿命的延长,卵巢老化逐渐成为更年期女性的一个关键健康问题。
实验设计
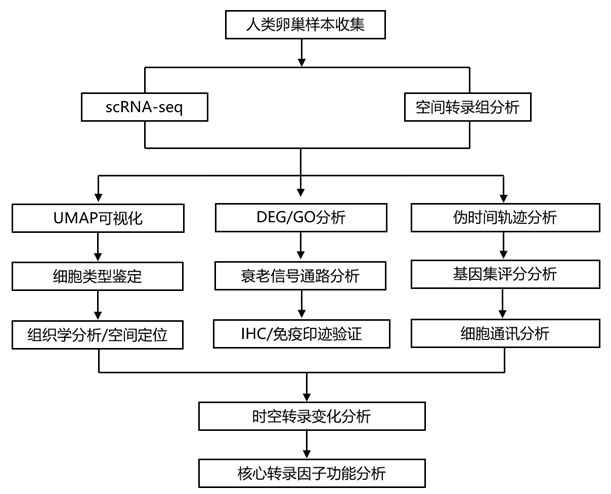
结 果
01
人类卵巢衰老时空分析
研究团队从因宫颈癌或子宫内膜癌接受子宫切除术和卵巢切除术的女性志愿者中总共收集了 15 个处于卵泡期的健康卵巢,15例卵巢组织根据年龄分为三组:青年组(Y;18~28岁)、中年组(M;36~39岁)和老年组(O;47~49岁)(图1a)。为了进一步阐明卵巢功能的动态变化,他们评估了血清抗苗勒氏管激素(AMH)的水平,这是一种用于评估卵巢储备功能的成熟临床生物标志物。AMH水平在年轻组中较高,在中年组中下降,在老年组中几乎检测不到。
他们对卵巢组织进行了单细胞转录组分析(scRNA-seq)和空间转录组分析(ST-seq)。使用统一流形近似和投影(UMAP)算法进行非线性降维分析,并根据特定细胞标记识别出八种细胞类型(图1b)。它们是颗粒细胞(GC)(GSTA1 +、AMH +和HSD17B1 +)、卵母细胞(TUBB8 +、ZP3 +和FigLA +)、卵泡膜和基质(T&S)细胞(DCN +和STAR +)、平滑肌细胞(SMC)(ACTA2+和MUSTN1 +)、内皮细胞(TM4SF1 +和VWF +)、单核细胞(TYROBP +和IFI30 +)、自然杀伤(NK)细胞(CCL5 +和NKG7 +)和 T 淋巴细胞(IL7R +和KLRB1 +),T&S 细胞占卵巢细胞的大部分。他们鉴定了卵母细胞和 GC 的特异性标记,包括经典标记 ZP3 和编码初级 β-微管蛋白亚基的 TUBB8 的卵母细胞特异性分布。 GSTA1 专门存在于 GC 中,可能作为 GC 的潜在标记。为了验证细胞聚类的准确性,他们对每种细胞类型的标记基因进行了GO分析(图1c)。GC 中高表达的基因富含调节激素水平的基因,而卵母细胞中的基因则与卵母细胞分化相关。T&S 细胞表现 “细胞外基质组织”和“胆固醇转移活性”富集,SMC 表现出“肌肉系统过程”和“细胞骨架组织”通路的富集。
利用 scRNA-seq 图集,进行因子分析以推断每个点可能的单细胞组成,从而有效定位所有 scRNA-seq 聚类。可识别的细胞类型,包括位于卵泡中心的卵母细胞(图1d)、卵泡周围的 GC(图1d)、广泛分布的 T&S 细胞(图1d)和 沿着血管的SMC/内皮细胞(图1d)。免疫细胞主要分布在髓质间质,包括单核细胞、NK细胞和T淋巴细胞(图1d)。空间细胞图谱揭示了scRNA-seq预测的人类卵巢细胞聚类的空间分布。
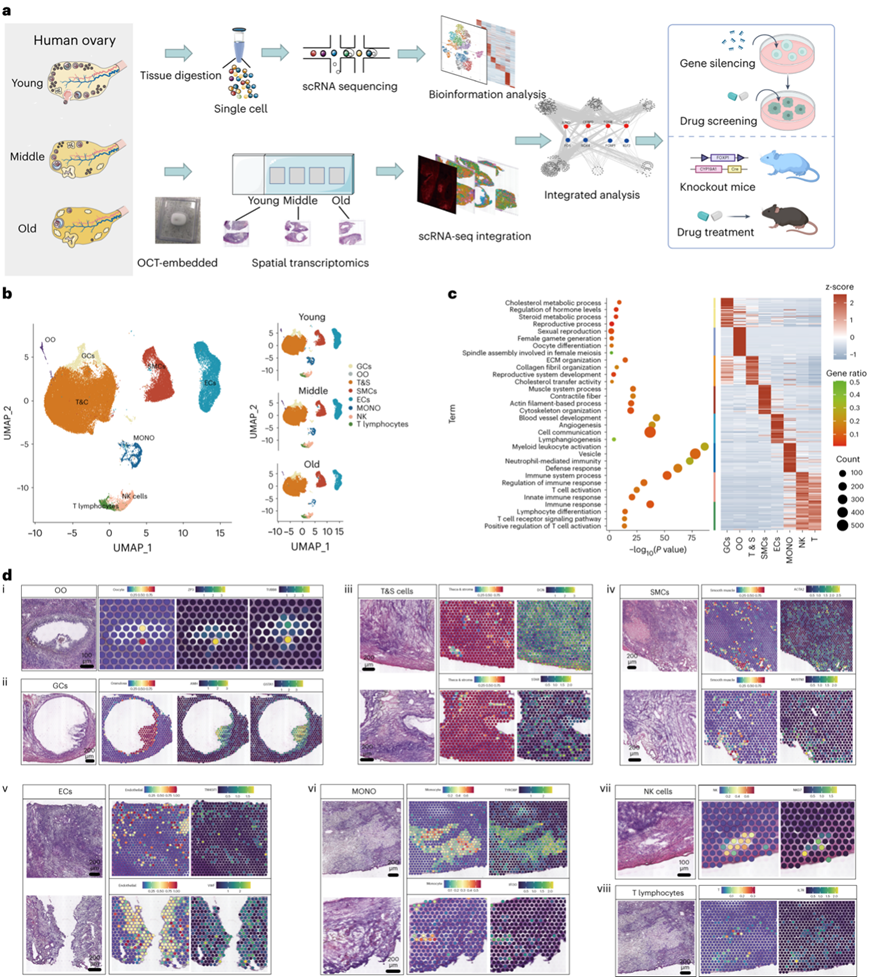
图1. 人类卵巢细胞的单细胞转录组分析和空间位置。
(a) 实验流程图。(b) UMAP 图显示八种细胞类型(左)和年龄依赖性细胞分布(右)。(c)GO分析(左),显示每种细胞类型中前 50 个标记基因的热图(右)。 (d) 每种细胞类型的 H&E 染色、ST 点细胞类型预测和特征标记。
02
卵巢衰老转录程序的细胞特异性变化
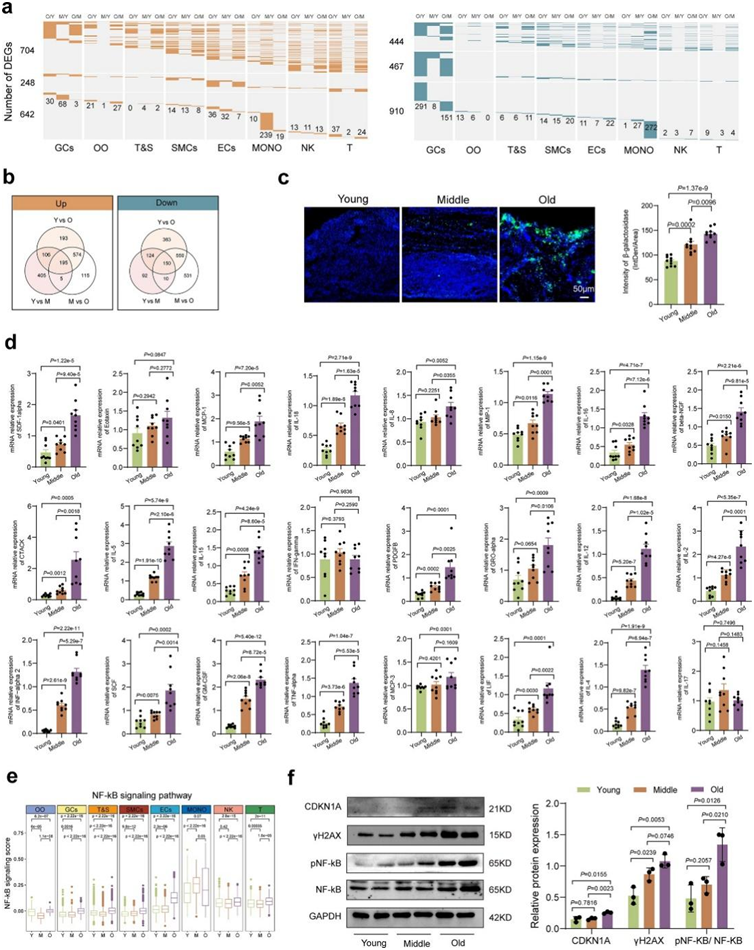
他们对年轻、中年和老年组的不同卵巢细胞类型的基因表达模式进行了比较分析。 鉴定出至少一种细胞类型中的差异表达基因(DEG)(图S3a)。其中,在O/Y、M/Y和O/M组中分别鉴定出1068、711和889个基因表达上调的DEG(图S3b)。在O/Y、M/Y和O/M组之间分别鉴定出1187、376和1241个下调的deg(图S3b)。DEG 分析强调了围绝经期卵巢与年轻或中年阶段具有生殖功能的卵巢之间的显著差异。 GO和KEGG富集分析显示,上调的DEGs主要与细胞衰老以及一些与衰老相关的通路有关,如FoxO信号通路、IL-17信号通路、核因子(NF)-κB信号通路、NOD样受体信号通路、p53信号通路和PI3K-Akt信号通路(图2a)。下调的DEG主要与细胞迁移、细胞外基质(ECM)-受体相互作用、雌激素信号通路、细胞外囊泡、氧化磷酸化、血小板活化、肌动蛋白细胞骨架和紧密连接的调节有关(图2a)。基于上述结果,细胞衰老可能在人类卵巢衰老中发挥重要作用。在衰老过程中,大多数卵巢细胞的衰老信号通路评分增加(图2b)。空间基因表达数据的通路分析进一步表明,衰老卵巢的卵泡、皮质和髓质中细胞衰老和衰老相关分泌表型(SASP)信号通路的富集程度更高(图2c)。值得注意的是,脂褐素(细胞衰老的标志)的积累在卵巢衰老过程中增加(图2d)。基于荧光的 β-半乳糖苷酶 (β-gal) 染色进一步说明了卵巢衰老过程中的持续增加(图S3c)。主要衰老标志CDKN1A/p21在老年组的所有卵巢细胞类型中表达增加(图2e)。使用ST数据的空间表达分析证实了CDKN1A在卵巢衰老过程中总体增加(图2f)。为了检测表达 CDKN1A 的卵巢细胞类型,他们采用了多重免疫组织化学 (IHC)。研究结果揭示了卵巢衰老过程中CDKN1A阳性细胞的积累,特别是在GC和T&S细胞中,GSTA1和DCN染色证明了这一点(图2g)。使用细胞因子寡核苷酸阵列检查 SASP 发现,衰老卵巢中的 SASP 表达增加(图2h,图S3d)。NF-κB信号通路的激活已知会诱导SASP并加剧细胞衰老,在衰老过程中在大多数卵巢细胞类型中观察到了NF-κB信号通路的激活(图S3e)。免疫印迹结果进一步支持卵巢衰老期间与细胞衰老相关的标记物(CDKN1A、γH2AX和pNF-κB)的增加(图S3f)。总之,这些发现表明,老年人类卵巢中的特定细胞类型可能表现出与细胞衰老相关的独特特征。
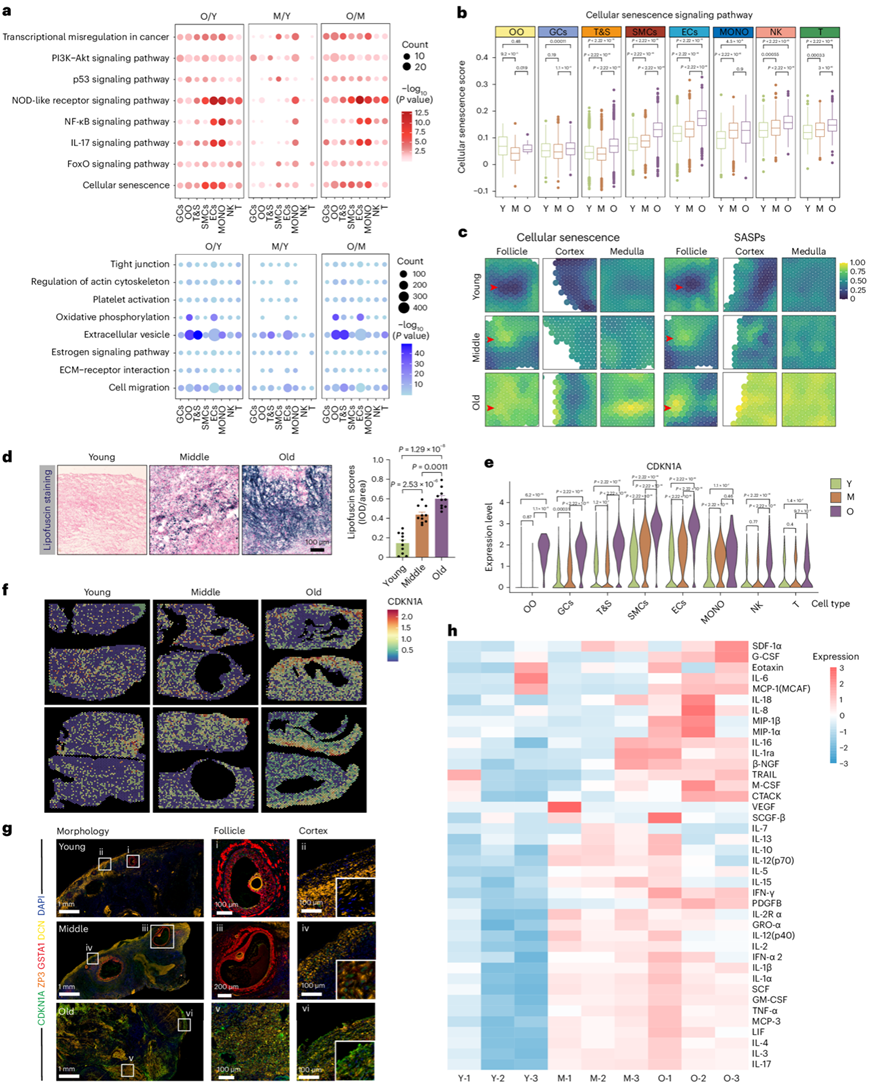
图2. 整个卵巢衰老过程中细胞类型特异性转录调控程序的时空变化。
(a) 八种细胞类型中 O/Y、M/Y 和 O/M 组之间上调 DEG(上)和下调 DEG(下)的代表性 KEGG 通路进行比较。 (b) 不同组(Y、M和O)的各种卵巢细胞类型的细胞衰老通路的基因集评分分析。 (c) ST 点显示人类卵巢内的细胞衰老和 SASP 评分。(d) 不同年龄的人类卵巢的脂褐质染色。(e) 小提琴图显示所有卵巢细胞类型中CDKN1A的表达。(f) ST点指示不同年龄的人卵巢中CDKN1A的表达。(g) 不同年龄人类卵巢的CDKN1A、ZP3(卵母细胞标记)、GSTA1(GC标记)和DCN(T&S细胞标记)的多重IHC染色。(h) 不同年龄的人类卵巢中SASP的细胞因子寡核苷酸阵列。
图S3. 不同细胞类型中基因表达的补充在人类卵巢衰老过程中发生变化。
(a)热图显示老年组和年轻组(O/Y)、中年组和年轻组(M/Y)以及老年组和中年组(O/Y)之间每种细胞类型的上调和下调DEG。(b)三组共有的DEG的维恩图。(c)基于荧光的β-Gal对年轻、中年和老年组的人卵巢进行染色。(d)通过RT-qPCR检测不同年龄的人卵巢中SASP的相对mRNA表达。(e)不同组的八种卵巢细胞类型中NF-κB信号通路的基因集评分分析。(f)通过Western blot检测人卵巢中细胞衰老相关基因的蛋白表达。
03
卵巢衰老过程中卵母细胞的时空变化
对卵母细胞的伪时间轨迹进行了分析,确定了三个阶段(聚类 a、b 和 c)(图3a)。年轻组的卵母细胞表现出三种类型的分布,而中年组的卵母细胞主要位于聚类a,而老年组的所有卵母细胞都位于聚类c(图3b)。伪时间分析显示,年轻组的卵母细胞处于轨迹的开始阶段,而老年组的卵母细胞处于终点状态,表明衰老过程中存在基因开关(GeneSwitch)(图3c)。在聚类a中,富集的通路包括“靶向膜的共翻译蛋白”、“核转录mRNA分解代谢过程”和“翻译起始”(图3d)。聚类b显示出“含胶原的细胞外基质”、“细胞外基质组织”和“细胞粘附的正向调节”的富集(图3d)。在聚类c中,丰富的通路包括“细胞凋亡”、“双链断裂修复”和“细胞器裂变”,表明卵母细胞中存在DNA损伤和细胞凋亡(图3d)。
接下来,他们比较了卵母细胞老化过程中的 DNA 损伤和修复基因列表并生成了分数。老化卵母细胞中DNA损伤评分增加而DNA修复评分下降(图3e)。经典DNA损伤反应基因(例如STAT3和EIF4A1)的表达在老年卵母细胞中显著增加,而关键DNA修复基因(例如APEX1和RAD1)则下调。IHC 结果支持原始阶段老化卵母细胞中 DNA 氧化(8-OHdG 阳性)和 DNA 损伤(γH2AX 阳性)的积累。总体而言,DNA 损伤增加和 DNA 修复减少可能会导致原始或初级阶段卵母细胞的衰老。
随后,CellPhoneDB 用于研究衰老过程中卵母细胞与其他卵巢细胞类型之间的细胞通信。值得注意的是,卵母细胞和其他细胞类型之间的相互作用在老年组中显著增强(图3f)。衰老卵母细胞表现出受体-配体对MDK-LRP1表达升高,其在慢性炎症和炎症细胞募集中发挥关键作用(图3g)。他们重点关注 ST 点内 MDK 和 LRP1 的共表达,揭示了卵母细胞和周围细胞中的广泛表达,在老年组中观察到得分较高(图3h),与IHC染色结果一致(图3i)。这些结果表明,MDK-LRP1 表达增加与衰老人类卵巢中卵母细胞和其他卵巢细胞之间的细胞通讯增强之间存在潜在关联。在数据中发现的相互作用可能会导致炎症反应,从而加剧衰老过程中卵母细胞的 DNA 损伤。
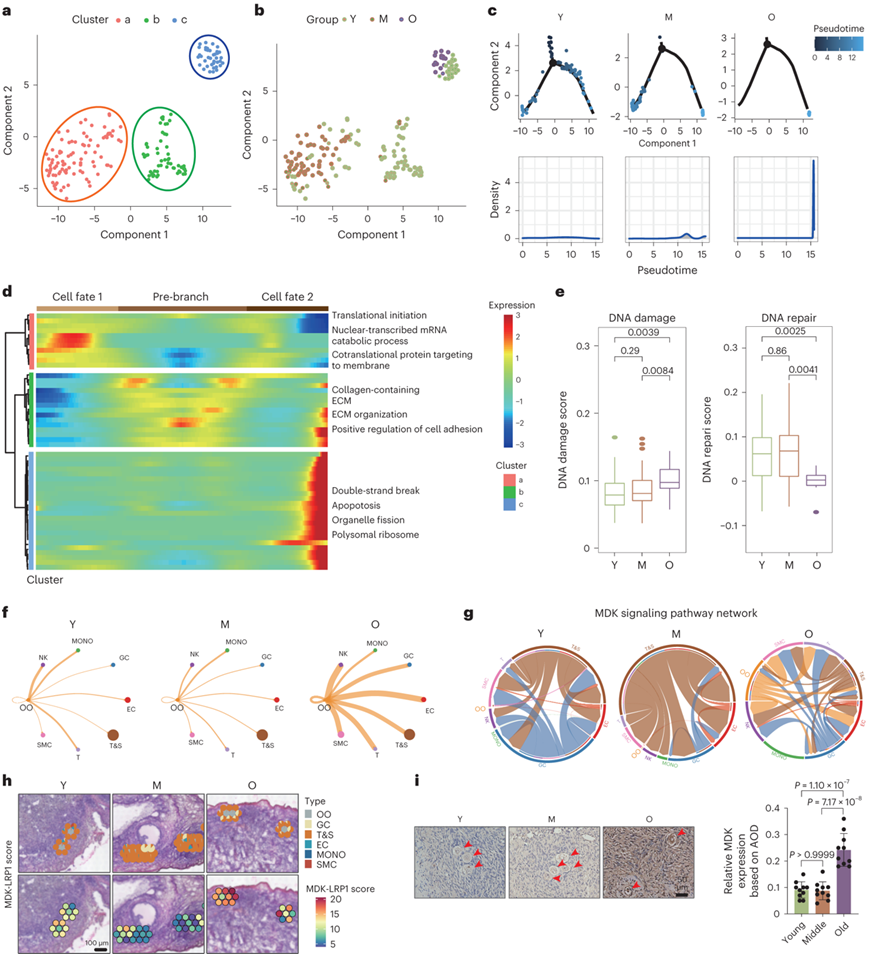
图3. 衰老过程中卵母细胞的时空变化。
(a) 卵母细胞的伪时间轨迹图。(b) 年轻、中年和老年组卵母细胞的 UMAP 图。(c) 来自年轻、中年和老年组的伪时间排序图。(d) 热图显示沿伪时间的动态 DEG。(e) 不同组卵母细胞DNA损伤和DNA修复通路的基因集评分分析。(f)卵母细胞与其他卵巢细胞间的细胞通讯分析。(g) Y、M和O组中卵母细胞的MDK信号通路网络。(h) ST点显示Y、M和O三组卵巢中卵母细胞及其周围细胞中MDK-LRP1的得分。(i) 通过 IHC 对 MDK 蛋白进行染色的来自 Y、M 和 O 人卵巢切片的卵母细胞的代表性图像。
04
衰老过程中GC的时空转录变化
UMAP分析将所有GC分为三个亚型(GC亚型1、2和3)(图4a)。分析表明,年轻组的GC主要是GC亚型1和2,而老年组的GC主要是GC亚型3(图4b)。GC亚型1表达已知的标记物,如AMH、FST、HSD17B1、SERPINE2和PRKAR2B,以及以前未报道的基因,如DSP和MAGED2(图4c)。GO 分析强调了 GC 亚型 1 中“ATP 代谢过程”和“间隙连接”的富集,这些过程涉及卵泡发育。GC亚型2表现出与激素合成相关的基因的表达,包括INSL3、APOE、GSTA1、APOA1、FDX1和CYP17A1(图4c)。GC亚型3表达标记物DCN、LGALS1和LGALS3,这些标记物是已知的GC凋亡和细胞周期的调节因子(图4c)。
值得注意的是,ST 数据揭示了不同区域的三个不同的 GC 群体。GC亚型1位于窦卵泡的卵丘中,亚型2位于卵泡的壁层中,并且亚型3表现出跨窦卵泡的广泛分布(图4d)。使用亚型特异性标记(亚型 1 的 AMH、亚型 2 的 GSTA1 和亚型 3 的 LGALS1)进行的实验验证证实了这些不同的空间分布(图4e)。在GC亚型1中,对于GC中类固醇生成至关重要的类固醇生成酶基因HSD17B1的表达较高(图4e)。亚型2以高水平表达 APOE,它是类固醇生成过程中胆固醇运输的关键参与者(图4e)。GC 亚型 3 中 HSD17B1 和 APOE 均不表达,表明该亚型中激素合成减少。随后,他们通过使用 Monocle 推断状态轨迹来探索 GC 中的动态状态和细胞转变。分析表明,GC 亚型 1 位于轨迹路径的起点(图4f-g)。早期GC亚型1主要分布在年轻和中年卵巢中,而老年样本中的GC主要分布在GC亚型3的末端,表明卵巢衰老过程中GC中存在基因转换(GeneSwitch)(图4h)。
为了研究细胞衰老是否会在衰老过程中经历GC亚型的变化,他们计算了细胞衰老评分,揭示了在衰老卵巢中三种类型的 GC 均有所增加(图4i)。免疫染色分析证实老化卵巢GC中CDKN1A蛋白水平升高(图4j)。与中青年组相比,老年组的GC表现出更高水平的细胞衰老和SASP,尤其是GC亚型1(图4k)。此外,从21岁至47岁接受辅助生殖治疗的参与者中获得原代人类GC(hGC),以进一步探索细胞衰老(图4l)。hGC 中的 SASP 表达随着年龄从 22 岁到 47 岁逐渐增加(图4m)。这些结果表明细胞衰老是衰老GC的一个潜在特征,这可能导致衰老过程中卵巢功能障碍。
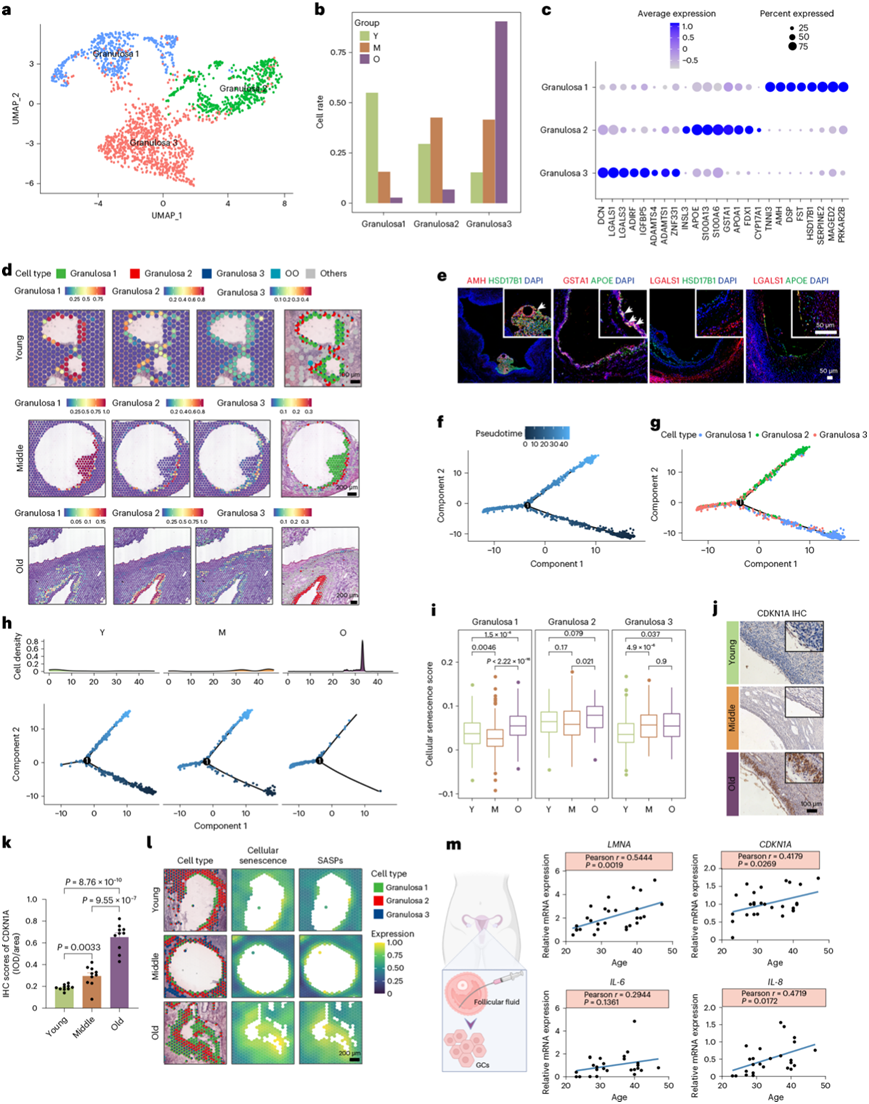
图4. 三个 GC 亚群在衰老过程中的时空转录变化。
(a) GC 亚聚类的 UMAP 可视化。(b) 柱状图显示Y、M和O组中三个GC亚聚类的细胞率。 (c) 点图显示GC亚聚类的前八个标记。(d) 每个亚聚类的空间聚类分布(左)和与H&E染色重叠的ST点(右)。(e) 亚型GC标记物的多重IHC染色。(f-g) GC 的伪时间排序分析。(h) Y、M 和 O 组的伪时间有序 GC 的二维图。(i) GC 亚型随年龄变化的细胞衰老通路的基因集评分分析。(j) IHC 检测的三组 GC 中 CDKN1A 表达的代表性图像。(k) GC 中 CDKN1A 的 IHC 评分。(l) 三组GC中细胞衰老的ST点叠加和SASP基因集评分。(m) 原代人GC(hGC)中SASP水平与年龄的相关性分析。
05
T&S细胞衰老过程中的时空变化
通过 UMAP 分析,他们鉴定了五种具有不同转录组学特征的 T&S 细胞亚型(图5a)。亚型1以STAR和CYB5A表达为特征,表现出丰富的RNA和蛋白质合成过程(图5b-c)并在卵巢髓质中广泛分布(图5d)。亚型2表达ECM基因,如COL1A1和COL3A1,与“细胞外囊泡”和“细胞外基质”通路相关,位于卵泡周围(图5b-d)。表达肌成纤维细胞标记物ACTA2和TAGLN 的亚型 3 ,显示出位于血管周围的超分子纤维通路和细胞骨架蛋白结合的富集(图5b-d)。亚型4,由FBLN1和CXCL2表达定义,与位于外皮层的“对化学反应”和“对刺激反应的调节”通路相关,可能参与卵巢抵御外部应激的防御(图5b-d)。亚型5的特征是表达CD74、HLA-DRB1、CCL4和HLA-DRA的炎症样成纤维细胞,富含与“抗原加工和呈递”、“细胞对干扰素-γ的反应”和补体级联相关的通路,可能参与其中在排卵后修复中。利用T&S亚型细胞的标记物进行进一步的实验验证(图5e)。
通过分析状态轨迹研究了 T&S 细胞的动态状态和细胞转变。 T&S细胞的亚型2占据了轨迹路径的初始阶段(图5f)。他们还分析了年轻、中年和老年组的 T&S 细胞轨迹。值得注意的是,早期T&S细胞主要存在于年轻和中年样本中,而老年样本中的T&S细胞主要出现在过渡路径的末端,这表明T&S细胞类型在衰老过程中可能发生变化(图5g)。
在衰老过程中,所有T&S细胞亚群的细胞衰老评分均增加(图5h),同时衰老细胞中CDKN1A表达上调(图5i)。ST数据证实CDKN1A升高,尤其是位于皮质的亚型4中,与IHC结果一致(图5j)。分析ST数据进一步揭示了老化T&S细胞中SASP因子的显著增加,包括HMGA1、PIM1和CAV1(图5k)。为了验证衰老过程中 T&S 细胞中 SASP 的上调,来自 23 至 47 岁女性卵巢的原代 T&S (pT&S) 细胞表现出与衰老相关的 HMGA1、PIM1、CAV1 和 NF-κB 增加,这与 scRNA-seq 和 ST 分析一致(图5l)。这些发现共同表明卵巢衰老过程中 T&S 细胞存在衰老样特征。
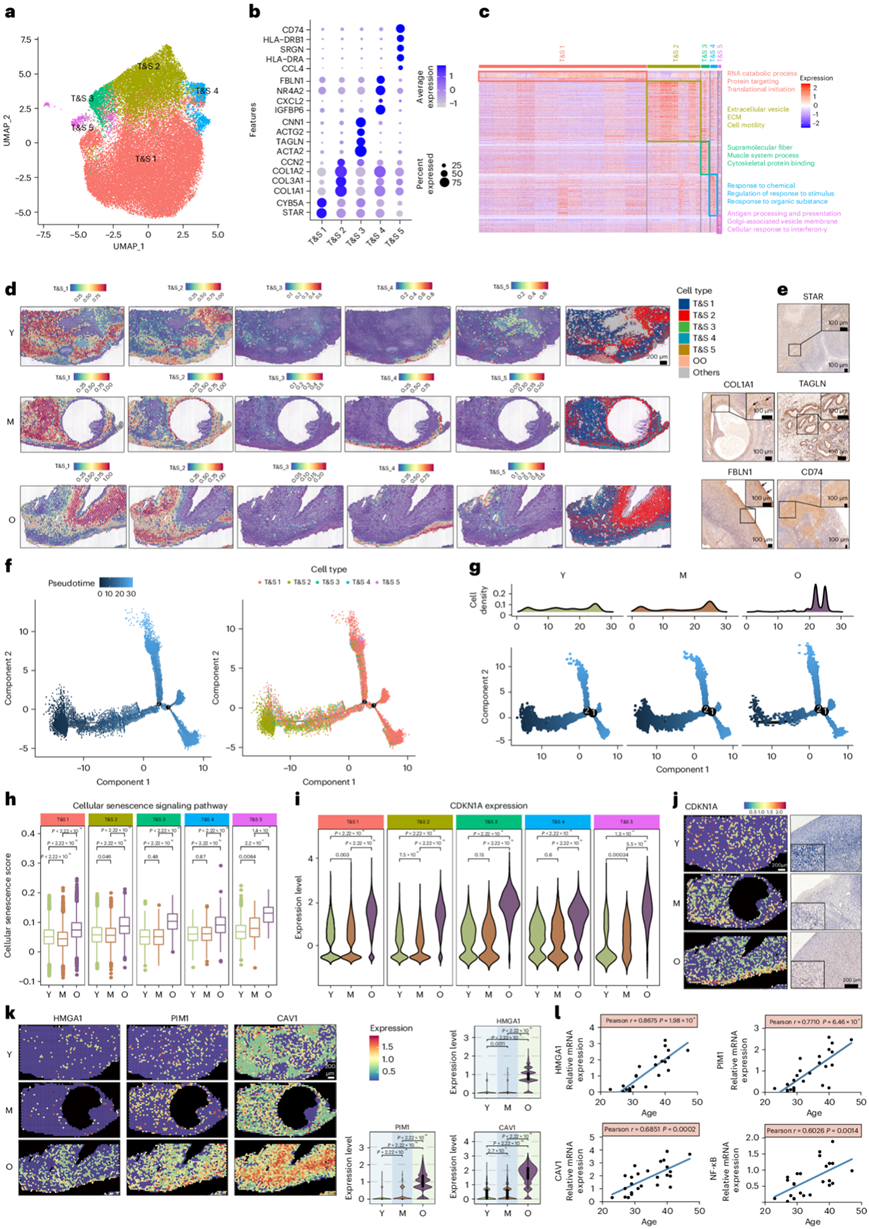
图5. 衰老过程中 5 个 T&S 细胞亚群的时空变化。
(a) T&S 细胞亚聚类的 UMAP 可视化。(b) 显示顶部 T&S 细胞亚聚类标记的点图热图。(c) 热图显示了 T&S 亚型细胞中高表达的基因和通路。(d) 每个亚聚类的空间聚类分布(左)和与H&E染色重叠的ST点(右)。 (e) T&S 亚型细胞标记物的 IHC。(f) T&S 细胞的伪时间排序分析(左)。亚类型用颜色标记(右)。(g) 年轻、中年和老年组的伪时间排序 T&S 细胞的二维图。(h) T&S亚型细胞随年龄增长的细胞衰老通路的基因组评分分析。(i) 小提琴图,显示五个 T&S 细胞亚群中 CDKN1A 的表达。(j) 三组 T&S 细胞中 CDKN1A 表达的 ST 斑点叠加(左)和 IHC 检测的 CDKN1A 表达的代表性图像(右)。(k) 三组T&S细胞中SASP(HMGA1、PIM1和CAV1)表达的ST点重叠。(l) 人卵巢pT&S细胞中SASP水平与年龄的相关性分析。
06
FOXP1是体外卵巢细胞衰老的核心转录调节因子
细胞衰老是卵巢衰老的潜在因素,尤其是 GC 和 T&S 细胞。他们采用单细胞调控网络推理和聚类分析来识别 GC 和 T&S 细胞中的核心转录因子 (TF)。 TF分析显示,FOXP1、SOX4和FOS在两种细胞类型中表达均降低,可能在卵巢衰老中发挥关键作用(图6a-b)。随后,他们使用小干扰 RNA (siRNA) 敲低人类 GC 系 (COV434) 中的FOXP1、SOX4和FOS ,以研究它们对卵巢衰老的影响。
人类卵巢中的 FOXP1 表达显示 hGC 和 pT&S 与年龄相关的减少(图6c)。通过蛋白质印迹和 IHC 在衰老的卵巢中证实了这种下降(图6d-e)。使用siRNA,他们沉默了COV434和pT&S细胞中的FOXP1,导致衰老相关(SA)-β-gal染色增加(图6f)。此外,在 FOXP1 敲低后,与细胞衰老和 DNA 损伤相关的蛋白质上调(图6g)。FOXP1耗竭还减少了5-乙炔基-2'-脱氧尿苷(EdU)阳性和Ki67阳性细胞的数量(图6h),表明细胞增殖受损。
GO分析表明上调基因在“刺激反应”和“免疫反应”中富集,而下调基因与“细胞发育过程”和“细胞分化”相关(图6i)。值得注意的是,si-FOXP1组中衰老标志物(CDKN1A、CDKN2A和CDKN2B)和SASP(IL-6、TNF和CXCL8)升高,而细胞周期相关基因(CCNA1、CCNB1和CCND1)降低(图6j)。Si-FOXP1 还增加了与细胞衰老和免疫炎症相关通路的表达,表明 FOXP1 沉默会在转录组水平上诱导 GC 衰老。
染色质免疫沉淀(ChIP)-qPCR证实FOXP1与CDKN1A启动子结合(图6k),表明FOXP1通过抑制CDKN1A转录来抑制卵巢细胞衰老。双荧光素酶报告基因测定表明,FOXP1 激活降低了野生型(WT)CDKN1A 启动子的活性,并且 CDKN1A 启动子 1535-1573 中的 FOXP1 突变消除了这种效应(图6l)。COV434中慢病毒介导的FOXP1上调减少了SA-β-gal染色和CDKN1A表达(图6m-p)。总之,这些结果表明 FOXP1 通过与其启动子结合来抑制 CDKN1A 转录,从而深入了解 FOXP1 在预防卵巢细胞衰老中的作用机制。
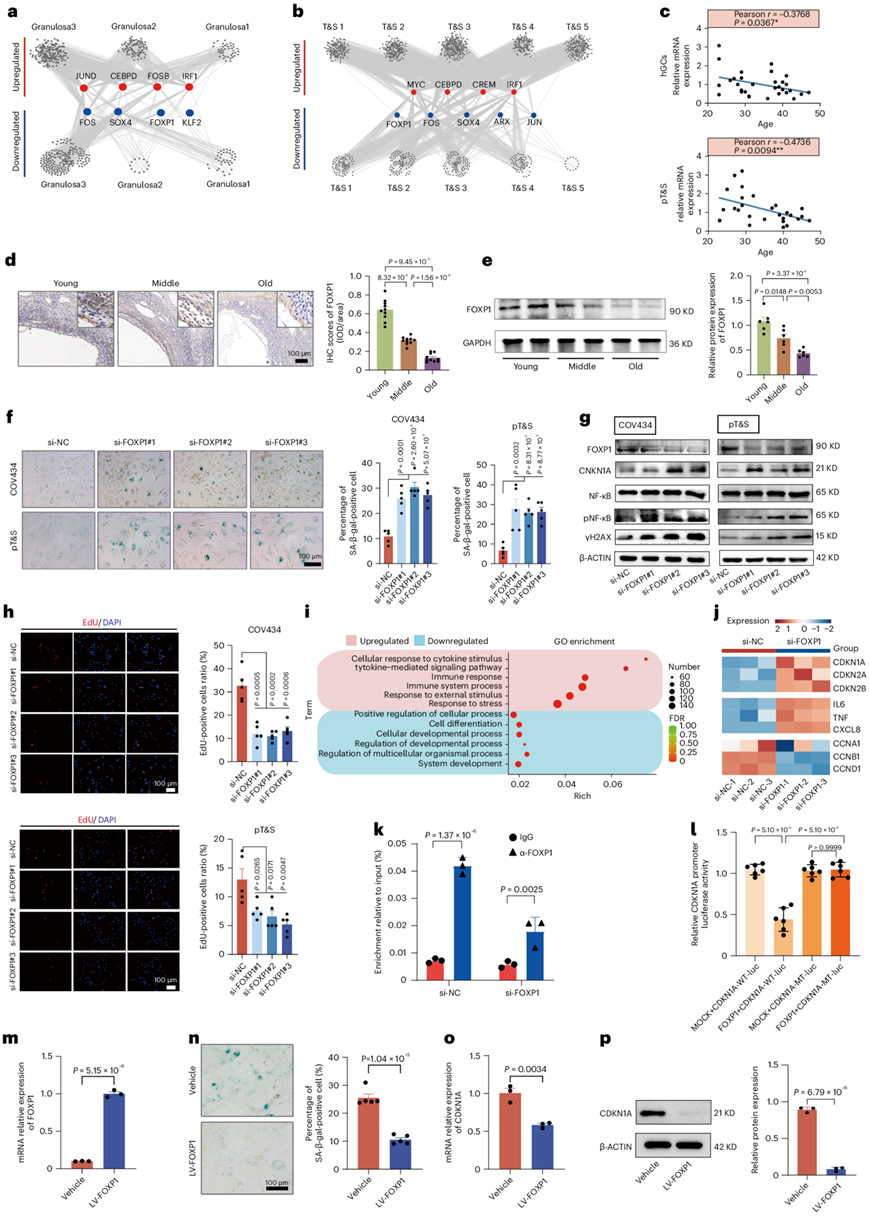
图6. FOXP1 在卵巢衰老中的作用。
(a) 三种 GC 亚型中的调控转录因子网络。(b) 五种 T&S 子类型的TF 网络。(c) hGC和pT&S中FOXP1表达与年龄的相关性分析。(d) 卵巢中FOXP1的表达。(e)免疫印迹分析。(f) SA-β-gal染色。(g) 与细胞衰老相关的基因的蛋白质表达。(h) EdU标记分析。(i) GO分析。(j) SASP和细胞周期相关基因的表达。 (k) 在 CDKN1A 启动子处使用 FOXP1 抗体进行 ChIP-qPCR。(l) WT和突变体(MT)CDKN1A启动子荧光素酶(luc)报告基因的活性。(m) COV434 中 FOXP1 过表达后的 mRNA 表达。 (n) SA-β-gal染色。(o) CDKN1A的mRNA表达。(p) COV434中CDKN1A的蛋白表达。
+ + + + + + + + + + +
结 论
本项研究结合了scRNA-seq和空间转录组学来系统地表征人类卵巢衰老,观察了衰老过程中八种卵巢细胞的时空分子特征。对与年龄相关的基因表达变化的分析表明,DNA 损伤反应可能是卵母细胞衰老的关键生物学通路。确定了三种颗粒细胞亚型和五种卵泡膜和基质细胞亚型,以及它们在衰老过程中的时空转录组学变化。 FOXP1 是卵巢衰老的调节因子,随着年龄的增长而衰退,并抑制 CDKN1A 转录。这些发现提供了对人类卵巢衰老的时空变异性的全面了解,有助于确定潜在诊断生物标志物和治疗策略的优先顺序。
+ + + + +



 English
English


