文献解读|Gut Microbes(12.8):多组学揭示脱氧胆酸通过肠道微生物群调节胆汁酸代谢,对抗四氯化碳引起的慢性肝损伤
✦ +
+
论文ID
原名:Multi-omics reveals deoxycholic acid modulates bile acid metabolism via the gut microbiota to antagonize carbon tetrachloride-induced chronic liver injury
译名:多组学揭示脱氧胆酸通过肠道微生物群调节胆汁酸代谢,对抗四氯化碳引起的慢性肝损伤
期刊:Gut Microbes
影响因子:12.8
发表时间:2024.02.28
DOI号:10.1080/19490976.2024.2323236
背 景
慢性肝病(CLD)的特点是持续性肝损伤以及肝脏内长期发生的病理变化。脱氧胆酸 (DCA) 在肝脏的生理和病理过程中发挥重要作用;然而,慢性肝损伤中 DCA、肠道微生物群和代谢之间的关系仍不清楚。
在肺炎克雷伯菌引起的肝脓肿和菌血症小鼠模型中,补充 DCA可以改善肝损伤并减轻炎症。一种包含 DCA 接枝壳聚糖和齐墩果酸的新型纳米复合材料已证明对四氯化碳(CCl4) 诱导的肝损伤具有保肝作用。然而,DCA 有益作用的确切机制仍未完全阐明,需要进一步研究以阐明 DCA 影响肝脏疾病发生、进展和治疗干预的机制。
实验设计
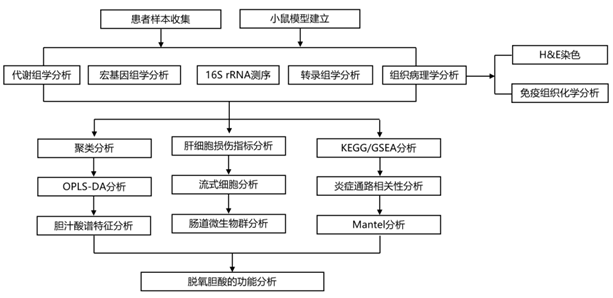
结 果
01
实验设计和程序以及CLD 患者的胆汁酸谱
36只雄性C57BL/6J小鼠随机分为6组:对照组(Control)、实验组(CCl 4)、DCA+CCl4治疗组(CCl 4 +DCA)、DCA+CCl 4联合抗生素(Abx)混合物治疗组(CCl4 +DCA+Abx)。每组由六只小鼠组成。对照组小鼠给予正常饮食。 CCl 4组小鼠腹腔注射CCl4(以橄榄油1:40稀释,2.5%,5 μL/g),为期5周。CCl4+DCA组在注射CCl4前三天接受含有0.2%DCA的饮用水(0.2克脱氧胆酸钠粉末溶于100毫升无菌饮用水中),并持续到注射CCl4 5周后结束。CCl4 +DCA+Abx组小鼠在DCA治疗前通过灌胃给予抗生素混合物9天,并持续到CCl4注射的五周期结束。在实验期结束时,对小鼠实施安乐死,并收集其血浆、肝脏和盲肠内容物的样本进行后续分析(图1)。
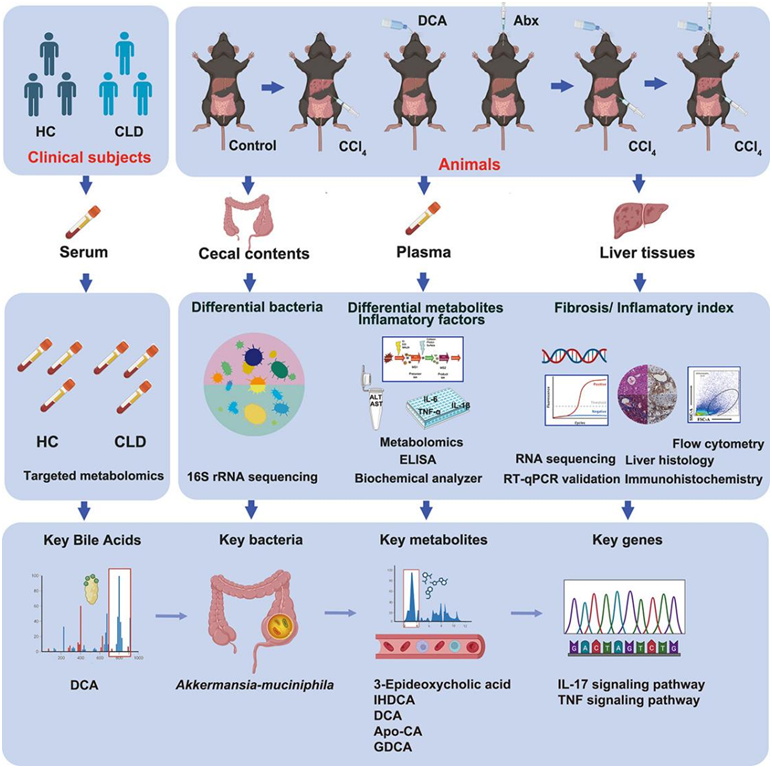
图1. 实验设计与流程。
本研究于2021年7月至2022年11月在福建医科大学附属第一医院入组受试者。招募的参与者包括 10 名诊断患有非酒精性脂肪性肝炎 (NASH) 的个体、10 名患有酒精性肝病 (ALD) 的个体、10 名患有原发性胆汁性胆管炎 (PBC) 的个体和 20 名健康对照 (HC) 个体,所有参与者的年龄和性别均匹配。
聚类分析图和正交偏最小二乘判别分析 (OPLS-DA) 证明不同病因的 CLD 患者和健康对照 (HC) 之间的胆汁酸(BA)谱存在显著差异(图2a-b)。与 HC 相比,CLD 患者的 DCA、23-去氧胆酸 (23-DCA) 和 3β-脱氧胆酸 (3β-DCA) 水平降低(图2c-d),这凸显了 CLD 患者的 BA 代谢失调。
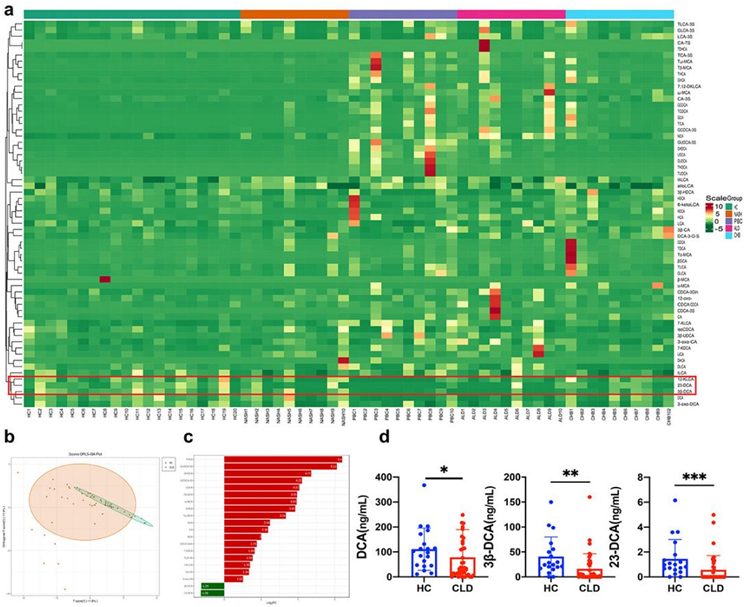
图2. CLD 患者胆汁酸谱的特征。
(a) 比较 CLD 患者和健康对照的热图聚类分析。(b) OPLS-DA 评分图说明 CLD 患者和健康对照之间的差异。(c) 描绘慢性肺病患者和健康个体之间代谢物水平差异的条形图。(d) 直方图显示与健康对照相比,CLD 患者的 23-DCA、3β-DCA 和 DCA 水平。
02
DCA通过肠道微生物群拮抗 CCl4诱导的肝脏炎症
他们观察了六组小鼠的肝脏表面形态,Control、DCA和Abx组肝脏表面健康、红润、光滑,而CCl4组和CCl4 +DCA+Abx组肝脏颜色相对苍白,表面粗糙不平。CCl4 +DCA组的小鼠肝脏外观不如对照组,但与CCl4组和CCl4 +DCA+Abx组相比,外观更红且不规则性更少,没有观察到肝脏大小的显著变化(图3a)。
使用 H&E 染色的组织学分析显示对照组、DCA 和 Abx 组没有显著变化。而CCl4组则表现出肝细胞形态丧失、细胞核增大、胞质疏松伴中央空泡化、点状坏死、胞质嗜酸性粒细胞增多、胞质颗粒和胞核消失、炎症细胞浸润和聚集等形态学破坏。相比之下,CCl4 +DCA组表现出肝脏病变严重程度显著降低,包括肝细胞坏死减少和汇管区炎症细胞减少。值得注意的是,CCl4 +DCA+Abx组中肠道微生物群的消耗导致了肝组织改变,表明肠道微生物群消耗后DCA对肝脏炎症的抑制作用减弱(图3b)。
免疫组织化学分析显示,与对照组相比, CCl4 组肝组织中F4/80和CD86的表达显著增加,表明巨噬细胞,特别是I型巨噬细胞增加。相反, 与CCl4组相比,CCl4+DCA组的肝脏巨噬细胞和I型巨噬细胞显著减少,表明DCA对CCl4诱导的巨噬细胞增加具有拮抗作用。有趣的是,与 CCl4 +DCA 组 相比,CCl4+DCA+Abx 组肠道微生物群的消耗导致肝脏巨噬细胞和 I 型巨噬细胞显著增加,表明拮抗作用DCA 对巨噬细胞增加的影响在肠道微生物群耗尽后显著减弱(图3c-f),各组之间的肝脏指数没有差异(图3e)。
在对照组、DCA和Abx组中没有观察到ALT和AST水平的显著变化,表明对肝细胞损伤的影响很小。相反,与对照组相比,CCl4组的 ALT 和 AST 水平显著升高。与CCl4组相比,CCl4 +DCA组的ALT和AST水平显著降低,证明DCA具有抵消血浆ALT和AST水平增加的能力。然而,与CCl4 +DCA 组相比,CCl4 +DCA+Abx 组的 ALT 和 AST 水平显著增加,表明 DCA 在缓解血浆升高方面的有效性大幅降低肠道微生物群耗尽后 ALT 和 AST 水平(图3g)。

图3. DCA对小鼠肝脏炎症病理及血浆生化指标的影响。
(a) 肝脏典型外观。(b) H&E 染色的代表性肝脏组织学。(c) 肝组织中F4/80的免疫组化染色。(d) 肝组织中CD86的免疫组化染色。(e) 各组小鼠肝脏指数。(f) 肝组织中F4/80和CD86的组织化学染色的定量结果。(g) 血浆 ALT 和 AST 水平。
03
通过流式细胞分析,DCA 减少了肠道微生物群诱导的肝脏炎症细胞群
与对照组相比, CCl4组显示肝组织内的炎症细胞显著增加,表明由于CCl4注射导致大量浸润。相反,与CCl 4组相比,CCl4 +DCA组的肝组织炎症细胞显著减少,表明DCA能够对抗CCl4诱导的小鼠慢性肝损伤中的炎症细胞浸润。与CCl4 +DCA组相比,CCl4 +DCA+Abx 组肝组织炎症细胞显著增加,表明DCA对肝脏炎症的抑制作用显著减弱。 (图4a)。ELISA分析显示对照组、DCA组、Abx组小鼠血浆炎症因子无明显变化。与对照组相比, CCl4组的IL-6、TNF-α和IL-1β水平显著升高。然而,与CCl4组相比,CCl4 +DCA组这些炎症因子的水平显著降低,表明DCA可以抵消CCl4诱导的慢性肝损伤小鼠炎症因子表达增加。与CCl4 +DCA组相比,CCl4+DCA+Abx组肝组织中IL-6、TNF-α和IL-1β的水平显著升高,表明 DCA 抵消肠道微生物群耗竭后小鼠肝脏炎症因子表达增加的能力显著减弱(图4b)。
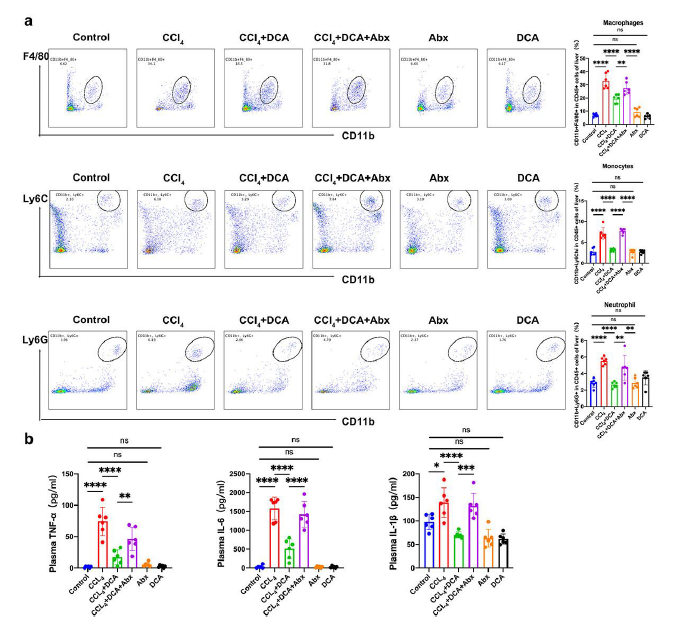
图4. DCA 对小鼠肝脏炎症细胞和血浆炎症因子的影响。
(a) 通过流式细胞检测肝脏炎症细胞[流式细胞术图(左)和条形图(右)]。(b) TNF-α、IL-6 和 IL-1β 的血浆水平。
Masson染色显示对照组、DCA和Abx组没有明显的纤维增生。然而,CCl4组在汇管区周围表现出明显的纤维增生。相反,CCl4 +DCA组显示纤维增殖和桥接减少,表明DCA处理导致肝脏胶原纤维含量显著降低。与 CCl4 +DCA 组相比,以肠道微生物群耗竭为特征的 CCl 4 +DCA+Abx 组显示汇管区周围纤维增殖显著增加(图5a)。与对照组相比,CCl4组的α-SMA和胶原蛋白I的表达增加。然而,与CCl4组相比,CCl4 +DCA组表现出α-SMA和胶原蛋白I的表达降低,表明DCA能够降低它们的表达。与CCl4 +DCA 组相比,CCl4 +DCA+Abx 组显示 α-SMA 和胶原蛋白 I 的表达增加,表明肠道微生物群耗竭后 DCA 的作用减弱(图5b-d)。
此外,他们还检测了肝脏中 α-SMA 和 I 型胶原蛋白的 mRNA 表达水平。与对照组相比,CCl 4组的α-SMA和胶原蛋白I mRNA表达显著增加。然而,与CCl4组相比,CCl4 +DCA组的α-SMA和胶原蛋白I mRNA表达显著降低,这表明DCA能够显著降低它们的表达。值得注意的是,在CCl4 +DCA+Abx组中,与CCl4 +DCA组相比,α-SMA和胶原蛋白I mRNA表达显著增加,表明表明在肠道微生物群耗竭后,DCA 对它们的 mRNA 表达的影响减弱(图5e)。
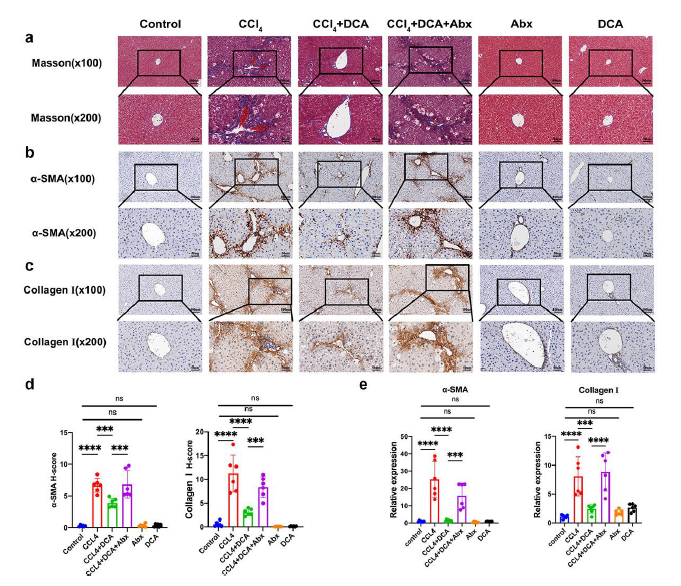
图5. DCA对小鼠肝纤维化病理及mRNA表达的影响。
(a) 肝组织Masson染色。(b) α-SMA 的免疫组织化学染色。(c) α-SMA 的免疫组织化学染色。(d) α-SMA和胶原蛋白I的组织化学染色的定量结果。(e) 肝组织中 α-SMA 和 I 型胶原蛋白的 mRNA 表达。
04
DCA 调节肠道微生物群以对抗 CCl 4诱导的慢性肝损伤
在这项研究中,他们对盲肠内容物进行了 16S rRNA 测序,以阐明 DCA、肠道微生物群和肝损伤之间的相互作用。对 α-多样性的分析表明,DCA 处理后微生物丰富度和多样性没有显著变化(图6a)。然而,PCoA 分析表明微生物组成发生了显著变化,实验组中观察到的不同聚类模式证明了这一点(图6b)。
在门水平上,与CCl4组相比,CCl 4 +DCA组表现出厚壁菌门的减少和疣微菌群的增加,而放线菌、软体菌和蓝细菌显著减少(图6c-d)。在属水平上,CCl4 +DCA组显示与炎症负相关的阿克曼氏菌和丁酸球菌丰度增加,而与宿主炎症相关的图里奇杆菌和乳杆菌显著减少(图6e-f)。同样,在物种水平上,与CCl4组相比,CCl4+DCA组显示出嗜Akkermansia muciniphila (A.muciniphila)和Butyricicoccus pullicaecorum pullicaecorum的水平增加,Alistipes massiliensis、Clostridium celatum和 Lactobacillus vaginalis的水平降低(图6g-h)。
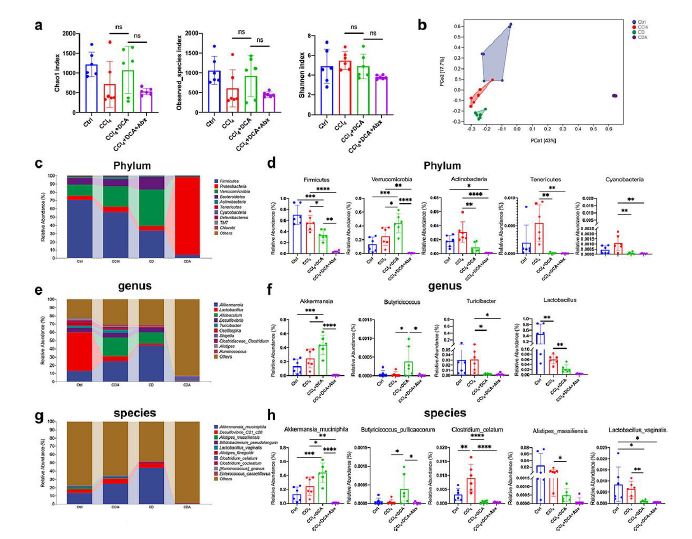
图6. DCA 调节肠道微生物群的组成。
(a) 使用 Chao1 指数、Observed_species 指数和 Shannon 指数评估每组的 α-多样性。 (b) 肠道微生物群的主坐标分析(PCoA)。(c) 门水平前10位细菌的相对丰度。(d) 门水平肠道微生物群的代表性直方图。(e) 属水平前10位细菌的相对丰度。(f) 属水平肠道微生物群的代表性直方图。(g) 物种水平前 10 位细菌的相对丰度。 (h) 物种水平肠道微生物群的代表性直方图。
随后,他们使用线性判别分析效应大小(LEfSe)进行分析,以确定实验组之间的分类富集变化。值得注意的是,在A.muciniphila中观察到显著的分类富集,表现出最高的 LDA 得分 5.324 和P值为 0.0004(图7a-b)。这些结果表明 DCA 对肠道微生物群发挥调节作用,从而减轻 CCl4诱导的慢性肝损伤。特别是,A.muciniphila细菌的大量增加在介导这种保护作用中发挥着至关重要的作用。
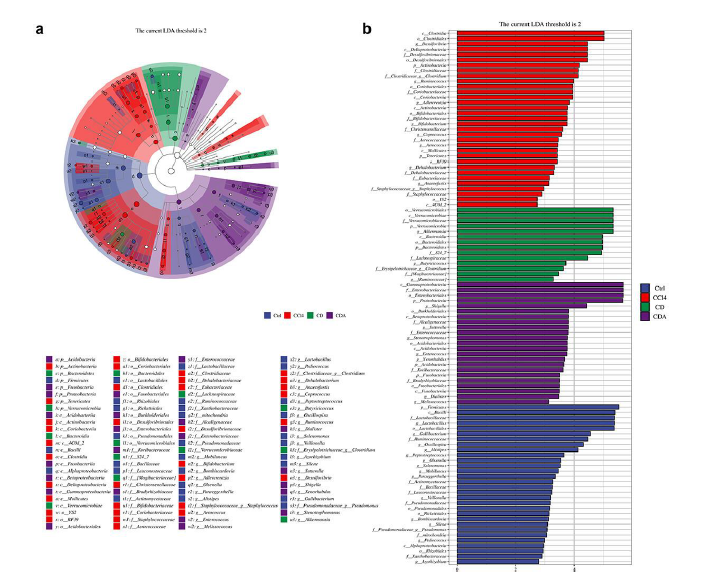
图7. DCA 调节肠道菌群组成的 LEfse 分析。
(a) 分类分支图说明了样本群落中主要类群从门到属(从内圈到外圈)的层次关系。 (b) 显著不同物种的线性判别分析 (LDA) 值的分布条形图显示了每个组内显著富集的物种及其重要性。
05
通过肠道微生物群 DCA 介导的血浆胆汁酸谱调节
主成分分析 (PCA) 和聚类分析揭示了每个实验组内明显的样本聚类,包括对照组、CCl4、CCl4 +DCA 和 CCl4 +DCA+Abx 组。重要的是,观察到的代谢物谱显示出明显的组内聚集和组间分离,这表明四个组之间主要代谢物成分存在显著差异(图8a-b)。
火山图显示,与CCl 4组相比,CCl 4 +DCA组血浆中存在214种差异代谢物,其中55种代谢物显示上调,159种代谢物显示下调。在上调的代谢物中,排名前30位的代谢物中有8个是BA,7个属于氨基酸及其衍生物。具体来说,除了鹅去氧胆酸(CDCA)外,上调的BA还包括3-表脱氧胆酸、异壬二胆酸、脱氧胆酸(DCA)、阿波胆酸(Apo CA)及其异构体、12-酮石胆酸(12-KLCA)、7-酮石胆酸 (7-KLCA)、甘氨酸脱氧胆酸 (GDCA) 和其他辅助 BA。相反,除了猪去氧胆酸(HDCA)外,初级胆汁酸如胆酸(CA)及其位置异构体γ-羟胆酸(γ-MCA)、α-羟胆酸(α-MCA)和β-羟胆酸牛磺酸(β-MCA)、牛磺酸结合beta-mercholic acid (T-β-MCA)及其位置异构体牛磺酸羟胆酸(THCA)和牛磺熊去氧胆酸(TUDCA)均显示出显著下降(图8c-f)。这些结果表明,DCA 通过与肠道微生物群的相互作用影响血浆 BA 的组成,并且肠道微生物群的变化主要影响次级 BA,而不是初级 BA。
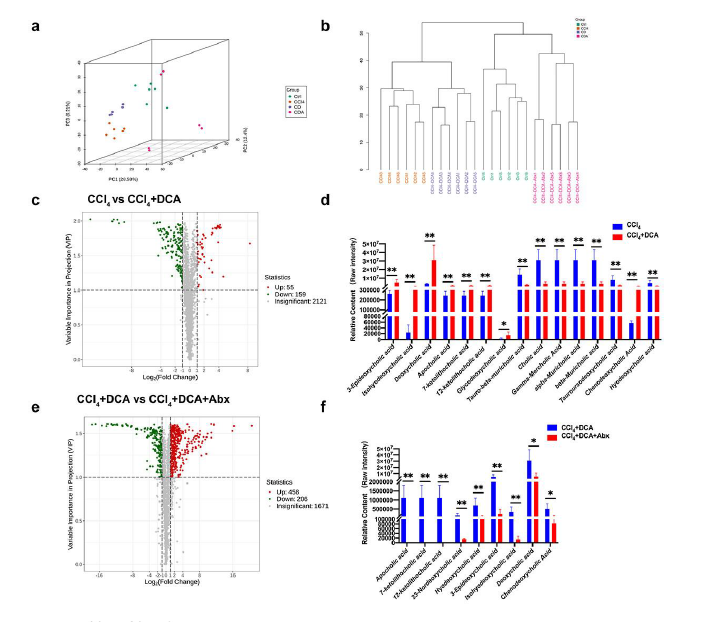
图8. DCA 通过肠道微生物群调节血浆胆汁酸谱。
(a) 进行无监督的 PCA,以评估不同组之间的差异。(b) 来自不同组的样本的层次聚类树。(c) 显示CCl4组与CCl4 +DCA组中代谢物相对含量差异的火山图。(d) CCl4 组和CCl4 +DCA组之间血浆BA水平的比较。(e)火山图,显示CCl4 +DCA和CCl4 +DCA+Abx组中代谢物的相对含量差异。(f) CCl4 +DCA组和CCl4+DCA+Abx组之间血浆BA水平的比较。
06
DCA调节炎症信号通路减轻CCl 4诱导的慢性肝损伤
为了探索 BA 谱变化、肠道微生物组成和肝损伤之间的关系,他们对小鼠肝组织进行了转录组测序。聚类分析显示CCl4 +DCA和CCl 4组之间基因表达模式存在显著差异,表明存在生物联系并表现出组内聚集和组间分离的模式(图9a)。火山图显示,与CCl4组相比,CCl4 +DCA组有192个基因显著上调,而219个基因显著下调(图9b)。
进一步的 KEGG 和基因集富集分析(GSEA) 揭示了 IL-17 和 TNF 炎症信号通路的显著下调(图9c-d)。随后,采用实时荧光定量PCR来验证与IL-17和TNF炎症通路相关的基因的表达。结果证实,CCl4 +DCA组中有10个基因(TNFAIP3、PTGS2、TNF、FOS、JUN、SOCS3、CCL2、FOSL1、LCN2、JUNB)显著下调,与转录组测序结果一致(图9e)。这些发现表明DCA可能抑制IL-17和TNF炎症信号通路的活性,从而通过减轻肝脏炎症来减轻CCl4诱导的慢性肝损伤。

图9. 肝脏转录组测序和qPCR分析。
(a) CCl4和CCl4 +DCA组基因表达的聚类热图。(b) 火山图,显示CCl4和CCl4 +DCA组中基因的相对含量和统计差异。(c) 基于KEGG数据库的基因功能预测。(d) IL-17和TNF通路的GSEA分析。(e) 实时荧光定量PCR,用于检测IL-17和TNF通路相关基因的表达。
07
多组学分析
他们进行了联合分析,以检测 CCl4和 CCl4 +DCA 组中差异肠道微生物群与差异 BA 之间的关系(图10a)。A.muciniphila与次级 BA之间存在高度正相关性,包括 3-表脱氧胆酸、阿朴胆酸 (Apo-CA) 及其异构体 12-KLCA 和 7-KLCA。此外,A.muciniphila与 IHDCA和 DC等次级 BA之间存在很强的正相关性。相反, A.muciniphila和初级 BA之间存在很强的负相关性,包括T -β-MCA 及其异构体 THCA和 TUDCA。
接下来,他们使用Spearman相关性检验对CCl4 组和CCl4 +DCA组之间的差异BA代谢物以及IL-17和TNF炎症通路中的差异表达基因进行相关性分析。结果表明,次级 BA 与 IL-17 和 TNF 炎症通路相关的差异基因之间呈负相关,而初级 BA 与这些炎症通路相关的差异基因之间呈正相关(图10b)。为了研究转录组学和代谢组学谱之间是否存在关联效应,对两个组学数据集进行了 O2PLS 分析(图10c)。结果表明,IHDCA、CDCA、DCA、3-表脱氧胆酸、GDCA、Apo CA及其异构体12-KLCA和7-KLCA与转录组数据呈正相关。相比之下,THCA、T-α-MCA、CA及其位置异构体γ-MCA、α-MCA和β-MCA、TUDCA和HDCA与转录组结果呈负相关。
随后,使用差异BA代谢物作为环境因素(变量),进行了 Mantel 检测以整合多组学数据。两个样品组的 16S OTU 和基因表达谱显示与 16 BA 代谢物显著相关(图10d)。值得注意的是:(1)DCA与基因表达有很强的相关性。(2) IHDCA与16S OTU呈显著相关。(3) GDCA与基因表达有较强的相关性。
这些发现强调了肠道微生物群、BA代谢和肝脏基因表达之间的相互关联性,表明肠道微生物群的变化在调节血浆BA代谢中发挥着作用,从而可能影响肝脏中IL-17和TNF炎症通路相关基因的表达,最终导致肝脏炎症减弱。
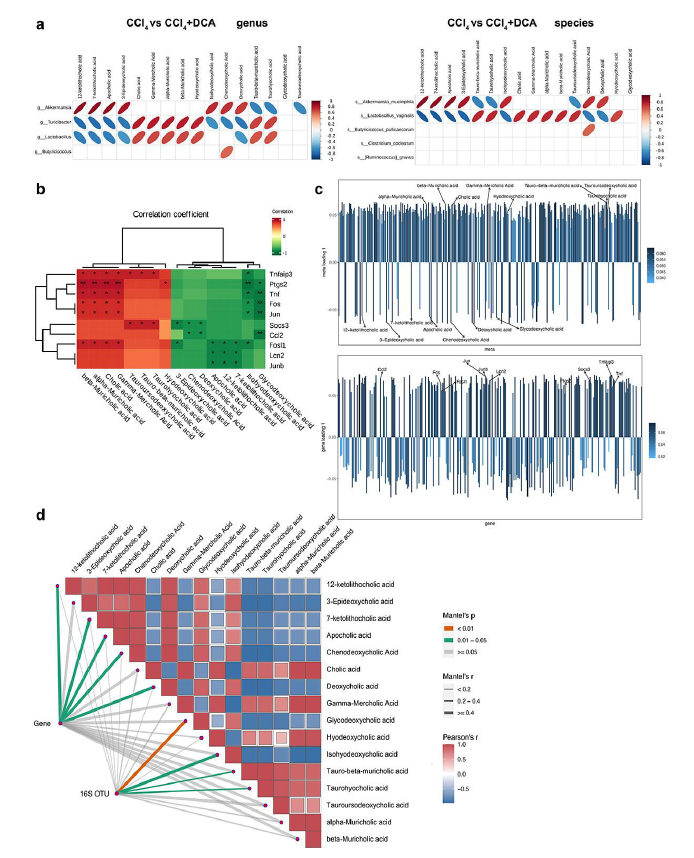
图10. 多组学分析。
(a) CCl4和 CCl4 +DCA 组之间属和种水平上差异肠道微生物群和差异 BA 代谢物的相关热图。(b) 差异BA代谢物与IL-17和TNF炎症信号通路差异基因的相关性分析。(c) 代谢组和转录组的 O2PLS 分析结果。(d) CCl4和 CCl4 +DCA组之间差异表达的肠道微生物群和BAs代谢物以及参与IL-17和TNF炎症通路的差异表达基因的相关性分析。
+ + + + + + + + + + +
结 论
本项研究发现,补充DCA会引起肠道微生物群组成的显著变化,这对于其对抗CCl4诱导的慢性肝损伤的拮抗作用至关重要。当肠道微生物群由抗生素耗尽时,观察到的 DCA 对慢性肝损伤的保护作用明显减弱。从机制上讲, DCA通过促进A.muciniphila的生长来调节BA的代谢,包括3-epi DCA、Apo-CA及其异构体12-KLCA和7-KLCA、IHDCA和DCA在肠道微生物群中。这可能导致IL-17和TNF炎症信号通路受到抑制,从而有效对抗CCl4诱导的慢性肝损伤。这项研究表明,DCA 介导的肠道微生物群中A. muciniphila的富集增强了次级胆汁酸的产生,从而减轻了 CCl4引起的慢性肝损伤。其潜在机制可能涉及抑制肝脏IL-17和TNF信号通路。本项研究提出了一种通过调节肠道微生物群和胆汁酸代谢来减轻慢性肝损伤的有前途的方法。
+ + + + +



 English
English


