文献解读|Cell(64.5):衰老小鼠大脑图谱揭示白质是脆弱的病灶
✦ +
+
论文ID
原名:Atlas of the aging mouse brain reveals white matter as vulnerable foci
译名:衰老小鼠大脑图谱揭示白质是脆弱的病灶
期刊:Cell
影响因子:64.5
发表时间:2023.09.14
DOI号:10.1016/j.cell.2023.07.027
背 景
衰老是认知功能障碍和多种神经退行性疾病[包括阿尔茨海默病 (AD) 和帕金森病 (PD)]的主要危险因素。然而,鉴于病理特征、发病时间以及受影响区域的差异,衰老如何导致这些不同的大脑疾病的发展仍不清楚。
实验设计
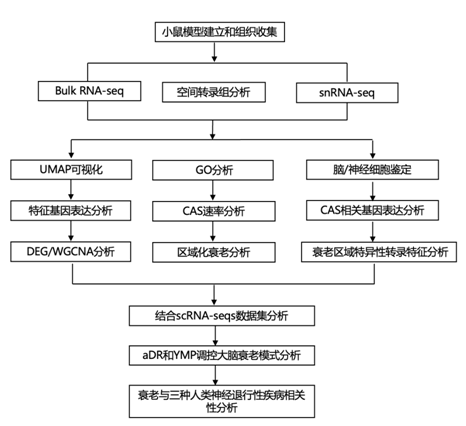
结 果
01
小鼠大脑中年龄相关基因表达的时空定量
为了寻求对哺乳动物大脑时空变化的分子理解,研究者团队从 59 只小鼠的冠状脑切片的每个半球中提取了 15 个区域(图 1 A)。三个皮质区[运动区(mot.cor)、视觉区(Vis.cor)和内嗅皮质(Ent.cor)]。海马体前部(背侧)(Hipp.ant)和后部(腹侧)(Hipp.post)、下丘脑(Hypoth.)、丘脑、尾壳核(部分)、纹状体(Caud.put.)、脑桥、脑髓、小脑(Cereb.)和嗅球(Olf.bulb)。他们进一步分离了三个富含胼胝体(Corp.cal.)、脉络膜丛(chorl .plx.)和神经源性室下区(SVZ)的区域,并对右半球区域进行bulk 转录组分析(bulk RNA-seq)(图1B),获得了 847 个单区域转录组,均匀流形近似和投影 (UMAP) 空间中的可视化按区域分隔样本(图1C)。样本在各个区域内按年龄进行转录分离,这凸显了精确分离脑组织以解决衰老对表达的微妙影响的必要性(图1D)。
RNA-seq允许对衰老速率进行定量比较。基于基因表达的变化,他们发现C4b表达的幅度和时间存在明显的区域依赖性(图1E),C4b是一种补体成分,也是精神分裂症的主要危险因素,在老年小鼠和神经变性模型中上调。
他们在3月龄组和随后的每个年龄组之间进行配对差异表达,以确定差异表达基因(deg)何时出现,将性别视为协变量,因为性别和年龄之间缺乏显著的相互作用,并且每个性别在衰老过程中都有类似的表达变化(图1E-G)。各区域的总体趋势表明,随着时间的推移,DEG的增加在21个月左右趋于稳定(图1F-G),尽管各个区域的DEG积累轨迹差异很大。例如,视觉皮层deg直到小鼠晚年都在一直稳定地增加,而运动皮层在12个月时就已经表现出明显的扰动,直到21个月时才出现跳跃式的增加(图1F-G)。相比之下,内嗅皮层的转录组不受年龄的影响(图 1F-G)。
值得注意的是,基因表达变化最大和最早的区域是富含白质的尾壳核、小脑和胼胝体,后者的 DEG 数量在 12 至 18 个月期间增加了 10 倍。
为了通过独立分析验证这些结果,他们首先探索了所有基因与年龄的相关性,并将所有年龄组考虑在内(图1H)。不同区域年龄相关基因的数量不同,证实了年龄的效应大小取决于区域,胼胝体和小脑受影响最大,而内嗅皮层基本未受影响(图1H)。
作为第二次验证,他们对每个区域进行了加权基因共表达网络分析 (WGCNA),将基因聚类到模块中。在胼胝体和小脑中发现了七个或更多模块,而在内嗅皮质中没有检测到与年龄相关的模块。而在 10 个区域中发现至少一个模块随着时间的推移表达量增加,并且富含小胶质细胞和炎症相关基因(图1I-J)。与这些发现一致的是,他们在跨区域的模块中发现了一小部分常见的 DEG,包括神经炎症标记物Fcgr2b、Ctss和Cst7 ,这表明整个大脑中存在极少数共同调节的基因发生变化。总之,他们发现三个独立分析(成对检验、年龄相关性和 WGCNA)的结果一致,表明观察到的衰老对转录组的影响是区域依赖性的。
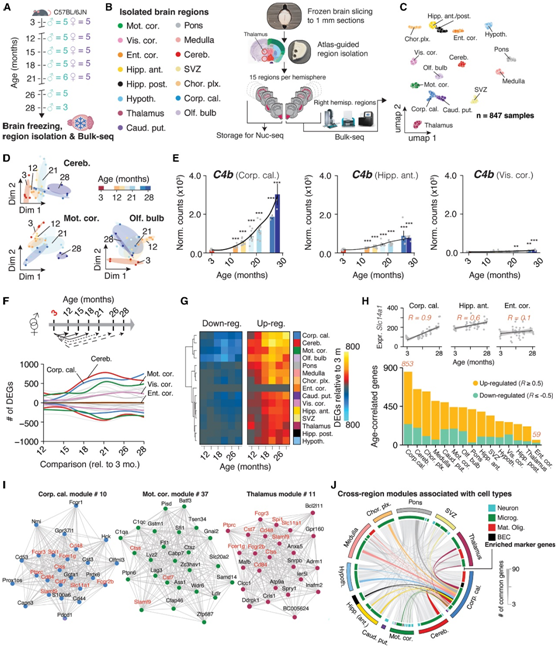
图1. 大脑区域表现出独特的衰老转录模式。
(A) 队列概述。从雄性和雌性小鼠中收集全脑。(B)分离15个脑区,并使用bulk RNA-seq。(C) 大脑区域转录组的 UMAP 可视化。(D) 来自选定区域的区域转录组的扩散图。(E)选定区域中的C4b表达。(F) 平滑线图显示用于成对比较的 DEG。(G) (F) 中数据的热图。(H) 年龄相关基因的数量,按调节着色。(I) 选定区域中连接最紧密的基因(“特征基因”)的网络。(J) 跨区域年龄相关模块共享基因的和弦图。
02
最小的基因组形成了大脑衰老的共同指纹图谱
尽管绝大多数 DEG 似乎仅在三个或更少的区域发生变化,但他们发现 82 个基因在 10 个或更多区域中受到差异调节(图2A-B),其中,具有免疫调节功能的上调基因发生强烈富集,包括主要组织相容性复合体I类(MHC-I)介导的抗原呈递、干扰素反应和补体级联,以及小胶质细胞活性的调节因子(图2C),如Cd22、Trem2和Tyrobp。而在仅有的7个下调基因中,他们发现了蛋白稳态基因Dnajb1、Hsph1和Ahsa1,以及胶原合成基因P4ha13(图2B)。他们将这82个基因组合成一个共同的RNA衰老特征,计算它们的表达作为一个单一的“共同衰老评分”(CAS)。尽管CAS在每个区域都显示出预期的显著增加(图2D),但轨迹的形状和幅度变化很大。他们采用线性模型来近似这些轨迹,使用线性拟合的斜率作为度量来比较评估跨区域的“CAS 速度”(图 2D-F),揭示了速度梯度,其中皮质区域排名最后,其速度是“最快”区域胼胝体速度的三分之一(图2G -2I)。其他白质富集的区域,包括尾壳核,也表现出较高的速度,而海马体、丘脑和下丘脑的速度低于平均水平。重要的是,他们发现 CAS 速度与年轻时区域的细胞组成之间没有关联(图 2 J),这表明 CAS 速度的异质性不太可能是由不同区域的细胞比例不同造成的。
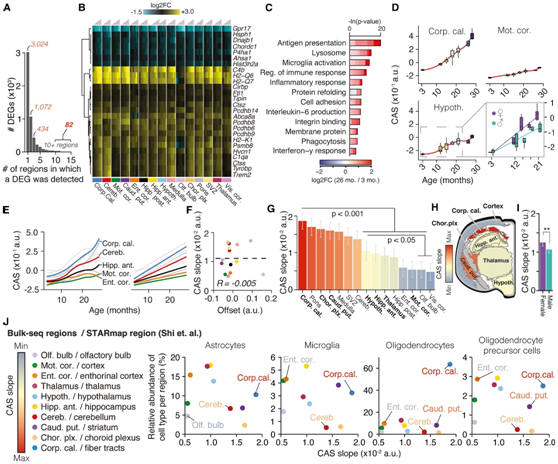
图2. 共同的基因特征识别加速衰老的区域。
(A)表示检测到DEG的区域的数量的条形图。(B) 选定基因的区域表达变化。(C)GO分析。(D) 选定区域的 CAS 轨迹。(E) 通过 LOESS 和线性回归近似的所有区域的 CAS 轨迹。(F) 线性模型的偏移和斜率比较。(G) (D) 中线性回归的斜率,按斜率着色。(H) 小鼠大脑横截面,其中区域由 CAS 线性斜率着色。(I) 所有大脑区域的线性回归斜率,按性别着色。(J) 主要神经胶质细胞类型的丰度与各区域各自的 CAS 斜率的相关性。
03
纤维束是大脑加速衰老的病灶
接下来,他们对大脑进行了空间转录组学 (10X Visium),从一组独立的 6、18 和 21 个月的雄性小鼠中分离出冠状切片(图 3 A)。使用基于聚类的方法,他们注释了 Visium 点的区域特征,并将它们鉴定为海马体、皮质、丘脑、下丘脑、纹状体、脉络丛和白质纤维束区域(图 3 B)。与皮质区相比,白质区(相当于解剖的胼胝体区域)中deg的调节更为明显,这包括82个CAS基因中的几个基因,如Trem2(图3C-D)。通过计算每个 Visium 点的 CAS 发现,沿白质束(包括胼胝体和其他纤维束子结构)的分数有明显的、空间定义的增加(图 3E-F)。然而,在皮质中,CAS 仅略有增加。由bulk-seq和空间转录组学确定的CAS速度具有良好的相关性(图3G),证实原位邻近区域之间的衰老速度存在巨大差异。
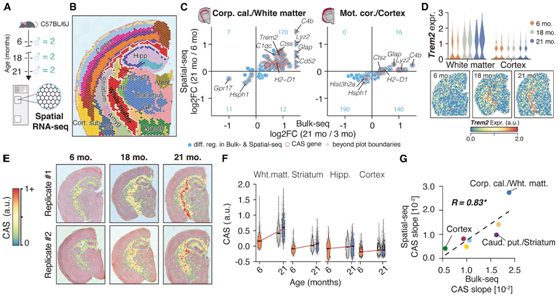
图3. 空间分辨 CAS 检测白质束加速衰老。
(A) 空间转录组分析概述。(B) 空间转录组数据,通过基于聚类的注释进行着色。(C) 选定区域中bulk-seq 和Visium 差异表达结果的比较。(D) Trem2随年龄变化的空间解析表达。(E) CAS 的空间表示。(F) 跨选定区域空间集群的 CAS。(G)bulk-seq 和 Visium 数据中线性模型的 CAS 斜率比较,按区域着色。
04
CAS 的异质速度由神经胶质转录本编码
他们的目的是在单细胞水平上量化 CAS 基因的活性,以鉴定出影响大脑区域异质表达动态的细胞类型。鉴于其中间 CAS 速度(图 2G),他们选择了前海马体,进行了单细胞核转录组分析(snRNA-seq)(图 4A),鉴定了所有主要细胞类型,细胞组成没有与年龄或性别相关的变化。小胶质细胞表现出最高的基线 CAS,这与许多已知的免疫反应基因 CAS 基因一致(图 2B-C)。尽管 CAS 在所有细胞类型中均表现出显著增加(图4B),但小胶质细胞表现出最明显的增加(图 4 C),其次是成熟少突胶质细胞、脑内皮细胞 (BEC)、星形胶质细胞和少突胶质细胞祖细胞 (OPC)。很明显,CAS可以通过细胞类型特异性或选择性基因表达转移反映小胶质细胞以外的几种细胞类型的衰老动态(图4D),包括Gfap(星形胶质细胞)、C4b(星形胶质细胞和成熟少突胶质细胞)、Gpr17 (OPC)和H2-Q7 (BEC)。值得注意的是,衰老可能会触发在年轻时未检测到的基因的表达。例如,C4b主要在年轻星形胶质细胞中检测到,在成熟的少突胶质细胞中随着年龄的增长而其表达量显著增加。同样, H2-Q7的表达仅在老年 BEC 中才可检测到。
接下来,他们分析了Tabula Muris Consortium的Smartseq2 单细胞转录组(scRNA-seq)数据(图4E),其中包含来自新鲜分离的小脑、纹状体(相当于尾壳核)、海马体和皮层的相等数量的小胶质细胞。由于其高效的每细胞转录物捕获率,Smartseq2特别适合于检测与衰老相关的微妙转录效应。与本项研究的bulkRNA-seq结果一致,各区域小胶质细胞的 CAS 增加,但小脑和纹状体的幅度更大,其次是海马体和皮质(图 4 F)。这些变化在是一致的,并且也反映在单个 CAS 基因的水平上,如Trem2(图 4 G)。
此外,他们对从小脑、纹状体、海马体和皮质中分离出的小胶质细胞的大容量微阵列数据集进行了Meta分析,其中包括 52 只4、12和 22 个月大的小鼠。在小脑和纹状体中发现了更多随着年龄增长的 DEG,以及 CAS 基因更明显的上调(图4F-G),特别是在 12-22 个月期间。
总之,在bulk-seq和Visium数据中观察到的CAS速度部分代表了表现出区域特异性衰老率的小胶质细胞。
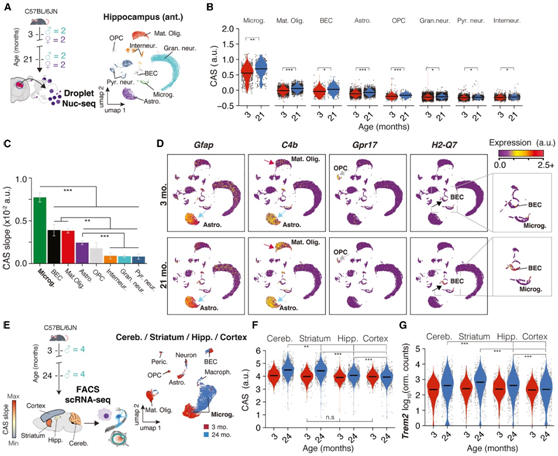
图4. 神经胶质细胞和内皮细胞的衰老是 CAS 增加的主要原因。
(A) snRNA-seq 实验概述。(B) 跨海马体细胞类型的 CAS。(C) 中线性回归的 CAS 斜率。(D) CAS 基因Gfap、C4b、Gpr17、H2-Q7的表达。(E) 来自不同大脑区域的小胶质细胞的 scRNA-seq 数据的Meta分析。(F-G)不同脑区小胶质细胞中CAS 和Trem2 的表达。
05
神经元转录本编码区域特异性表达模式
通过识别功能不同的器官中的特定特征,他们研究了各个大脑区域在衰老过程中是否表现出相似程度的特异性。区域特异性 DEG 的数量差异很大(图 5 A),他们利用它来构建每个区域的衰老特征(图 5 B-C)。以尾壳核为例,大多数区域特异性特征通常随着年龄的增长而增加,主要集中在它们所在的区域(图 5 B-D)。
特征基因似乎在功能上相互关联,例如尾壳核特异性特征,其富集于下调的线粒体相关通路和上调的细胞粘附和脂质结合相关通路(图5E)。他们分析了前海马体(图4A)和尾壳核(图5F)的snRNA-seq数据,其中捕获了非神经元细胞类型以及纹状体特异性D1和D2型中棘神经元(分别为D1和D2 msn)。将Fgf16、S100a10和Fabp4等特征基因映射到不同的细胞群(图 5G)表明,大块组织确实可以捕获特定细胞亚群的表达动态。相比之下,齿状回颗粒细胞表现出明显的海马体特异性特征增加(图5K),而轴突引导受体Unc5d和转录因子Onecut1等特征基因分别受到调控(图5L-M)。值得注意的是,颗粒神经元在小脑中非常丰富,但海马体特异性特征以及Unc5d或Onecut1的表达在小脑的大量数据中没有表现出与年龄相关的变化。因此,本项研究的方法可以识别特定区域选择性发生的细胞类型的衰老特征。
最后,他们探究了与特征基因相关的生物通路是否可以表明整个通路或细胞器的转录活性差异。观察到尾壳核中线粒体相关基因的显著下调,包括电子传递链亚基,这可能表明线粒体功能受损(图 5 E)。在该区域发现了编码线粒体相关蛋白的所有基因的整体逐渐下调,并且在衰老的 D2 MSN、成熟少突胶质细胞和星形胶质细胞中,相应的线粒体特征显著下降。
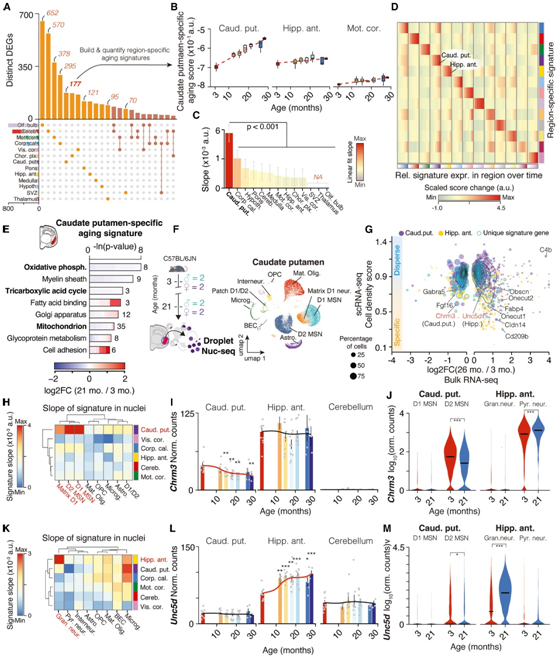
图5. 神经元转录本编码区域特异性表达变化。
(A) 显示 DEG 区域特异性的 UpSet 图。(B) 选定区域中尾壳核特异性衰老评分的轨迹。(C) 中线性回归的斜率,按斜率着色。(D) 相对于 3 个月的特定区域特征的分数变化。(E) GO分析。(F) 用于bulk RNA-seq 的相同小鼠的左半球区域的 snRNA-seq 实验概述。(G) 不同区域的单核分散分数与 log2转换的表达比率。(H) 尾壳核特异性特征的细胞类型斜率随年龄变化。(I-J) Chrm3的体积和细胞类型以及表达变化。(K) 海马体特异性特征的细胞类型斜率随年龄变化。(L-M) Unc5d的体积和细胞类型以及表达变化。
06
在正常衰老过程中,恢复活力的干预措施作用于不同的区域和细胞类型
鉴于正常衰老过程中区域特异性表达的显著变化,他们想知道已知的可避免与年龄相关的病理的干预措施是否也可以在区域内发挥作用。于是。他们对19个月大的小鼠的大脑进行了区域分辨率的测序,这些小鼠分别接受了4周的急性饮食限制(aDR)、营养干预(图6A注射年轻小鼠血浆(YMP)(图6E)。
19 个月大的雌性小鼠接受 4 周的 aDR 或随意(AL) 喂养(图6A)。值得注意的是,aDR 和 YMP 在整个大脑中产生了明显的表达变化(图6B-6D,图6F-6H)。aDR 的主要特征是嗅球、小脑和皮质区域的差异调节,以及所有区域的较少表达变化(图 6A-C)。aDR 下的 DEG 与衰老过程中发生的 DEG 几乎没有重叠,并且 CAS 在整个大脑中保持不受影响(图6D)。在几个区域,特别是小脑, aDR 诱导的与生物钟调节相关的基因有很强的功能富集。一组23个基因,包括生物钟的三个直接成员(Cry1、Usp2和Ciart)和其他循环表达基因,它们在至少四个区域受到差异调控(图6C-J)。为了找出驱动aDR信号的细胞类型,他们对24月龄雌性小鼠的整个冷冻海马体组织进行了snRNA-seq,这些小鼠从20月龄开始喂食AL或接受40% aDR处理(图6K)。在成熟少突胶质细胞、星形胶质细胞、小胶质细胞和 OPC 中,该特征在 aDR 下特异性上调,但在任何神经元亚群中均不受影响(图6 L)。
相比之下,YMP 引起区域选择性表达变化,尤其影响 SVZ(图 6 E-H)。与干细胞分化和神经元成熟相关的通路发生显著上调(图6M)。他们将一个代表YMP下所有上调基因的特征映射到SVZ的公开单细胞数据中,划分了主要在年轻小鼠中发现的神经母细胞、静息细胞和ansc(图6N-O)。老年小鼠的SVZ细胞降低了YMP特征,相反,在YMP处理的小鼠中,在aNSC中发现的与年龄相关的deg发生下调(图6P-Q)。因此,YMP 注射重新激活了神经源性谱系中的表达模式,该表达模式随着年龄的增长而下调。
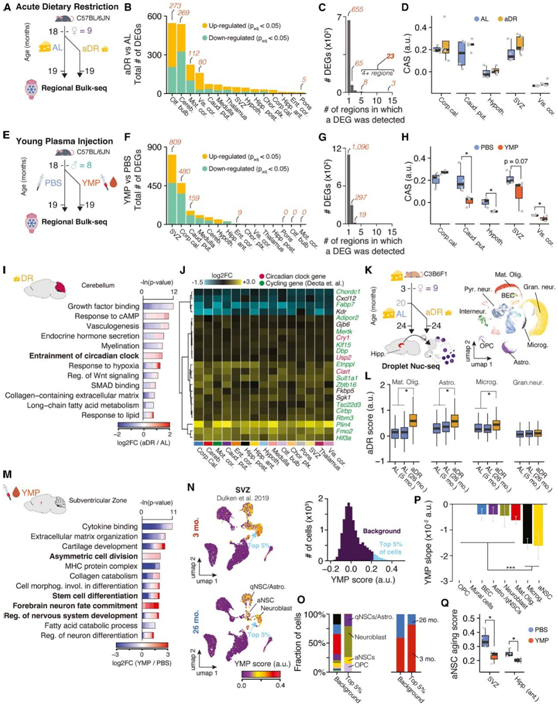
图6. 年轻血浆注射和急性饮食限制引发老年大脑中明显的空间基因表达变化。
(A) 实验概述。(B) DEG 的数量。(C) 条形图显示检测到特定 DEG 的区域。(D) CAS 因选定区域的 aDR 而发生变化。(E) 实验概述。老年雄性小鼠在 4 周内注射年轻小鼠血浆 (YMP) 或 PBS。(F–H) 类似于(B)–(D) 的YMP 实验。(I) 由于 aDR 导致小脑发生变化的 DEG 的代表性 GO 分析。(J) 24 个基因的 aDR 的区域表达变化。(K) 实验概述。对 20 个月时进行 AL 至 aDR 饮食转换的雌性 C3B6F1 小鼠的整个海马体进行 snRNA-seq。(L) 四种细胞类型中常见 aDR 分数的箱线图表示。(M) 与 (I) 类似,但针对 SVZ 中 YMP 诱导的 DEG。(N) 单细胞 SVZ 数据的 UMAP 可视化,以及 YMP 特征的分数。(O) 显示最高 YMP 分数的细胞类型和年龄组的组成。(P) YMP 线性回归对年龄的评分斜率,按细胞类型着色。(Q)注射 YMP 或 PBS 的小鼠 SVZ 和海马体中aNSC衰老评分的箱线图。
07
衰老导致与人类疾病相关的基因的区域特异性表达变化
他们分析了与常染色体显性疾病相关的基因或与散发性疾病风险相关的基因的表达,根据 3 个月时Apoe、Trem2、Plcg2或Scna(α-突触核蛋白)的高度可变表达对区域进行排名(图 7A-D)。由于区域特异性差异调节,每个基因在老年动物大脑中的表达分布都发生了显著的重新排列。为了系统地评估疾病风险相关基因的调控,他们收集了 AD 或 PD 的全基因组关联研究 (GWAS) 基因列表,并研究了它们是否在给定区域的年龄相关 DEG 中显著富集。每个疾病相关基因集表现出不同的富集模式(图7E -G)和不同数量的相关基因(图 7H-I)。ad相关基因,包括Apoe、Ms4a6d和Plcg2,是在脉络丛、胼胝体和脑桥这三个区域共同调控的deg的一部分(图7E)。相反,PD 相关基因,如神经保护基因Ip6k2 分布在几个重叠有限的区域(图 7F)。
由于在富含白质的区域观察到年龄相关的影响,他们还分析了多发性硬化症(MS) 的 GWAS 基因。这些基因与来自九个不同区域的 DEG 具有显著关联,将这些区域分为两个聚类,表明两个不同的子集。其中一个聚类由包括胼胝体和小脑在内的区域组成,这些区域上调了一组共享的炎症相关基因,例如Stat3、Ly86和Irf8,它们都是 CAS 的一部分(图 7G),这表明了与多发性硬化症相关的炎症和脱髓鞘的病理生理过程与在富含白质的区域观察到的加速衰老之间的相似性。视觉和运动皮层形成了第二个聚类,显示出上调和下调的MS基因。这证明了皮层区域的转录转移(例如Cbln)可能发生在远离实际病变的区域,并强调了广泛研究基因表达的区域模式以了解ms相关基因的作用的必要性。
他们进一步比较了 GWAS 同源物的上调与其跨区域的基线表达(图7H-J),这证实了特定区域中与年龄相关的差异表达导致特定 GWAS 同源物在大脑中主要表达的位置发生显著的重新分布(图7H-J)。
这些结果表明,与三种主要神经退行性疾病相关的遗传风险因素以区域选择性方式受到年龄的影响。
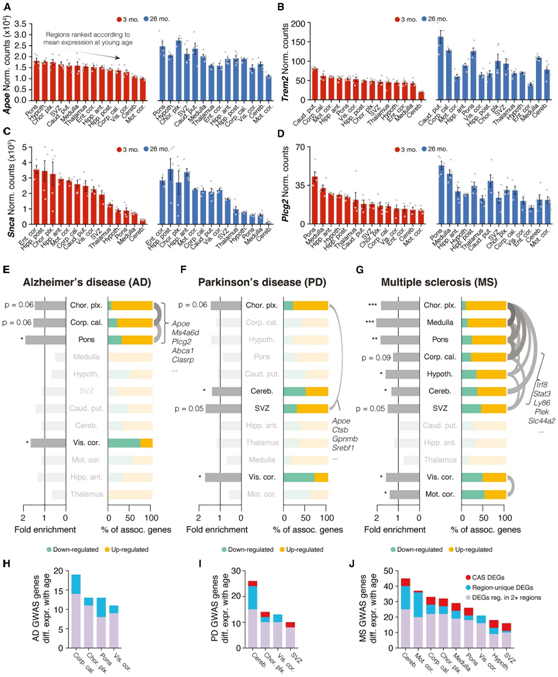
图7. 区域和年龄的相互作用决定了疾病变异同源物的表达。
(A–D) 3 个月和 26 个月龄时Apoe、Trem2、Scna(α-突触核蛋白)和Plcg2的大量表达。(E-G) 对 AD、PD 和 MS 人类 GWAS 变异的区域解析 DEG 进行富集分析。(H–J) 每个区域与 AD、PD 和 MS 的人类 GWAS 变体同源的 DEG 数量。
+ + + + + + + + + + +
结 论
本项研究对小鼠大脑进行了时空转录组分析,发现了神经胶质细胞衰老的全脑基因特征。通过整合空间和单细胞核转录组学,他们发现与皮质区域相比,白质中的胶质细胞存在衰老加速现象,而特殊的神经元群体则表现出区域特异性的表达变化。年轻小鼠的血浆注射和饮食限制等干预措施对特定大脑区域的基因表达表现出明显的影响。此外,本项研究发现了与三种人类神经退行性疾病相关的差异基因表达模式,强调了区域衰老作为疾病潜在调节靶点的重要性。本项的研究结果确定了大脑衰老的分子病灶,为解决与年龄相关的认知能力下降提供了新的理论依据。
+ + + + +



 English
English


