文献解读|Nat Metab(20.8):人类脂肪形成的时空蛋白质组图
✦ +
+
论文ID
原名:A spatiotemporal proteomic map of human adipogenesis
译名:人类脂肪形成的时空蛋白质组图
期刊:Nature Metabolism
影响因子:20.8
发表时间:2024.04.02
DOI号:10.1038/s42255-024-01025-8
背 景
白色脂肪细胞通过储存大量甘油三酯作为人体主要的能量储存库,其功能障碍与代谢紊乱有关;然而,脂肪生成过程中细胞特化的机制仍然未知。
实验设计

结 果
01
人类脂肪形成的时间解析核心蛋白质组
为了定义人类脂肪生成过程中的核心蛋白质组轨迹,研究者团队对不同人类脂肪细胞模型的分化时间过程进行了液相色谱-质谱(LC-MS)蛋白质组学分析(图1a)。所有模型均源自从白色脂肪组织(WAT)的基质血管部分 (SVF) 中分离的人脂肪细胞前体细胞 (hAPC),并且在用促脂肪混合物处理后具有分化为脂肪细胞的能力。其中两种细胞类型是非永生化的[Simpson-Golabi-Behmel综合征(SGBS)和hAPC],而另外两种细胞类型是永生化的(TERT-hAPC和hWA)。为了进行比较,他们还纳入了来自 7 名捐赠者的皮下腹部成熟脂肪细胞 (pAC)、SVF(包含未成熟脂肪细胞前体)和完整 WAT 的原始样本,这些作为体内脂肪生成的参考。
他们评估了所有四种模型的成脂能力。通过采用BODIPY染色和荧光显微镜检测脂质积累以及已建立的脂肪生成标记基因的mRNA水平,发现所有模型都表现出较高的分化效率(图S1a-b)。接下来他们对整个脂肪形成过程中的细胞进行蛋白质组分析。诱导分化后,一些蛋白质在最初 24 小时内水平发生变化。这组早期调控蛋白与之前研究中发现的早期脂肪生成标记物强烈重叠[例如高迁移率组蛋白 B2 (HMGB2)、11β-羟基类固醇脱氢酶 1 (HSD11B1)、FKBP 脯氨酰异构酶 5 (FKBP5) 的上调和下调信号蛋白 7A (Sema7A)]。然后可以在诱导分化后 24-48 小时开始观察到蛋白质组的大规模重塑(图S1c-d)。
Spectronaut分析在4个细胞模型中定量了5979-7061个蛋白质,在初级样本(pAC/SVF/WAT)中定量了3638 ~ 6403个蛋白质,在完整数据集中定量了8268个蛋白质,其中86%的蛋白质是基于独特的肽段(图S1e-f)。LC-MS信号的丰度范围为5个数量级(图1b)。对于大多数定量肽(98%),每个峰的数据点在3到8个范围内(图S1g)。在蛋白质水平上,72%的变异系数(CoV)低于20%,42%的变异系数(CoV)低于10%,所有样本的CoV中位数为12.3%(图S1h)。重复间的平均Pearson相关系数为0.97,进一步证实了LC-MS分析的高重复性(图S1i)。
比较样本时,系统之间相同时间点的Pearson相关系数很高(图S1j),表明脂肪生成存在共同的蛋白质组学特征,可以在多个体外模型中重现。主成分分析 (PCA) 证实,蛋白质组数据概括了成分 1 和成分 2 中沿体外(四种细胞模型)和体内(SVF 与 pAC)分化轨迹的细胞转变,其中细胞系的脂肪形成过程投射向成熟脂肪细胞(图1c)。LD 和脂质生物合成蛋白水平的增加是驱动成分 1 轨迹的关键因素(图1d)。此外,通过显微镜观察和脂肪细胞标志物的mRNA/蛋白水平,PCA证实了hWA细胞比其他模型达到了更低的成熟状态(图S1b, k)。在四个模型中的至少三个中水平显著改变的 3939 种蛋白质中(图1e-f),其中大约一半在脂肪形成过程中表现出保守的时间轨迹,他们将其定义为细胞模型之间所有成对比较的时间分布。对保守的时间分布进行了层次聚类分析,并确定了代表脂肪生成过程中早期、中期和晚期反应的不同聚类(图1g-h)。早期阶段的特点是参与细胞周期进程和蛋白质生物合成的蛋白质下调,以及糖胺聚糖降解和溶酶体途径的上调。中间阶段的定义是参与脂肪酸代谢和线粒体相关功能的酶显著增加,例如三羧酸(TCA)循环、呼吸链和三磷酸腺苷(ATP)合成。
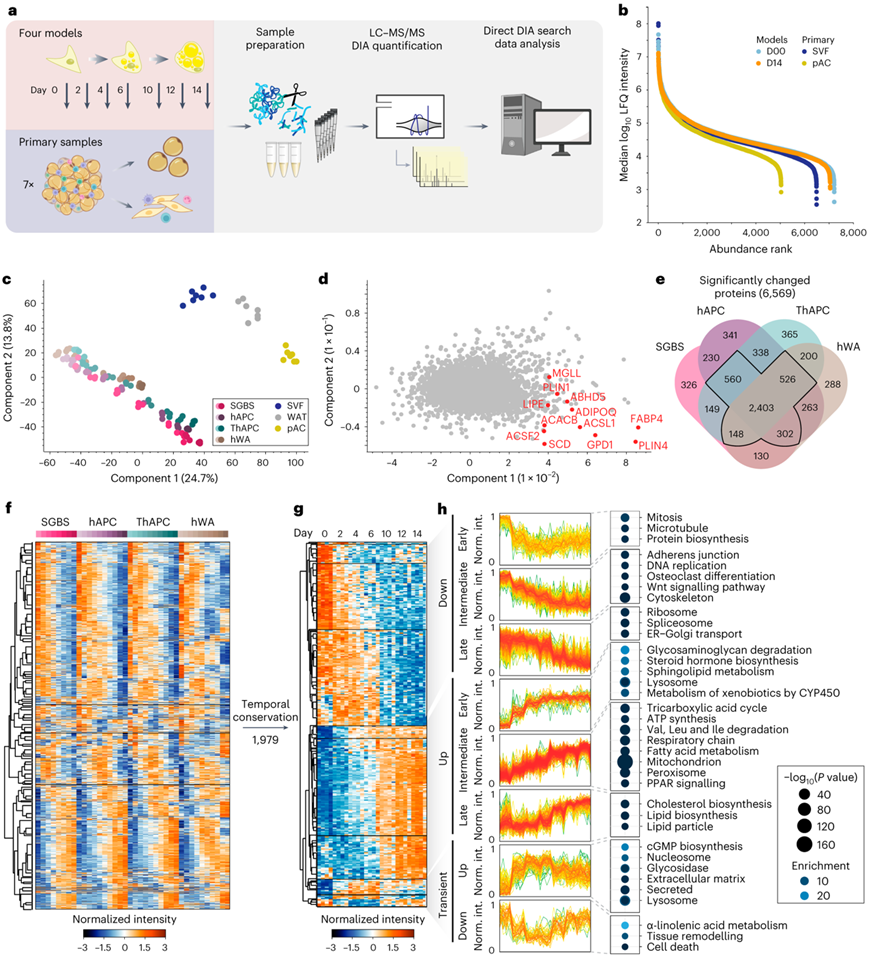
图1. 绘制人类脂肪生成的时间解析核心蛋白质组图。
(a) 基于 LC-MS 的蛋白质组学工作流程,用于绘制人类脂肪生成的核心蛋白质组。(b) 细胞模型和原代细胞蛋白质组的动态范围。(c) 初级样品的PCA和细胞系的分化阶段(从浅到深描绘)。(d) 参与脂质代谢的主要驱动蛋白的 PCA 负载量以红色显示。(e) 每个模型的分化过程中蛋白质的重叠显著变化。 (f) 在四个模型中的至少三个中,对 3934 个显著改变的蛋白质进行z评分时间分布的监督层次聚类。(g) 所有细胞模型的z评分时间特征的监督层次聚类。(h) 各个聚类的概况和富集注释。
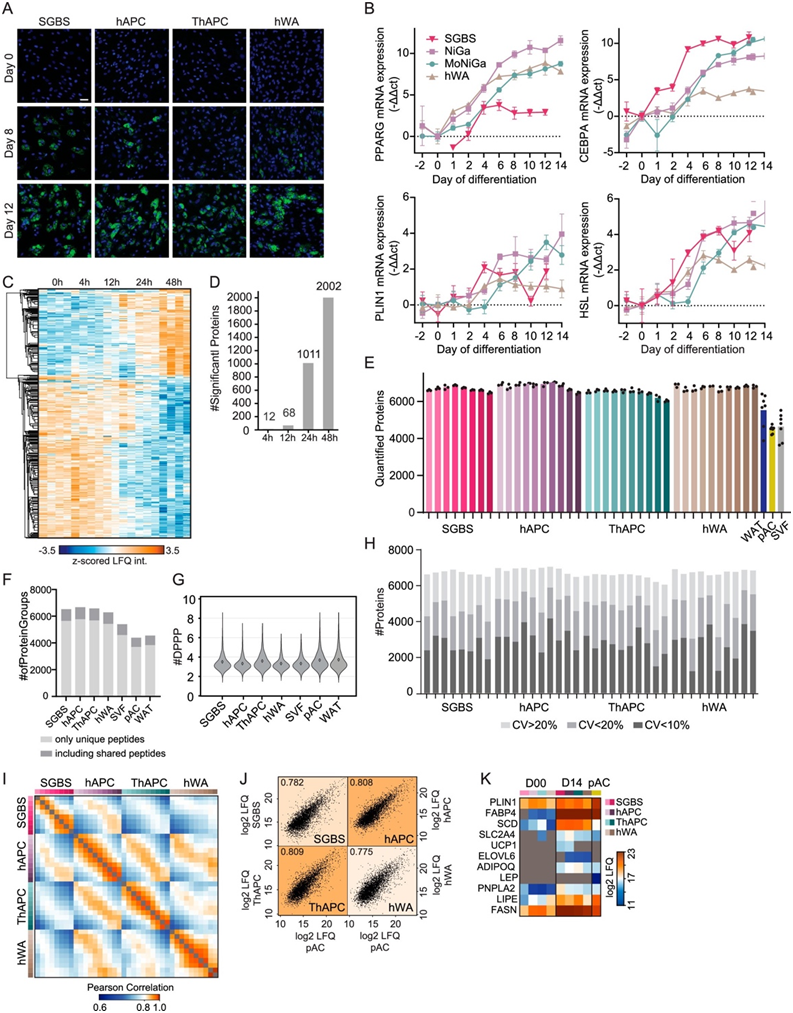
图S1. 人类脂肪生成模型的表征以及与原代细胞蛋白质组的比较。
(a) 脂肪形成早期(第 0 天)、中期(第 8 天)和晚期(第 12-14 天)细胞模型的荧光显微镜。(b) 在指定时间点对脂肪形成标记基因进行 qPCR。(c) SGBS 细胞分化初始阶段显著改变的蛋白质的层次聚类。(d) 分化前 48 小时内显著改变的蛋白质数量。(e) 细胞模型和初级样品分化过程中定量蛋白质组的数量。(f)仅基于独特肽识别的蛋白质的数量。(g) 不同细胞模型中每个已识别肽的峰值数据点的小提琴图。(h) 每个细胞模型中每个时间点具有指定 CV 值的蛋白质数量。(i) 样本之间的Pearson相关性。(j) 每个分化模型和原代脂肪细胞之间的中值蛋白质强度的Pearson相关性。(k) 细胞模型中脂肪生成标记物的 Log2 LFQ 强度。
02
细胞模型之间的异同
蛋白质组学标尺通过组蛋白的强度(假设与样本中的DNA量和细胞数量成比例)检测每个细胞的蛋白质拷贝数,从而为LC-MS读数提供绝对尺度,他们使用蛋白质组学标尺进一步挖掘了本研究的数据(图S3a-c)。对排序拷贝数的时间分布进行有监督的层次聚类和随后的功能注释富集分析,表明脂肪形成过程中细胞过程的全面重塑,具有独立于归一化方法的特定功能通路的独特时间调节。
细胞模型和临床样品的主成分分析结果表明,组分3和4有效地分离了单个细胞模型(图S3d-e)。为了更全面地了解细胞模型之间的差异,他们在未分化和完全分化状态下进行了统计分析。对差异蛋白进行无监督聚类分析,发现在前脂肪细胞和脂肪形成末期的细胞模型中有独特的表达模式。在未分化状态下,SGBS细胞表现出最独特的特征,其特征是核糖体升高和蛋白酶体蛋白水平降低(图S3f)。在不同的分化模型中,hWA细胞表现出最独特的特征,主要与它们的不成熟状态有关。与细胞周期和细胞骨架蛋白相关的蛋白聚类表达上调,与线粒体和LD蛋白相关的蛋白聚类表达下调(图S3g)。
在hWA中上调的聚类9表现出高水平的单胺氧化酶A和B(MAOA和MAOB),它们调节去甲肾上腺素的降解,从而控制脂肪分解,以及醇脱氢酶1B (ADH1B)(图3g)。这些蛋白是PCA中成分3的主要驱动因素,有效地将hWA与其他细胞模型区分开来(图3h-i)。两种细胞模型之间的另一个明显差异是TERT-hAPC和hWA经历了永生化过程,表现出与病毒防御机制相关的蛋白表达上调(图S3f-g)。除了在接受PPARγ激动剂罗格列酮较长时间治疗的细胞模型中,过氧化物酶体增殖物激活受体γ (PPARγ)靶点水平较高外,未观察到不同治疗方案的明显效应(图S3j)。
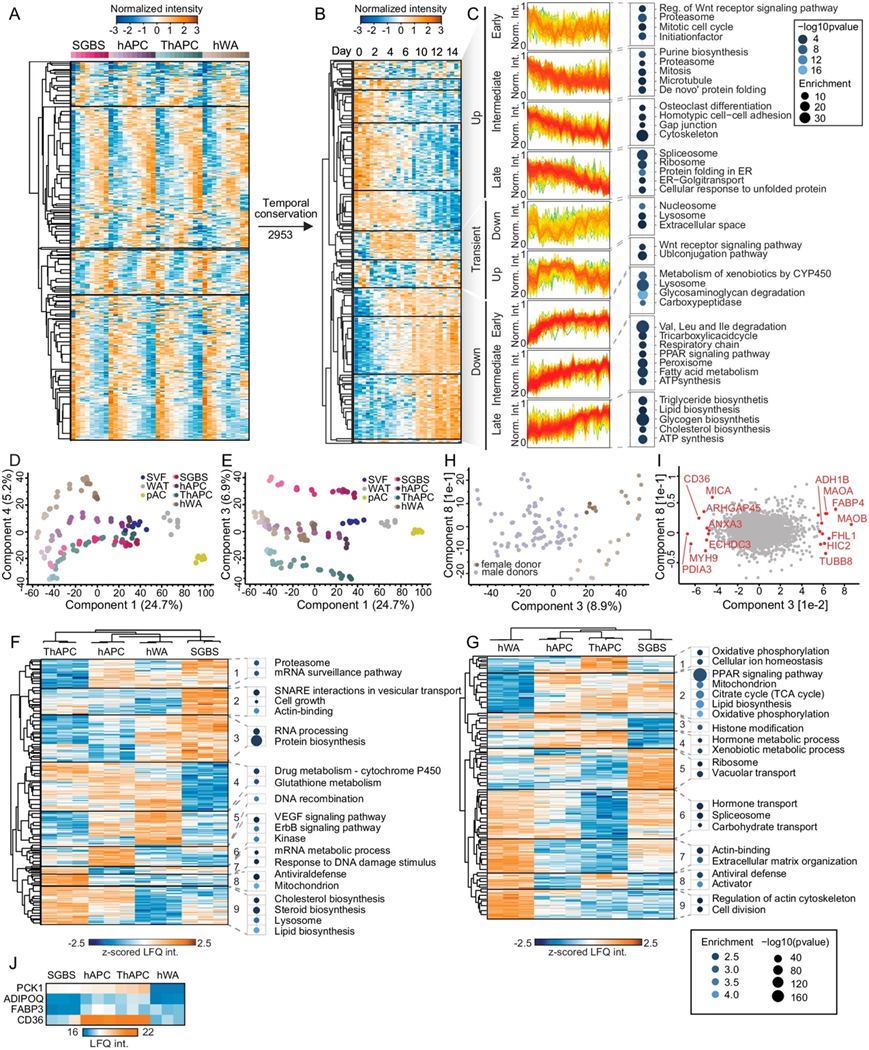
图S3. 蛋白质拷贝数的变化以及细胞模型之间的差异。
(a) 在四个模型中的至少三个中对显著变化的蛋白质的排名拷贝数的z评分时间概况进行有监督的层次聚类。 (b) 细胞模型的 z 评分时间分布的监督层次聚类。(c) 显示了所示聚类中富集的代表性 GO 注释、KEGG 路径和Keywords。(d-e) 细胞系脂肪形成分化阶段的 PCA。(f-g) 显著不同蛋白质的 z 评分蛋白质水平的无监督层次聚类。(h) PCA显示成分3和成分7,分别是雄性和雌性供体的细胞模型。(i) PCA图显示组分3的主要驱动蛋白。(j) 第14天PPARγ靶点LFQ强度热图。
03
转录组和蛋白质组之间时间动态的偏差
他们将 hAPC 的蛋白质组与先前生成的同一细胞模型的转录组时间过程进行整合。两个数据集之间的相关性在各个时间点在0.39-0.48之间,并且在后期阶段增加(图S4a)。全面的比较表明,正如预期的那样,蛋白质组的修饰通常滞后于转录组的修饰,尽管这种延迟的程度因个体蛋白质而异(图S4b-c)。16%的时间蛋白质谱显示与相应的mRNA谱呈负相关(图S4d),如此处所示的涉及嘌呤合成的蛋白质的mRNA和蛋白质谱(图S4e)。总体而言,代谢通路分析显示蛋白质和 mRNA 丰度之间的相关性高于参与信号传导通路、染色质调控和转录调控的蛋白质。此外,蛋白质复合物和非膜结合细胞器中涉及的蛋白质显示出较低的相关性,表明蛋白质水平的调节增强(图S4f)。这些结果表明,除了基因转录之外,其他方面(例如蛋白质降解)也会导致脂肪形成过程中蛋白质丰度的变化。mRNA并不能全面揭示蛋白质水平的时间动态。
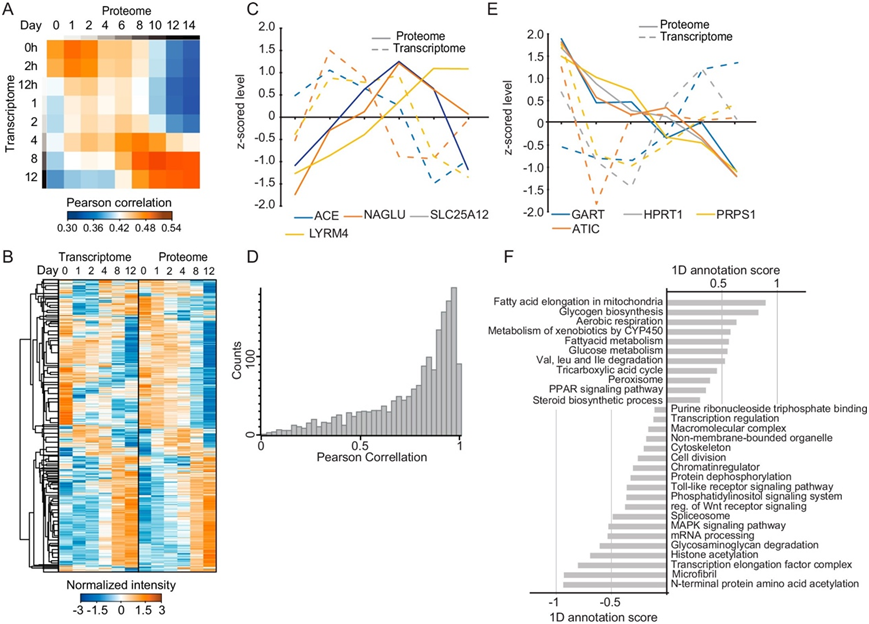
图S4. 脂肪生成过程中蛋白质组和转录组的时间变化。
(a) hAPC 中每个指定分化时间点的蛋白质和 mRNA 水平之间的 Pearson 相关系数。(b) 在蛋白质和 mRNA 水平上监督 z 评分谱的层次聚类。(c) Z 评分的蛋白质和所示蛋白质的 mRNA 谱。(d) 蛋白质的时间蛋白质和 mRNA 谱之间的 Pearson 相关值的直方图。(e) Z 评分的蛋白质和所示蛋白质的 mRNA 谱。(f) 代表性 GO通路、关键词和 KEGG 通路的 1D 注释分数在具有高和低时间 mRNA 和蛋白质相关性的通路中富集。
04
脂肪生成的空间蛋白质组图
为了识别在脂肪生成过程中显示不同位置的蛋白质,他们使用SGBS模型将蛋白质相关分析(PCP)应用于分化的脂肪细胞和前脂肪细胞(图2a)。通过进行 1 小时 LC-MS DIA 单次分析,他们实现了每个级分 3500-5600 个蛋白质的定量(图S5a),从而获得了蛋白质组覆盖率和识别率更高、LC-MS 运行时间更短且更高的细胞图谱。虽然存在一些重叠,但能够根据细胞器各自的特征来区分它们(图2b)。UMAP可视化表明大多数细胞区室具有不同的聚类,其中特征性标记蛋白根据其相似性与其他成员分组(图2c,图S5b)。
通过使用基于支持向量机(SVM)的监督学习,他们能够利用生成的丰度谱预测初级和潜在的次级蛋白质定位。细胞器聚类边界是用经过实验验证的定位蛋白来确定的。在前脂肪细胞中观察到的较低准确度源于该细胞类型中缺乏 LD,以及随后将 LD 标记蛋白分配给其他区室(图S5c)。当检查不同细胞器的预测准确性时,他们观察到线粒体和细胞质标记物达到了最高的准确性水平,而核内体和 LD 的标记物在脂肪细胞中表现出相对较低的准确性水平,为 88%(图S5c)。这很可能反映了这些区室驻留蛋白的动态性质和非排他性定位。
总之,他们对脂肪细胞和前脂肪细胞的图谱分别揭示了总共 5530 个和 5675 个蛋白质的定位。其中,脂肪细胞中的 4452 个蛋白质和前脂肪细胞中的 4912 个蛋白质由 SVM 以高置信度分配给特定的细胞器聚类(图2d-e)。发现超过一半的蛋白质与至少两个细胞器相关(图S5d-e)。
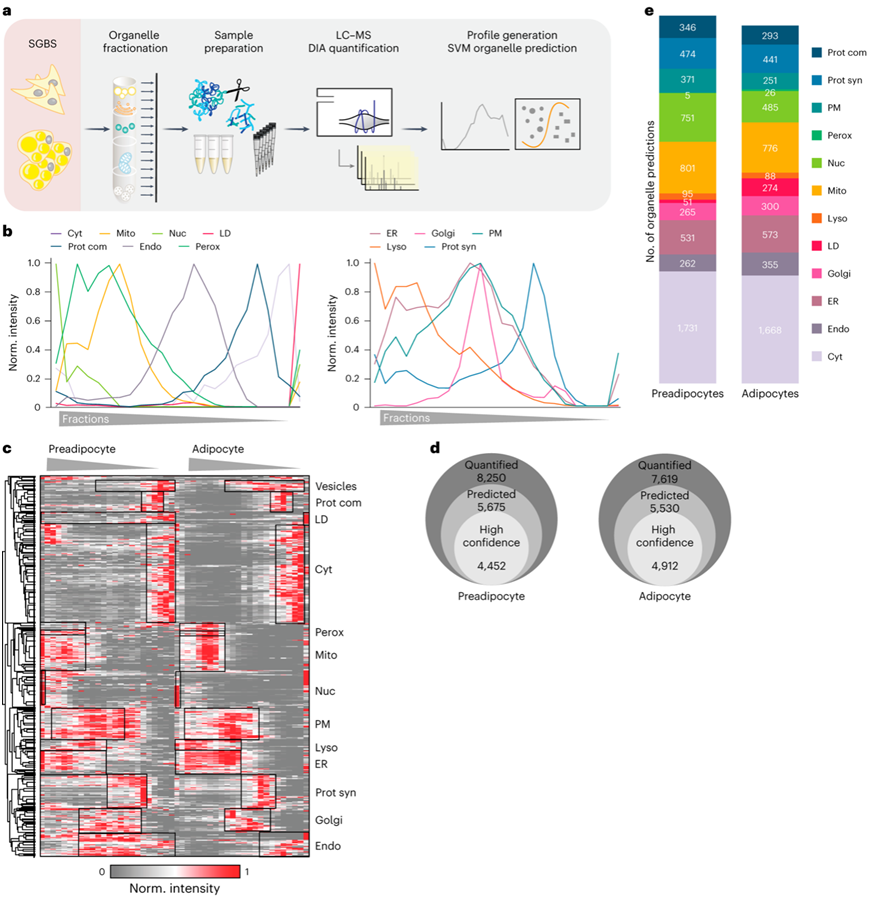
图2. 人类脂肪生成细胞图谱的生成。
(a) 通过PCP生成人类脂肪细胞细胞器图。(b) 基于分配给具有单一定位的细胞器的所有蛋白质,来自成熟脂肪细胞中指定细胞器的生物三重数据的中值分布。(c)脂肪细胞的蛋白质谱的监督层次聚类。 (d) 脂肪前细胞和脂肪细胞中定量和预测的蛋白数量。(e) 通过基于支持向量机的连接蛋白谱分析,分配给细胞器作为第一关联的蛋白质数量。
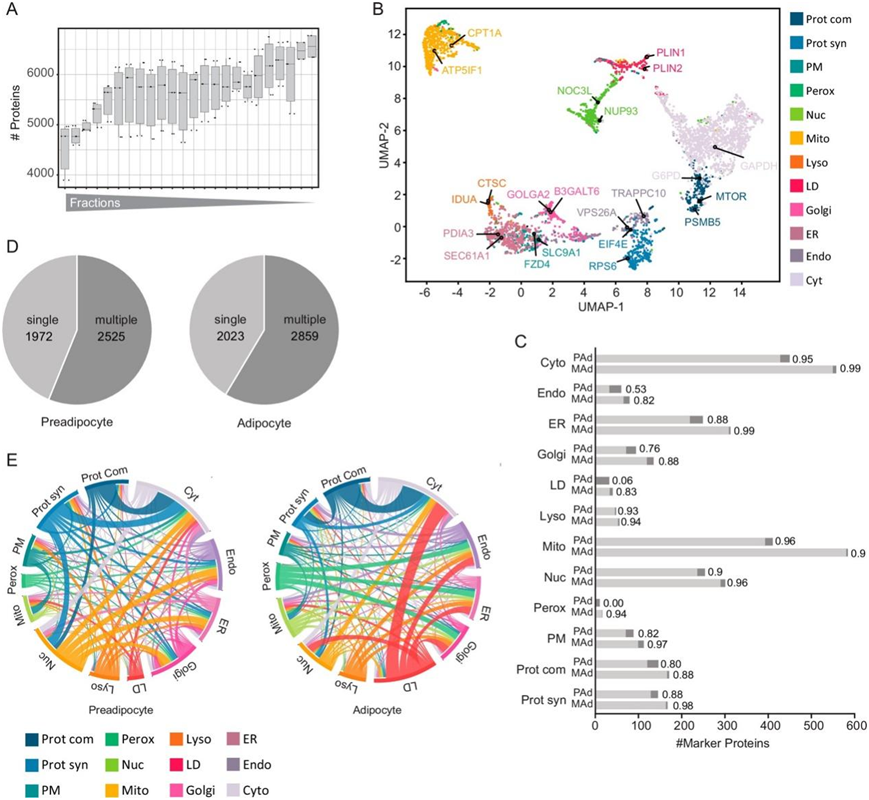
图S5. 人类前脂肪细胞和脂肪细胞的细胞图。
(a) 箱线图显示脂肪细胞和前脂肪细胞中每个细胞器部分的定量蛋白质数量。(b) 脂肪细胞 PCP 数据集的 UMAP 可视化。(c) 每个隔室的细胞器标记物的数量以及通过SVM对前脂肪细胞(pAd)和成熟脂肪细胞(mAd)预测这些标记物的准确性。(d) 前脂肪细胞和脂肪细胞中具有单蛋白和双蛋白预测的蛋白数量。(e) 前脂肪细胞和脂肪细胞细胞器预测的圆形图。
05
脂肪生成中蛋白质定位的变化
根据SVM 分析,与未分化祖细胞和分化脂肪细胞相比,1323 个蛋白质显示出不同的细胞器分配,其中 654 个蛋白质在两个数据集中都具有高置信度(图3a)。接下来,他们利用这些空间蛋白质组学数据和脂肪形成的时间分辨核心蛋白质组来表征脂肪形成过程中的细胞器重塑。通过整合两个数据集的信息,能够预测每个细胞器在总蛋白质组中的比例。在脂肪生成过程中,线粒体、ER、核内体和 LD 蛋白的比例增加,而胞质和核蛋白的比例下降。细胞器组成的这些变化反映了参与脂质代谢和分泌功能的所有区室的总蛋白质质量的总体增加,这最终导致了一种与 pAC 中比例细胞器分布非常相似的状态(图3b)。
他们观察到脂肪生成过程中翻译机制的重组。在成熟脂肪细胞中,N末端乙酰转移酶(NAT)复合物与翻译机制相关,而在前脂肪细胞中,同一复合物的亚基在所有部分中表现出弥散分布(图3c-d)。事实上,NAT 可以与核糖体结合,以共翻译方式进行 N 末端乙酰化,以调节蛋白质降解速率和相互作用。他们绘制了许多线粒体蛋白质的易位图,包括参与嘧啶生物合成的脱氧胸苷酸激酶(DTYMK)。在脂肪生成过程中,DTYMK 显示线粒体靶向增加,同时胞质溶胶减少(图3e)。
此外,他们观察到另一种机制导致脂肪生成过程中蛋白质定位的变化,其中涉及具有不同定位的亚型表达的调节。这种现象在 SLC25A10 中观察到,SLC25A10 是负责琥珀酸转运的线粒体二羧酸载体,主要在 WAT 中表达。在脂肪生成过程中,具有核特征的同种型 2 下调,而具有线粒体定位的同种型 1 大幅增加(图3f-h)。这种异构体转换存在于所有四种细胞模型中(图3i)。他们使用识别 hAPC 和 SGBS 细胞中两种异构体的抗体,通过 SLC25A10 的免疫荧光染色进一步证实了异构体转换驱动的定位变化(图3j)。染色显示SLC25A10定位于前脂肪细胞的细胞核和细胞质以及脂肪细胞的线粒体中。这些结果强调,大约 20% 的映射蛋白质组在脂肪形成过程中改变了其定位,表明蛋白质定位在细胞分化过程中的调节发挥着关键作用。
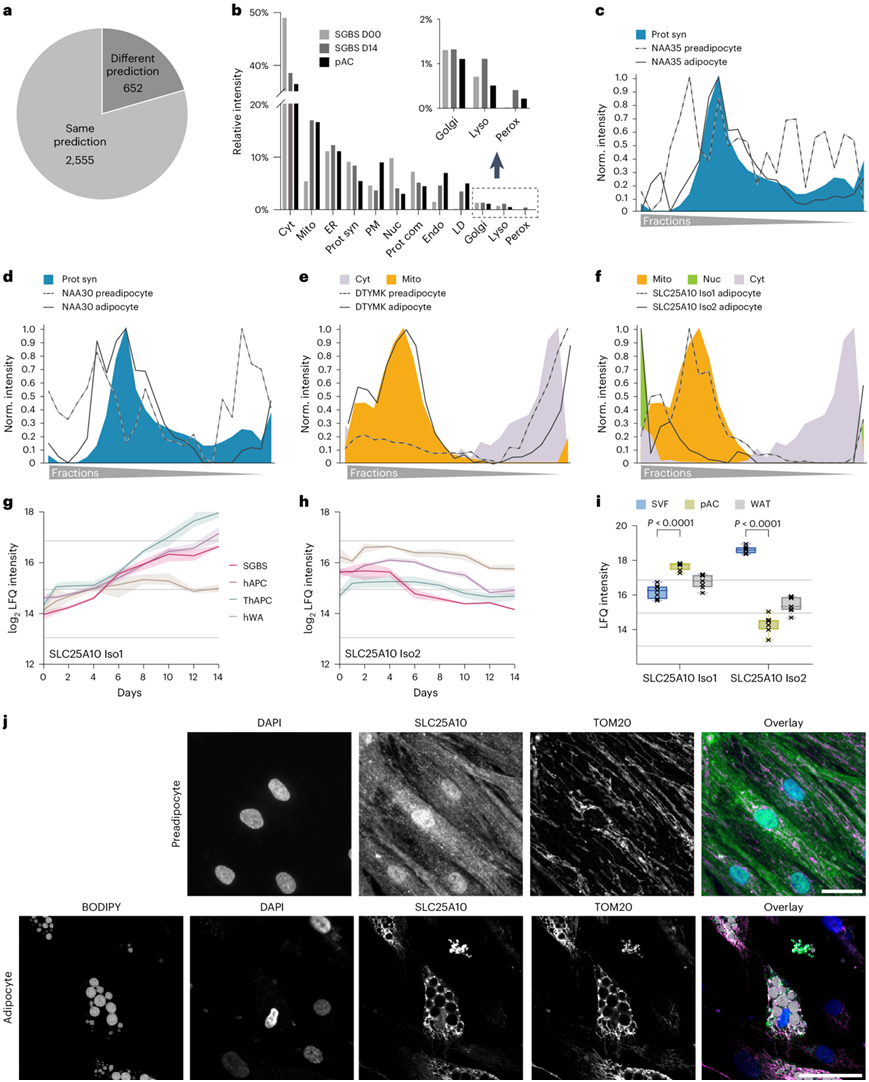
图3. 脂肪生成过程中蛋白质定位的变化。
(a) 以高置信度分配给 SGBS 前脂肪细胞和脂肪细胞中相同或不同区室的蛋白质数量。(b) 前脂肪细胞(SGBS第0天)、成熟脂肪细胞(SGBS第14天)和pAC的总蛋白质组中细胞器的百分比。(c-d) 前脂肪细胞和脂肪细胞中 NATC 复合物亚基的概况。(e) 前脂肪细胞和脂肪细胞的DTYMK图谱与各自的细胞器标记图谱重叠。(f) 脂肪细胞中检测到的两种 SLC25A10 亚型的概况。(g-h) 脂肪生成过程中来自四种细胞模型的 SLC25A10 同种型的 LFQ 强度的时间曲线。(i) SVF、PAC 和 WAT 中的 SLC25A10 同工型水平。(j)免疫荧光分析。
06
蛋白质定位和丰度变化驱动细胞重编程
为了更好地了解细胞器在脂肪生成过程中如何反应,他们对分配给特定细胞器的时间蛋白质谱进行了聚类分析,脂肪生成过程中线粒体蛋白总量的显著增加伴随着各种线粒体途径的上调(图3b),包括TCA循环、呼吸链复合物和支链氨基酸(BCAA)分解代谢(图4a)。时空数据整合揭示了BCAA分解代谢酶水平和定位的区室特异性调节(图4b)。具体来说,他们发现在脂肪前体细胞增殖阶段,BCAA降解途径中的第一批酶BCAT1和BCAT2位于细胞质中(图4b-c)。这种定位使BCAA降解产生谷氨酰胺,谷氨酰胺是从头核苷酸生物合成所需的关键成分,对细胞分裂至关重要;然而,在分化过程中,支链氨基酸转氨酶1 (BCAT1)下调。与此同时,支链氨基酸转氨酶 2 (BCAT2) 上调并易位至线粒体(图4c)。
另一个意想不到的发现是,脂肪生成过程中线粒体蛋白质质量的增加伴随着参与一碳代谢的线粒体酶水平的下降,一碳代谢是激活和转移生物合成过程的一碳单位的通路(图4a) 。与支链氨基酸降解类似,他们观察到在一碳循环中蛋白质水平和蛋白质定位之间的相互作用,以一种可能增强胞质烟酰胺腺嘌呤二核苷酸磷酸(NADPH)合成的方式进行重组,这是维持脂质合成所需的减少量(图4d)。同时,10-甲酰四氢叶酸脱氢酶的两个亚型,ALDH1L1和ALDH1L2,催化该途径的最终反应并促进NADPH释放,从它们的蛋白图谱显示,以及在SGBS细胞和hAPC中与线粒体标记物线粒体外膜转位酶20 (TOM20)的共免疫染色证实了它们的定位从线粒体到细胞溶质蛋白复合物(图4e-h)。嘌呤和蛋氨酸合成催化反应的胞质酶消耗单碳代谢中间体和胞质NADPH降低(图4d)。

图4. 空间蛋白质组学与蛋白质水平的整合,以表征细胞器代谢重编程。
(a) 对于所有预测为线粒体的蛋白质,在分化时间过程中总蛋白质组中显著变化的z得分蛋白质谱的层次聚类。(b) 支链氨基酸代谢方案及其在脂肪形成过程中的变化。(c) BCAT2 的蛋白质谱和指示的细胞器标记谱。(d) 脂肪生成过程中一碳代谢重塑的方案。(e,g) ALDH1L1 和 ALDH1L2 的蛋白质谱和指示的细胞器标记谱。(f,h) SGBS 前脂肪细胞和脂肪细胞中 ALDH1L1 和 ALDH1L2 的代表性免疫荧光染色。
07
人白色脂肪细胞脂质代谢的空间组织
注释富集分析不仅确定了几个重要复合物(包括 mTOR、蛋白酶体或伴侣蛋白复合物)在该蛋白质复合物聚类中的分配,而且还确定了脂肪酸生物合成的富集(图5a)。值得注意的是,将催化脂肪酸生物合成步骤的酶ATP-柠檬酸裂解酶(ACLY)、脂肪酸合成酶(FASN)、乙酰辅酶A羧化酶A (ACACA)和乙酰辅酶A羧化酶B (ACACB)分选在这一聚类中。它们的蛋白质谱几乎相同(图5b),表明这些酶在脂肪细胞的细胞质中可能形成凝集物或特殊排列。对脂肪细胞中映射并存在于至少两个 LD 蛋白质组数据集中的显著改变的 LD 蛋白质进行聚类分析(图5c),揭示了脂肪生成过程中 LD 蛋白质组的良好协调和时间依赖性调节,这在所有检查的模型中表现出高度一致性(图5d)。诱导脂肪生成后,观察到 seipin (BSCL2) 水平迅速激增。
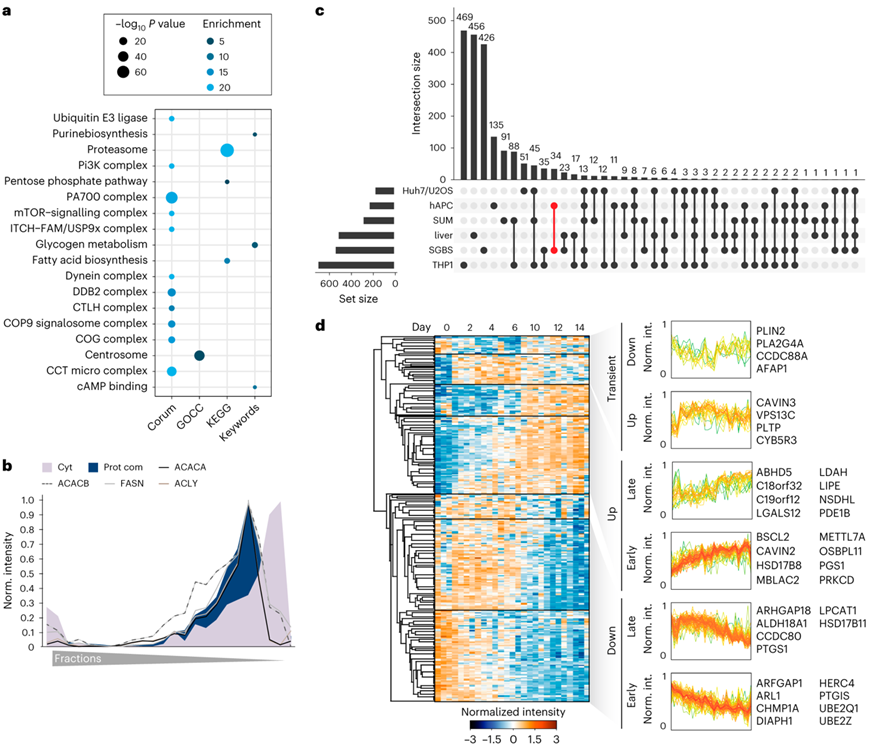
图5. 脂肪细胞脂质代谢的空间组织。
(a) 脂肪细胞PCP蛋白复合物聚类中蛋白质的KEGG,Keywords,CORUM和GO-term富集分析。(b) 参与从柠檬酸盐从头合成脂肪酸的酶的谱。(c) 显示来自SGBS和hAPC细胞的LD蛋白质组与来自不同细胞系和LDKP的肝脏的LD蛋白质组重叠。(d) 在脂肪形成过程中显著改变的LD蛋白的时间分布的监督层次聚类。
08
C19orf12 是一种调节脂质周转的脂肪细胞 LD 蛋白
为了确定脂肪细胞 LD 蛋白作为促进脂肪细胞脂质储存和动力学的特殊特性的潜在候选者,他们将 SGBS 细胞的 LD 蛋白质组与 hAPC 的 LD 蛋白质组重叠。在脂肪细胞LD蛋白质组中,他们检测到了大多数已知的LD蛋白质,其中许多蛋白质涉及甘油三酯和甾醇代谢。他们鉴定了两种白色脂肪细胞模型共有的 59 种 LD 蛋白,其中 34 种专门映射到脂肪细胞的 LD(图5c)。脂肪生成的核心蛋白质组数据与脂肪细胞特异性 LD 蛋白质组的整合揭示了 29 种 LD 蛋白在脂肪生成过程中表现出显著的调节作用。在这些候选蛋白中,C19orf12 脱颖而出,因为它在所有四种人类脂肪生成模型中都具有保守的时间轨迹(图6a),并且与细胞系和 pAC 相比,mRNA 表达和蛋白水平的大幅增加超过了细胞系和 pAC 中的所有其他候选蛋白。C19orf12 是一种与神经退行性疾病 MPAN 相关的功能未知的蛋白质。
他们旨在验证PCP通过免疫荧光在SGBS和hAPC中预测的C19orf12的亚细胞分布(图6b)。在这两种细胞类型中,他们观察到 LD 周围的 C19orf12 免疫染色(图6c)。为了深入了解 LD 上的 C19orf12 相互作用组,他们进行了免疫共沉淀 (co-IP) 与蛋白质组学相结合,以鉴定前脂肪细胞和成熟脂肪细胞中的结合蛋白。除了未表征的蛋白质 C12orf75 之外,他们还确定了 C19orf12 与参与蛋白质折叠的蛋白质和高尔基体蛋白质 GOLGA4 以及参与线粒体蛋白质输入的几种蛋白质之间的相互作用。具体来说,他们鉴定出了 TOM40(TOM 复合物的通道形成亚基)、TOM22 和 TOM5(图6d)。C19orf12 和线粒体标记 TOM20 的联合免疫染色证实了 C19orf12 与线粒体在 LD 附近的共定位(图6e-f)。
敲除C19orf12后,LD 数量更高,基础脂肪分解减少两倍(图6g-h)。同时,C19orf12耗尽的细胞比用对照短干扰RNA(siRNA)转染的细胞多分泌约50%的脂联素(图6h)。这些结果表明C19orf12在脂肪细胞分化中的作用,以及对脂质代谢的影响。
与对照细胞相比,C19orf12沉默导致胰岛素刺激的脂质合成和基础脂肪分解减少,表明脂质周转受损(图6i-j)。为了验证这是否与脂质利用的改变有关,他们使用 Seahorse 进行了生物能分析。数据显示,C19orf12 耗尽导致最大耗氧率 (OCR) 降低(图6k-m)。这可能是由于 (1) 脂肪酶对 LD 的作用减少,(2) 线粒体中的脂质利用减少或 (3) 线粒体功能普遍受损。为了区分这些可能性,他们首先评估最大脂肪分解能力。与对照细胞相比,C19orf12 耗尽的最大异丙肾上腺素诱导的脂肪分解增加,表明脂肪酶仍然可以在 LD 上发挥作用(图6n)。接下来,为了评估效果是否依赖于脂肪酸水平,他们将细胞与外源棕榈酸酯一起孵育,这并不影响 C19orf12 沉默后 OCR 的降低,表明脂肪酸丰度不是限制因素(图6k-m)。此外,他们在依托莫克西(一种 CPT1 抑制剂,可阻止脂肪酸进入线粒体)存在下进行了生物能测定(图6l-m)。他们观察到 C19orf12 敲低和对照 siRNA 细胞表现出相似的 OCR。这表明其他能量底物(例如碳水化合物和氨基酸)的利用是完整的,并且线粒体功能没有普遍受损。总而言之,这些结果以及细胞器定位和与 TOM 复合物的相互作用表明,C19orf12 通过影响线粒体代谢长链脂肪酸的能力来决定脂肪细胞脂质周转。
最后,他们分析了人类 WAT 中 C19orf12 mRNA 水平与脂肪细胞参数之间的关系。几个独立队列的转录组学特征揭示了C19orf12表达与体脂肪、脂肪细胞体积、血浆甘油三酯水平和胰岛素抵抗之间的负相关(图6o)。
这些结果表明 C19orf12 是一种脂肪细胞 LD-线粒体接触位点蛋白,在确定脂肪细胞中的脂质周转方面具有至关重要的功能。
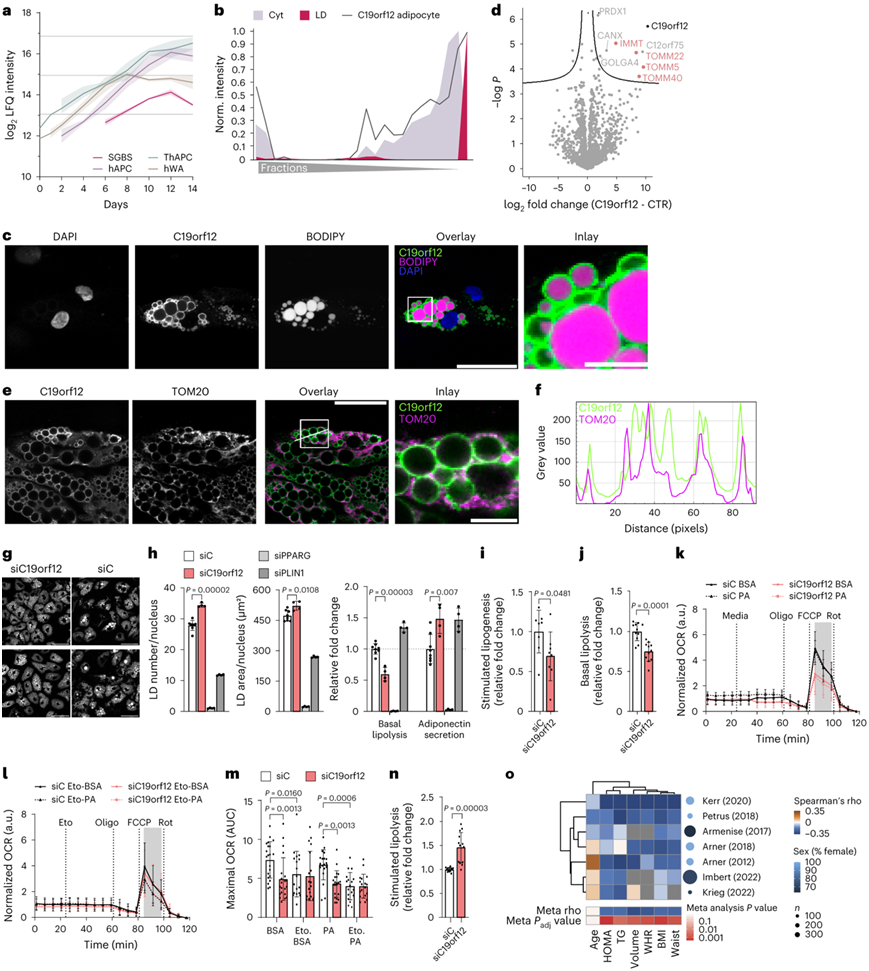
图6. C19orf12 调节脂肪细胞脂质变化。
(a) 脂肪生成过程中 C19orf12 水平的时间调节。(b) SGBS 细胞中 C19orf12 的蛋白质谱与所示的细胞器标记谱重叠。(c) SGBS脂肪细胞中C19orf12的代表性免疫荧光。(d) 在过度表达 GFP 标记蛋白的 SGBS 前脂肪细胞中,C19orf12-GFP 与 GFP 对照的相互作用组的火山图。(e) SGBS 脂肪细胞中 C19orf12 的代表性免疫荧光。(f) C19orf21 和 TOM20 的荧光信号强度图。(g) 分化前1天C19orf12和对照siRNA处理后分化第12天hAPC中BODIPY染色的两个代表性图像。(h) LD数,LD面积,基础脂解和脂联素分泌。(i) 第 8 天 siRNA 处理后分化第 13 天 hAPC 中的刺激脂肪生成分析。(j,n) 在siRNA处理后的第8天,hAPCs在分化第12天发生了基础和刺激的脂肪分解。(k-m) 分化第12天的OCR测量和第8天siRNA处理的hAPCs在BSA或棕榈酸盐存在和依托莫西处理下的OCR定量。(o) C19orf12表达与临床参数的关系。
+ + + + + + + + + + +
结 论
本项研究生成了人类脂肪生成的时空蛋白质组图谱,它阐明了细胞重塑以及代谢途径的空间重组,以优化细胞的脂质积累,并强调脂肪细胞形成过程中蛋白质定位和丰度的协调调节。确定了蛋白质水平的区室特异性调节和代谢酶的定位变化,以重新编程支链氨基酸和一碳代谢,以提供构建块和还原当量。此外,还确定 C19orf12 是一种分化诱导的脂肪细胞脂滴蛋白,它与脂滴相关线粒体外膜复合物的转位酶相互作用,并通过确定线粒体代谢脂肪酸的能力来调节脂肪细胞脂质储存。
+ + + + +



 English
English


