文献解读|Cancer Cell(50.3):鉴定胶质母细胞瘤中具有血管正常化治疗潜力的缺氧巨噬细胞
✦ +
+
论文ID
原名:Identification of hypoxic macrophages in glioblastoma with therapeutic potential for vasculature normalization
译名:鉴定胶质母细胞瘤中具有血管正常化治疗潜力的缺氧巨噬细胞
期刊:Cancer Cell
影响因子:50.3
发表时间:2024.04.18
DOI号:10.1016/j.ccell.2024.03.013
背 景
弥漫性神经胶质瘤,包括异柠檬酸脱氢酶 (IDH) 野生型 (wt) 胶质母细胞瘤 (GBM) 和 IDH 突变型星形细胞瘤和少突胶质细胞瘤,是成人中最常见的恶性脑肿瘤。肿瘤相关巨噬细胞 (TAM) 是弥漫性神经胶质瘤中主要的免疫浸润。TAM 直接与恶性细胞相互作用,促进肿瘤发生。弥漫性胶质瘤中的 TAM 主要来源于外周单核细胞(单核细胞衍生的 TAM [Mo-TAM])或大脑驻留小胶质细胞(小胶质细胞衍生的 TAM [Mg-TAM])。不同 Mo-TAM 子集的功能以及它们的表型是否受到空间限制或受特定生态位线索引导仍然很大程度上未知。
实验设计

结 果
01
弥漫性胶质瘤中骨髓细胞的单细胞转录组学
研究者团队收集了来自 51 例人类弥漫性胶质瘤和 12 例小鼠 GBM (mGBM) 样本的 单细胞转录组分析(scRNA-seq)数据,并分析了骨髓细胞组成和 Mo-TAM 细胞多样性(图 1 A)。肿瘤标本来源于诊断为 GBM-IDHwt、IDH 突变型星形细胞瘤 (Astro-IDHmut) 和 IDH 突变型少突胶质细胞瘤 (Oligo-IDHmut) 的患者(图 1 A)。数据集中的31 个神经胶质瘤标本位于大脑的不同脑叶(图 1 B)。通过基于规范基因表达模式和拷贝数变异(CNV)的无偏聚类和细胞谱系注释,他们鉴定了 360214 个单细胞,分为 12 个主要谱系。两种最丰富的细胞类型是肿瘤细胞(占总数的 46%)和骨髓细胞(占总数的 30%)。根据典型细胞类型标记,骨髓细胞进一步分为单核细胞、Mo-TAM、Mg-TAM、树突状细胞(DC)和增殖性TAM(图1C)。有趣的是,GBM-IDHwt 中 Mo-TAM 的比例高于 IDH 突变型胶质瘤(Astro-IDHmut 和 Oligo-IDHmut),而与 GBM-IDHwt 相比,Mg-TAM 在 IDH 突变型胶质瘤中更为普遍。他们进一步将 Mg-TAM 和 DC 分为不同的细胞状态或亚型,产生 Mg-TAM 的五种状态和 DC 的四种亚型,强调了每种类型的肿瘤浸润骨髓细胞内的转录多样性。
为了确定弥漫性神经胶质瘤中 Mo-TAM 聚类的异质性,他们分析了人类 Mo-TAM,并鉴定了六个表现出独特分子特征的聚类(图1C-E)。具体来说,缺氧(Hypoxia)-TAM 聚类表现出显著的缺氧反应程序,其特征是缺氧反应基因(ADM、BNIP3和CSTB)上调、糖酵解增强和促血管生成。趋化性(Chemo)-TAM聚类的特征是涉及细胞迁移和白细胞趋化性的基因模块。干扰素 (IFN)-TAM 聚类显示 IFN 刺激基因(IFIT1、IFIT3和IFI44L)的上调以及 IFN 响应特征(CXCL10、MX1和MX2)。Lipid-TAM 聚类的特点是丰富的脂质代谢和脂质载体蛋白(APOC1和APOE)的上调。核糖体 (Ribo)-TAM 聚类富含核糖体基因(RPL13和RPL19),并具有 rRNA 处理程序的特征。上调的参与吞噬和抗原提呈的基因(CD83和HLA-DRA)识别吞噬和抗原提呈(Phago/AP)-TAM聚类(图 1D-E)。hGBM和mGBM的公开scRNA-seq数据集的meta分析证实Mo-TAM聚类在很大程度上是保守的(图1F-I)。然而,Mo-TAM的组成在人类不同类型的弥漫性胶质瘤中存在显著差异。与IDH突变型胶质瘤相比,与 IDH 突变神经胶质瘤相比,GBM-IDHwt 中Hypoxia -TAM 和 Chemo-TAM 的频率更高,而 Phago/AP-TAM 的比例更低(图 1 H)。
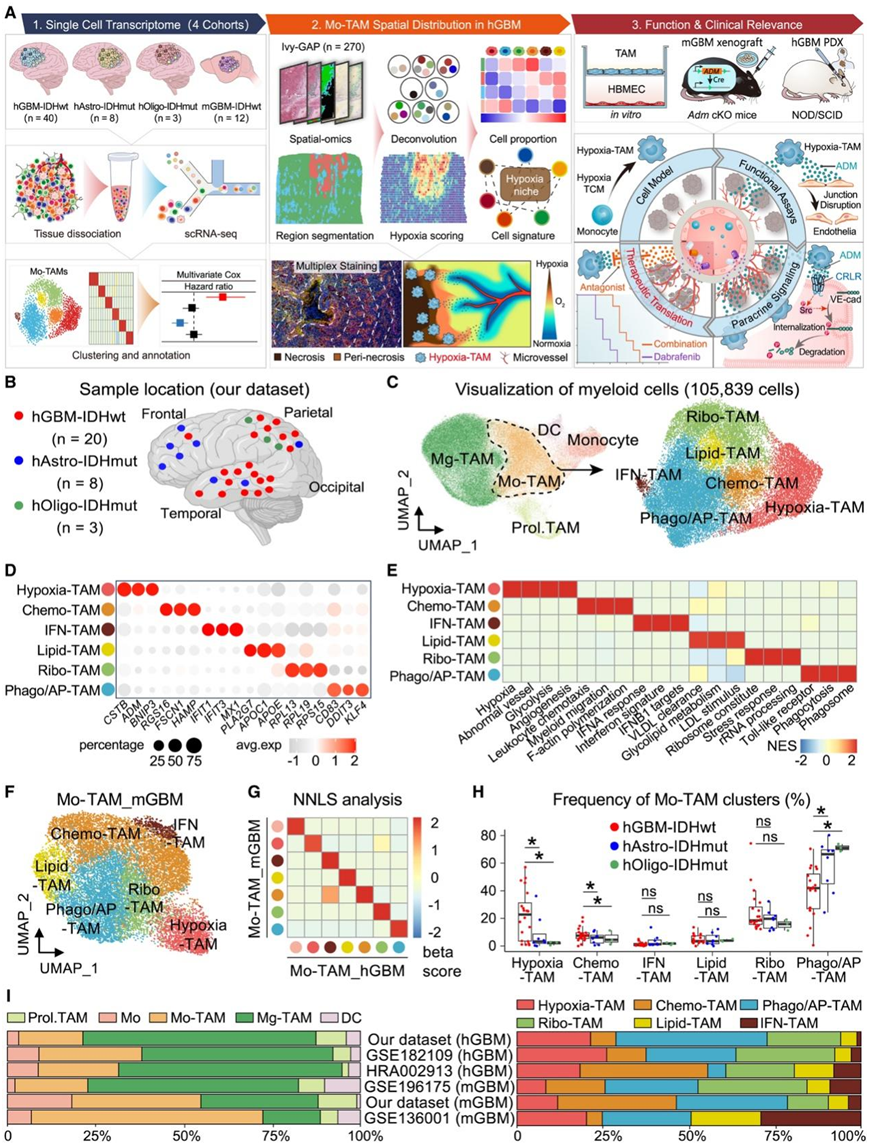
图1. 人弥漫性胶质瘤中Mo-TAM单细胞景观。
(A)实验流程。(B) scRNA-seq数据集中人类胶质瘤标本的位置。(C)UMAP 可视化。(D)细胞特异性标记点图。(E) Mo-TAM集群间基因集变异分析(GSVA)。(F)使用GL261 mGBM scRNA-seq数据集的Mo-TAM聚类的UMAP图。(G)非负最小二乘回归(NNLS)分析显示hGBM(横轴)和mGBM(纵轴)之间的Mo-TAM聚类具有相似性。(H)显示频率的箱形图。(I) hGBM和mGBM中骨髓细胞类型(左)和Mo-TAM细胞聚类(右)细胞组成的堆叠柱状图。
02
Mo-TAM 成分对弥漫性神经胶质瘤的临床意义
使用癌症基因组图谱 (TCGA)-GBM/低级别胶质瘤 RNA 测序 (RNA-seq) 数据集,他们研究了 Mo-TAM 聚类方案的翻译意义。使用反卷积分析估计每个 Mo-TAM 聚类的频率。与 IDH 突变胶质瘤相比,GBM-IDHwt 中 Hypoxia-TAM、Chemo-TAM、IFN-TAM 和 Lipid-TAM 的频率增加,而 Ribo-TAM 和 Phago/AP-TAM 的频率减少(图 2 A-B)。使用 TCGA 样本,不同 Mo-TAM 聚类的比例也与神经胶质瘤分级(图 2A)和关键分子变化(图 2C-D)相关。Hypoxia-TAM 的预测比例独立表明 GBM 患者的预后较差(图 2 E),表明其具有肿瘤支持功能。这些数据强调了 Mo-TAM 分类方案用于评估弥漫性胶质瘤中 Mo-TAM 成分的可行性和可重复性,并具有临床意义。
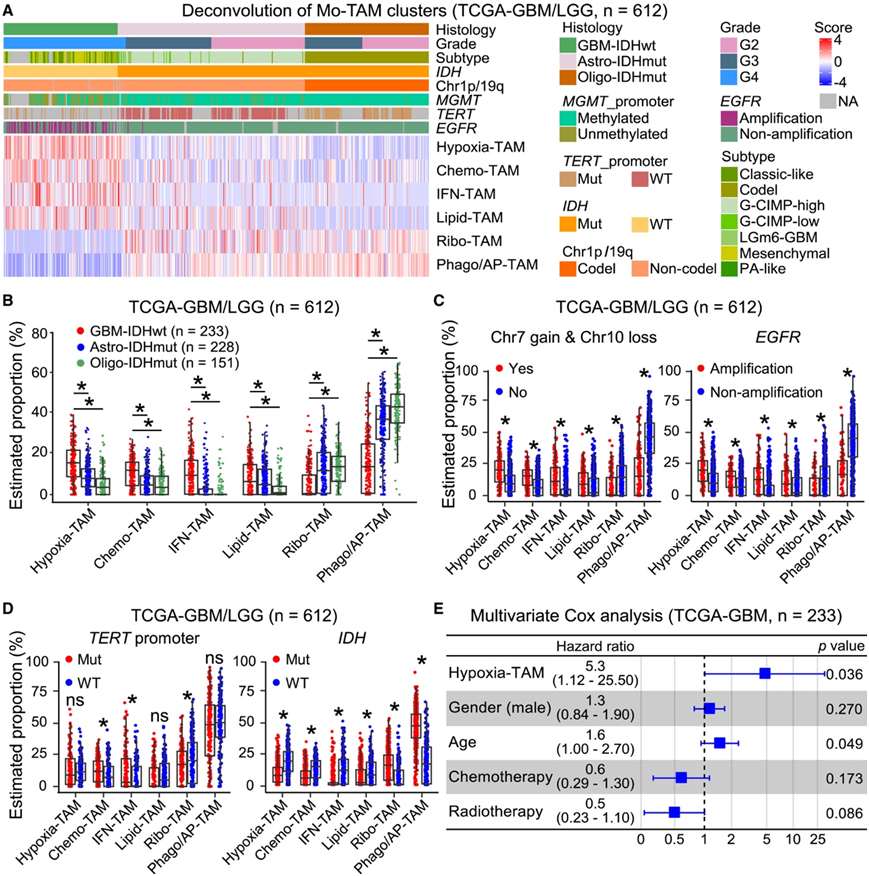
图2. Mo-TAM 分类方案的临床相关性。
(A) 热图描绘了使用 TCGA-GBM/LGG 队列在弥漫性神经胶质瘤中不同 Mo-TAM 聚类的估计比例。(B–D) 箱线图显示使用 TCGA-GBM/LGG 队列在不同类型或分子特征的弥漫性胶质瘤中 Mo-TAM 聚类的估计比例。(E) 使用 TCGA-GBM 队列对患者总生存期进行多变量 Cox 回归分析。
03
Mo-TAM在空间分辨率下的细胞多样性
为了在空间上分析Mo-TAM的异质性,他们使用Ivy-hGBM队列将Mo-TAM的转录特征与hGBM组织的不同组织学区域联系起来,并估计每个Mo-TAM聚类的比例(图3A)。值得注意的是,Hypoxia-TAM 优先位于坏死周围区域。血管周围区域IFN-TAM的比例相对较高。在浸润肿瘤区域,Chemo-TAM 减少,而 Ribo-TAM 和 Phago/AP-TAM 适度增加。相比之下,Lipid-TAM 的比例在不同区域和样本之间表现出差异(图 3 A)。空间分辨转录组分析在很大程度上概括了 Ivy-hGBM 病例中不同 Mo-TAM 聚类的预测空间分布(图3B-D)。
对 Hypoxia-TAM 空间特征的具体分析表明,Hypoxia-TAM 转录特征和ADM作为标记基因的表达在缺氧肿瘤区域显著上调。ADM和Mo-TAM标志物半乳糖凝集素-3的共染色证实了缺氧TAM(定义为ADM+/ galectin-3 + Mo-TAM)靠近hGBM组织中的假栅栏状坏死区域(图3E)。
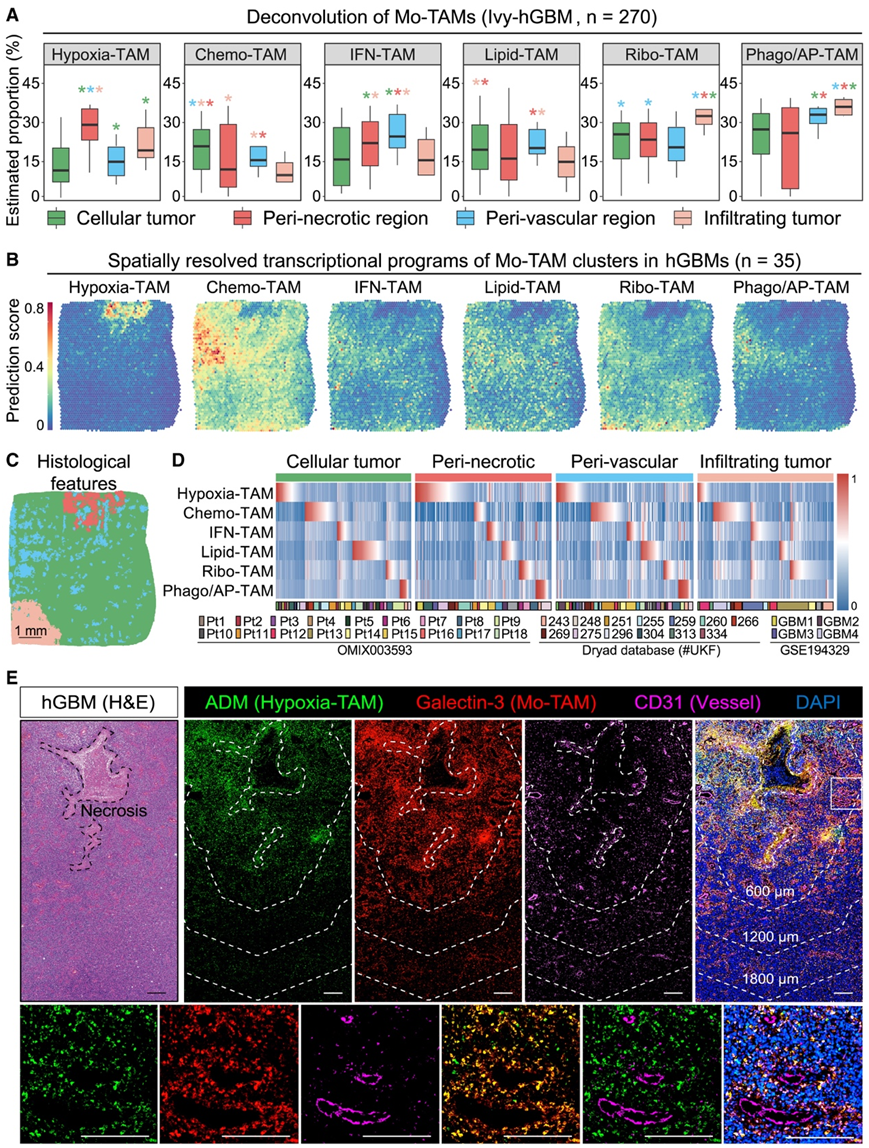
图3. Mo-TAM在空间分辨率下的细胞多样性。
(A) 箱线图显示使用 Ivy-hGBM 队列的bulk RNA-seq 数据估计 hGBM 不同组织学区域中 Mo-TAM 聚类的估计比例。(B) 表面图显示使用三个公开 hGBM 空间转录组数据集在空间分辨率下跨 Mo-TAM 聚类的转录程序。(C) hGBM 的注释组织学特征。(D) 使用公开 hGBM 数据集按不同组织学区域排列的空间转录组热图。(E) hGBM 坏死周围区域 ADM、galectin-3 和 CD31 的 H&E 染色和免疫染色。
04
缺氧肿瘤信号诱导缺氧-TAM 极化
为了确定 Hypoxia-TAM 的极化是否可以由缺氧肿瘤线索驱动,他们建立了体外Mo-TAM 极化模型(图 4 A)。 hGBM-3肿瘤细胞条件培养基(TCM)加1% O2的培养条件有效上调源自人外周血单核细胞(PBMC)、U937细胞和小鼠的Mo-TAM中Hypoxia-TAM特征基因的表达骨髓源性巨噬细胞 (BMDM)(图 4B,图S5A-B)。他们在 TCM 和/或 1% O2的刺激下对巨噬细胞 (Mφ) 进行了bulk转录组分析(bulk RNA-seq)(图 S5 C)。对这四种不同极化的 Mφ 中 Hypoxia-TAM 特征基因表达的评估表明,暴露于 TCM 加1% O2的 Mφ很大程度上类似于hGBM scRNA-seq 数据集中注释的 Hypoxia-TAM 转录特征(图 S5 D)。为了阐明肿瘤诱导的变化和缺氧诱导的变化对TAM缺氧极化的作用,他们使用定量蛋白质组学分析筛选肿瘤细胞产生的因子,并评估缺氧刺激下糖酵解代谢物谱的变化(图S5E-G)。肿瘤细胞来源的富含半胱氨酸的酸性分泌蛋白(SPARC)(图S5F)和缺氧诱导的乳酸(图S5H)确定为诱导缺氧-TAM特征的关键生态位因子,这两种因子的组合在很大程度上类似于缺氧-TAM极化的缺氧肿瘤线索(图S5I-K)。
为了揭示缺氧肿瘤线索引导的 Mo-TAM 表型变化,他们使用 hGBM scRNA-seq 数据筛选缺氧正相关或负相关基因(称为 HPG 或 HNG),并绘制缺氧相关基因相互作用网络。上调的通路与 TAM 募集(MES 样细胞迁移)、细胞对缺氧的适应(饥饿、自噬和糖酵解)和生态位重塑(血管生成和细胞外基质降解)相关(图 4 C)。下调的通路与 TAM 的免疫抑制特征(吞噬作用受损、抗原呈递延迟、T 细胞激活效率低下以及 IFN 产生减少)和细胞周期停滞相关(图 4 C)。核心转录因子(TF)和缺氧反应基因在 Hypoxia-TAM 聚类中富集,并与上述通路密切相关(图 4 C)。
对 Hypoxia-TAM 聚类和来自 GSEA 分子特征数据库 (MSigDB) 的缺氧反应基因集调节子活性得分最高的前 10 个 TF 进行子集化,将 p50、缺氧诱导因子 1α (HIF1α) 和 c-Jun 作为核心 TF 调节缺氧 TAM 特征(图 4 D)。他们使用短发夹 RNA (shRNA) 特异性敲低 PBMC 衍生的 Hypoxia-TAM 中的这些 TF。p50(由NFKB1编码)的破坏显著降低了Hypoxia-TAM特征基因的表达,而其他两个TF则没有(图4E)。他们还证实 p50 介导的ADM转录是 Hypoxia-TAM 特征基因(图 4F-H)。这些结果表明,肿瘤细胞产生的 SPARC 和缺氧诱导的乳酸至少部分通过激活 p50 协同促进缺氧-TAM 极化(图 4 I)。
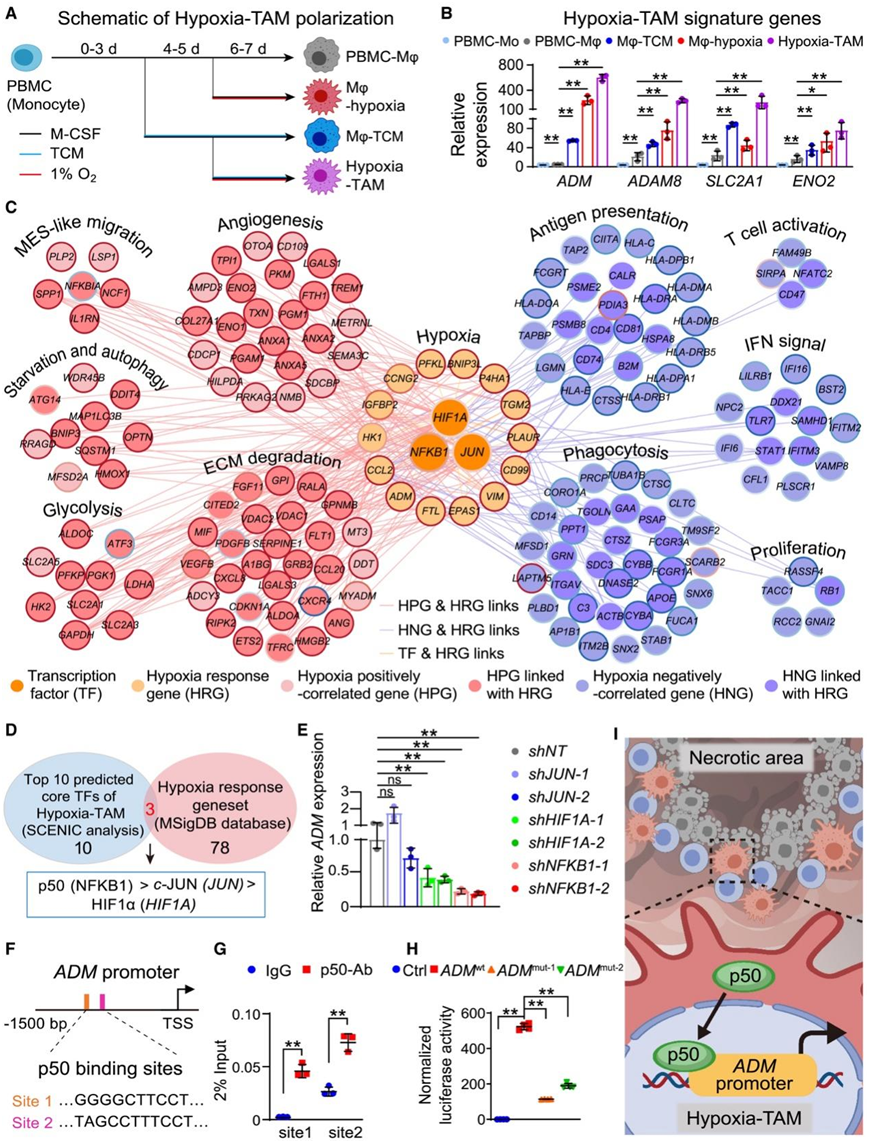
图4. 缺氧肿瘤信号促进Hypoxia-TAM极化。
(A) 单核细胞极化至不同 Mφ 状态的示意图。(B) Hypoxia-TAM 特征基因表达的 qRT-PCR 分析。(C) 网络图说明缺氧相关基因相互作用和缺氧-TAM 的通路富集。(D) Hypoxia-TAM 和缺氧反应基因组的预测核心 TF 的子集。(E)对 PBMC 衍生的 Hypoxia-TAM 表达靶向JUN、HIF1A和NFKB1的 shRNA 中ADM表达进行 qRT-PCR 分析。(F) ADM基因启动子上 p50 结合位点的示意图。(G) 使用 PBMC 衍生的缺氧 TAM 对 p50 进行 ChIP-qPCR。(H) 在 PBMC 衍生的缺氧 TAM 中进行荧光素酶报告基因分析。(I) Hypoxia-TAM 中p50 介导的ADM转录的示意图。
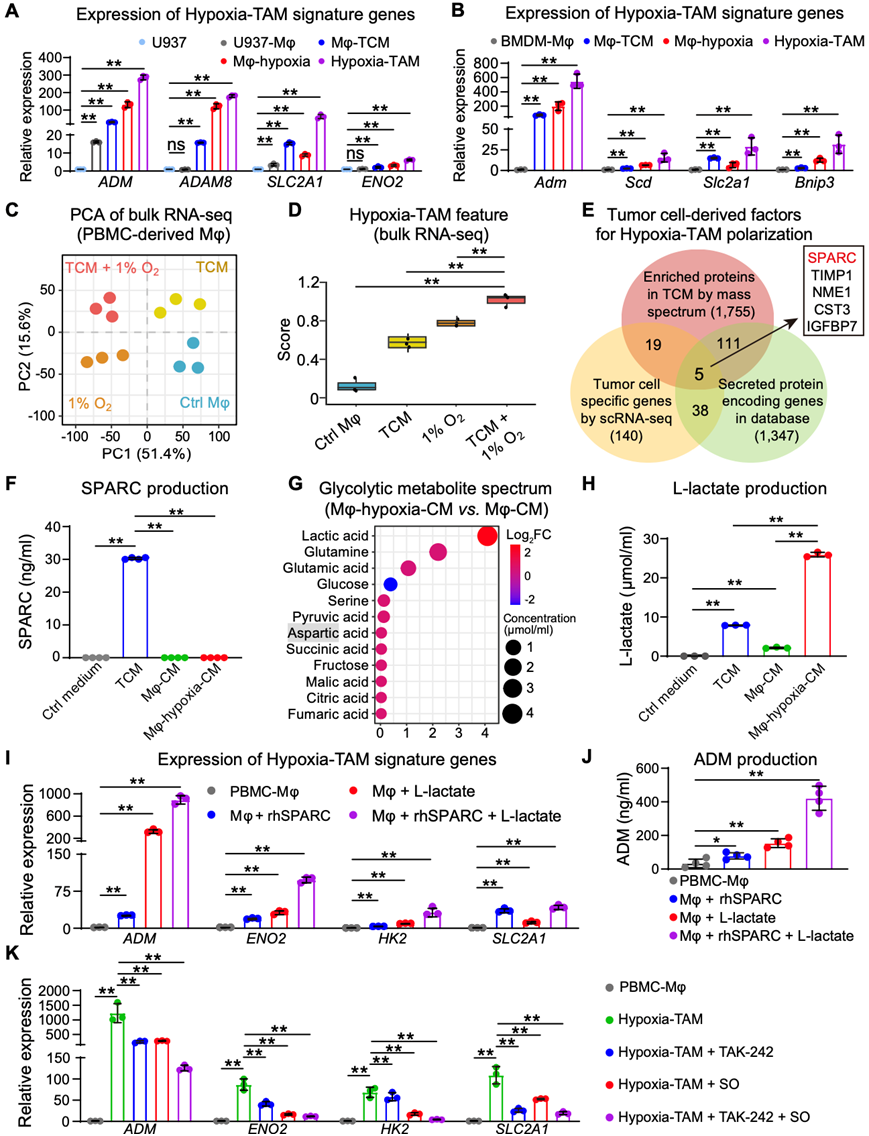
图S5. 肿瘤细胞产生的SPARC和缺氧诱导的乳酸共同诱导缺氧- TAM极化。
(A-B)qPCR分析。(C)主成分分析(PCA)。(D)缺氧- TAM特征基因在差异极化体Mφ中的平均表达分数。(E)利用hGBM scRNA-seq数据集鉴定出TCM中富集蛋白、编码分泌蛋白的人类基因以及在肿瘤细胞中优先表达的人类基因的亚群。(F)酶联免疫吸附试验(ELISA)分析。(G)气泡图显示Mφ-hypoxia-CM组与Mφ-CM组糖酵解代谢谱的变化。(H) L-乳酸测定法测定的分泌L-乳酸浓度。(I) qRT-PCR分析。(J) ELISA法测定PBMC衍生的Mφ在指定刺激下产生ADM的浓度。(K) qRT-PCR分析。
05
Adm基因缺失恢复 mGBM 血管完整性
他们确定了 Hypoxia-TAM 在缺氧生态位中的功能意义。在 hGBM 的坏死周围区域,富集的缺氧 TAM 伴随着丰富的微血管(图 3 E)。使用 hGBM scRNA-seq 数据进行的基因集变异分析表明,Hypoxia-TAM 富含调节脉管系统完整性和发育的通路(图 5 A)。使用hGBM scRNA-seq数据集、编码分泌蛋白的人类基因和来自MSigDB的缺氧反应基因集对缺氧TAM特征基因进行亚组分析,结果显示ADM是唯一的候选基因(图5B)。他们使用Ccr2-Cre-eGFP在单核细胞衍生物中有条件地敲除Adm;Admfl/fl小鼠(称为Adm cKO小鼠)建立GL261 mGBM异种移植瘤(图5C)。
葡聚糖(70 kDa)标记肿瘤血管的活体成像显示,与Ccr2-Cre-eGFP (WT)异种移植物相比,Adm cKO异种移植物的肿瘤血管和连接点密度中度降低(图5D-E)。在结构上,与WT异种移植物中相邻内皮细胞(EC)之间的宽间隙相比,Adm cKO异种移植物中的内皮细胞(EC)明显缩小(图5F)。免疫染色显示,内皮黏附连接标志物血管内皮(VE)-cadherin的表达在Adm cKO异种移植物中大量恢复(图5G)。同时,紧密连接标志物claudin-5、周细胞标志物血小板衍生生长因子受体β和血管基底膜标志物层粘连蛋白的表达不受Adm敲除的影响(图5G)。使用尸胺(1 kDa)评估肿瘤血管通透性显示,与野生型异种移植物相比,Adm cKO异种移植物的尸胺渗出面积显著减少(图5G)。
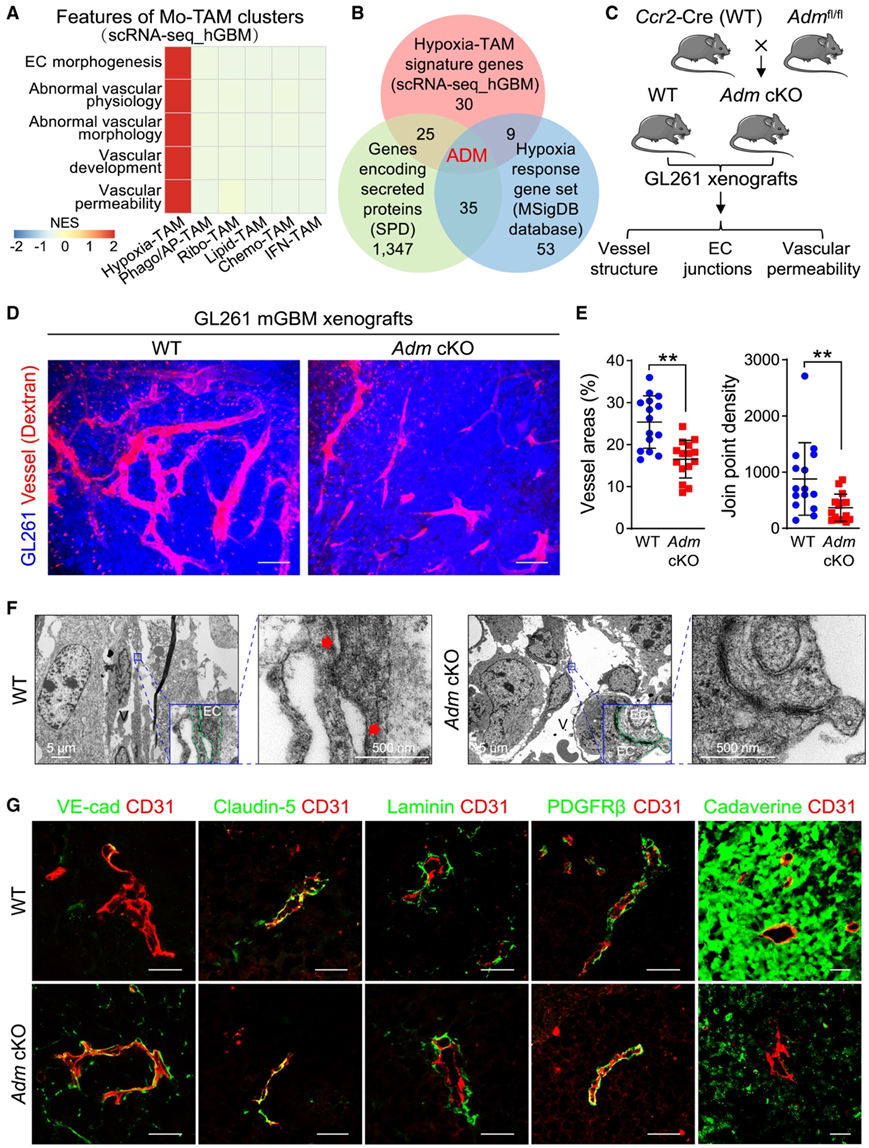
图5. Adm敲除可恢复 mGBM 异种移植物中的血管完整性。
(A) hGBM scRNA-seq 数据的 GSVA 显示缺氧 TAM 富集的通路。(B) 来自 hGBM scRNA-seq 数据集的 Hypoxia-TAM 特征基因的子集、来自基于网络的分泌蛋白数据库 (SPD) 的分泌蛋白编码基因以及来自 MSigDB 的缺氧反应基因集。(C) Ccr2 -Cre-eGFP (WT) 小鼠和Adm cKO 小鼠的生成以及随后对 GL261 mGBM 异种移植物中肿瘤血管的评估的示意图。(D-E) WT 和Adm cKO 异种移植物中葡聚糖标记的肿瘤脉管系统的活体成像以及血管结构的定量。(F) 异种移植物中微血管的透射电子显微镜 (TEM)分析。(G) 异种移植物中 VE-钙粘蛋白、claudin-5、层粘连蛋白、PDGFRβ、尸胺和 CD31 的免疫染色分析。
+ + + + + + + + + + +
结 论
本项研究绘制了 51 名IDH野生型胶质母细胞瘤或 IDH 突变型胶质瘤患者的 Mo-TAM 空间解析转录图谱。Mo-TAM子集位于坏死周围生态位,并受到缺氧生态位线索的影响,并具有缺氧反应特征。Hypoxia--TAM 通过激活肾上腺髓质素旁分泌信号传导破坏内皮粘附连接的稳定性,从而刺激高渗透性的新血管系统,从而阻碍胶质母细胞瘤异种移植物中的药物输送。因此,对 Hypoxia-TAM 产生的肾上腺髓质素进行基因敲除或药理学阻断可恢复血管完整性。 Hypoxia-TAM 或肾上腺髓质素表达比例的增加预示着肿瘤血管通透性过高和胶质母细胞瘤的预后较差。本项研究结果强调了弥漫性神经胶质瘤中 Mo-TAM 的多样性和空间生态位导向的 Mo-TAM 重编程,并表明了针对缺氧 TAM 以使肿瘤血管正常化的潜在治疗方法。
+ + + + +



 English
English


