文献解读|Sci Adv(13.600):ULK1介导的代谢重编程通过乳酸化修饰调节Vps34脂质激酶活性
原名:ULK1-mediated metabolic reprogramming regulates Vps34 lipid kinase activity by its lactylation
译名:ULK1介导的代谢重编程通过乳酸化修饰调节Vps34脂质激酶活性
期刊:Science Advances
影响因子:13.600
发表时间:2023.6.2
DOI号:10.1126/sciadv.adg4993
背 景
自噬和糖酵解是高度保守的生物学过程,参与生理和病理状态下的细胞程序反应,但是二者之间的相互作用知之甚少。在本文,作者发现在营养剥夺条件下UNC-51样激酶1(ULK1)被激活,进一步激活糖酵解酶——乳酸脱氢酶A(LDHA)。具体来说,ULK1直接与LDHA相互作用,当营养物质稀少时LDHA丝氨酸-196位点发生磷酸化(LDHA Ser196),促进乳酸生成。乳酸进一步介导空泡蛋白分选34(Vps34,自噬的关键调控因子)赖氨酸-356和赖氨酸-781位点的乳酸化修饰,将自噬和糖酵解连接起来。Vps34乳酸化修饰促进自噬和溶酶体运输。除此之外,作者还发现Vps34乳酸化修饰与癌症进展相关。总之,作者的发现描述了自噬的调节机制,整合了细胞自噬和糖酵解的相互作用。
实验设计
结 果01

ULK1介导LDHA Ser196磷酸化
为了全面鉴定ULK1的相互作用蛋白,作者进行了串联亲和纯化实验。质谱分析揭示了糖酵解酶LDHA可与ULK1结合。进一步通过免疫共沉淀和酵母双杂交实验证实了ULK1与LDHA的相互作用(图1 A-C)。因为ULK1可介导糖酵解酶己糖激酶(HK)和磷酸果糖激酶1(PFK1)的磷酸化,因此作者假设ULK1可能也介导了LDHA的磷酸化。通过质谱分析发现LDHA在Ser196位点可被ULK1磷酸化。为了进一步验证,作者制备了特异性识别LDHA Ser196磷酸化的多克隆抗体(图1 D)。且用丙氨酸(S196A)替换196位的丝氨酸可完全消除LDHA磷酸化(图1 E、I)。
Earle平衡盐溶液(EBSS)诱导的饥饿或雷帕霉素激活ULK1,可增强LDHA Ser196磷酸化,而ULK1抑制剂MRT68921可降低LDHA Ser196磷酸化(图1 F)。一致地,ULK1的敲除(KO)可降低LDHA Ser196磷酸化(图1 G),且可抑制p62(抑制自噬蛋白)的降解(图1 H)。这些结果表明ULK1作为上游调节因子介导LDHA Ser196磷酸化。

图1 ULK1介导LDHA Ser196磷酸化。
A -C,免疫共沉淀和酵母双杂交实验;D,抗体检测;E,免疫共沉淀;F-I,蛋白质印迹。
02

乙酰转移酶TIP60介导Vps34 K356和K781位点的乳酸化修饰
乳酸化修饰是一种主要的蛋白翻译后修饰。LDHA调控糖酵解生成乳酸,因此作者推测乳酸通过调控自噬核心蛋白的乳酸化修饰从而调节自噬。因此,作者首先用泛乳酸化抗体通过免疫共沉淀测定了自噬核心蛋白的乳酸化修饰。结果表明许多处于不同自噬阶段的核心蛋白均会发生乳酸化修饰,包括Vps34(图2 A-B)。作者发现LDHA敲低或抑制后,Vps34乳酸化修饰水平降低(图2 C-D)。通过质谱分析,鉴定出Vps34有两个赖氨酸残基(K356和K781)发生乳酸化修饰。为了验证这两个位点的乳酸化修饰,通过定点突变将两个赖氨酸残基变为精氨酸残基,结果表明Vps34K356R和Vps34K781R的乳酸化修饰水平显著降低,双突变体(Vps342KR)的乳酸化修饰消失(图2 E)。
许多研究表明,乙酰转移酶和去乙酰转移酶不仅分别介导蛋白质的乙酰化和去乙酰化,还催化其他酰化修饰。作者构建了乙酰转移酶的shRNA文库,用泛乳酸化抗体进行免疫共沉淀,结果表明敲低KAT5/TIP60可显著减弱Vps34的乳酸化修饰(图2 F-G),且EBSS饥饿处理促进了Vps34和TIP60的相互作用(图2 H)。这些结果表明TIP60介导了Vps34的乳酸化修饰。

图2乙酰转移酶TIP60介导Vps34 K356和K781位点的乳酸化修饰。
A-E,免疫共沉淀;F-G,shRNA文库;H,免疫共沉淀。
03

Vps34乳酸化修饰促进自噬体形成和成熟
Vps34在自噬体形成和成熟中起重要作用。Vps342KR抑制了p62降解(图3 A)。微管相关蛋白1轻链3(LC3)是自噬体膜和自噬溶酶体膜的特征性标志物,分为LC3-I和LC3-II两型,LC3-I是可溶性的,LC3-II结合于自噬结构膜上,因此LC3-II的表达与自噬结构形成成正比。Vps34乳酸化修饰介导LC3的剪切(图3 B-D)。同样,透射电镜检测显示,Vps34乳酸化修饰促进自噬囊泡的数量(图3 E-F)。这些结果证明自噬体形成和成熟需要Vps34被乳酸化修饰。
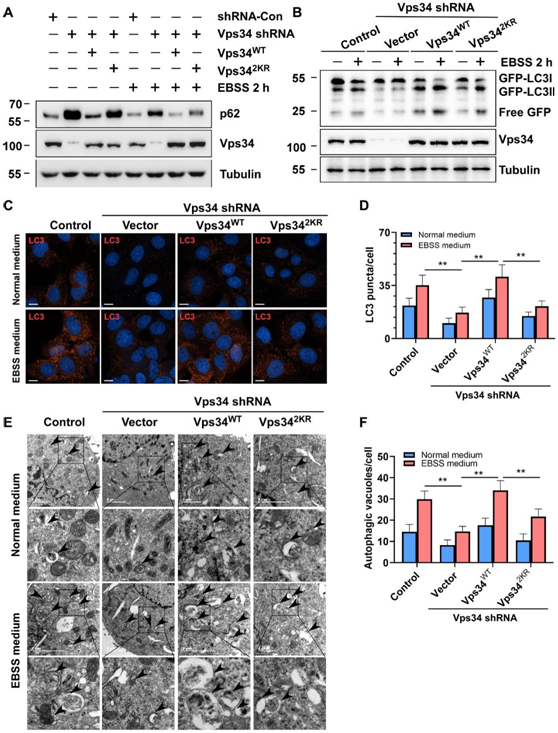
图3 Vps34乳酸化修饰促进自噬体形成和成熟。
A-B,蛋白质印记;C-D,免疫组化;E-F,透射电镜检测。
04

Vps34乳酸化修饰与癌症进展相关
为探究Vps34乳酸化修饰的病理功能,作者分析了人肺癌和胃癌中乳酸水平与Vps34乳酸化修饰的关系。结果表明人肺癌和胃癌中乳酸水平升高(图4 A、E),且Vps34乳酸化修饰增加,同时伴随着LDHA的表达上调和自噬通量的增加(图4 B-H),表明乳酸通过上调Vps34的乳酸化修饰调节肿瘤组织的自噬活性,与癌症进展密切相关。
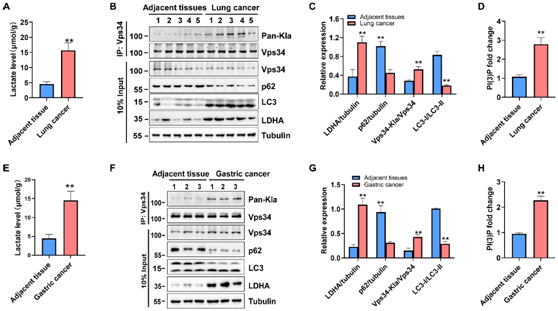
图4 Vps34乳酸化修饰与癌症进展相关。
A,E,乳酸含量检测;B,F,免疫共沉淀;C,G,相对表达量检测;D,H,PI(3)P含量检测。
+ + + + + + + + + + +
结 论
总之,作者提供的证据表明ULK1通过介导LDHA Ser196磷酸化来增强LDHA活性,促进乳酸的产生。乳酸进一步介导Vps34的乳酸化修饰促进其脂质激酶活性,以利于细胞自噬和溶酶体降解。Vps34乳酸化修饰通过调节细胞自噬在肿瘤进展过程中起关键作用。这项研究描述了一种新的自噬调控机制,整合了糖酵解和自噬两个高度保守的生命过程。
+ + + + +



 English
English

