文献解读|Cell Rep Med(11.7):肠道微生物 GABA 失衡成为轻度自闭症谱系障碍的代谢特征,与大肠杆菌过度表达有关
✦ +
+
论文ID
原名:Gut microbial GABA imbalance emerges as a metabolic signature in mild autism spectrum disorder linked to overrepresented Escherichia
译名:肠道微生物 GABA 失衡成为轻度自闭症谱系障碍的代谢特征,与大肠杆菌过度表达有关
期刊:Cell Reports Medicine
影响因子:11.7
发表时间:2025.01.21
DOI号:10.1016/j.xcrm.2024.101919
背 景
自闭症谱系障碍 (ASD) 的特征是社交互动受损、行为重复和兴趣刻板,对患者社会适应能力构成重大挑战。自闭症的全球患病率最近估计为 1%–2%,自闭症给社会带来了沉重的负担。人们普遍认为,早期干预对于取得积极成果至关重要,但由于自闭症症状多样,且言语和非言语交流表达能力有限,因此在幼儿中诊断自闭症仍然具有挑战性。迫切需要有效的实验室指标来阐明自闭症病因并跟踪其发展。
实验设计
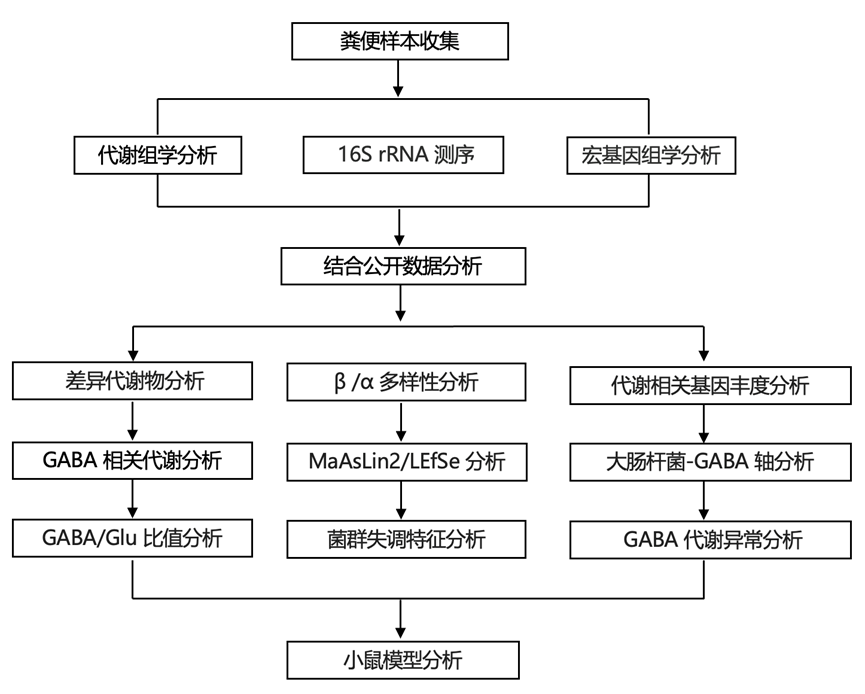
结 果
01
微生物 GABA 代谢失衡是 ASD 的一个与年龄和性别无关的特征
研究团队重点研究轻度 ASD病例,他们代表了该患者群体在全球范围内的主要人群。此外,本研究分为两个不同的阶段,以有效筛选和验证与 ASD 相关的核心微生物特征。其中,在筛选阶段,从专门的 ASD 研究所和邻近社区招募了一批 123 名儿童[56 名 ASD 和 67 名 正常发育 (TD)](筛选队列)。此阶段的招募策略经过量身定制,以确保参与者的环境因素和人口分布的同质性。儿童自闭症评定量表评估证实,所有患有 ASD 的受试者确实都是轻度病例。为了扩大研究的地域多样性,他们组建了一个验证队列,包括来自多个机构的 40 名轻度 ASD 受试者,以及地理匹配的 TD 受试者。
为了研究 ASD 中肠道微生物群 (GM) 的代谢特征,他们首先确定了总共 32 种代谢物,包括 10 种神经递质、7 种短链脂肪酸 (SCFA)和 15 种胆汁酸 (BA),根据文献或临床推断,它们广泛适用于 ASD 症状。他们首先使用了筛选队列中的第一次取样并进行了代谢组学分析(图 1 A)。为了最大限度地减少队列中混杂因素造成的分析偏差,他们应用了逆正态变换 (INT) 方法来实现根据年龄和性别调整的正态分布的代谢物水平。随后使用偏最小二乘判别分析 (PLS-DA) 进行分析,结果显示 ASD 和 TD 个体之间的代谢物谱有明显的分离(图 1 B),确定了 6 种差异代谢物:γ-氨基丁酸 (GABA)、去甲肾上腺素、二羟基苯丙氨酸、组氨酸、乙酸和甘醇石胆酸(图 1 C)。值得注意的是,这些差异代谢物中最显著的变化是 ASD 患者的 GABA 水平升高(图 1 D)。
为了更深入地探究 GABA 代谢的变化,他们分析了筛查队列中的第二轮样本,特别关注参与 GABA 代谢的代谢物(图 1 A)。他们选择了 10 种参与 GABA 合成和分解的代谢物,并应用 INT 方法对这些代谢物的水平进行标准化,并根据年龄和性别进行调整。PLS-DA 图显示两组之间的代谢物谱明显分离(图 1 E)。重要的是,与第一个样本的结果一致,与 TD 对照组相比,ASD 患者的 GABA 显著增加,而 Glu、谷氨酰胺 (Gln) 和富马酸显著下降(图 1 F)。这些结果表明 GABA 代谢存在复杂的、ASD 特异性波动。
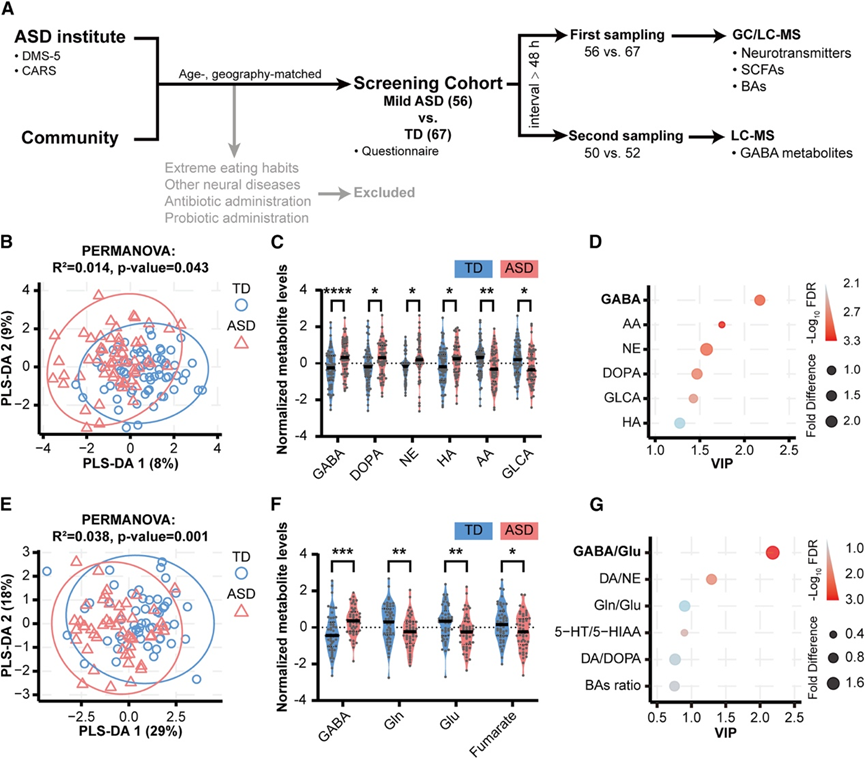
图1. 肠道微生物 GABA 和谷氨酸 (Glu) 代谢失衡是 ASD 的一个与年龄和性别无关的特征。
(A) 筛查队列的实验设计工作流程。(B) 基于 PLS-DA 的第一次采样的肠道微生物代谢分析显示 ASD组和 TD 组之间存在显著差异。(C) 与 TD 组相比,ASD 组的代谢物发生显著改变。(D) GABA 已确定为差异代谢物中变化最显著的代谢物。(E) 基于 PLS-DA 图的第二次采样的 GABA 相关代谢分析。(F) 与 TD 组相比,ASD 组的GABA相关代谢物发生显著改变。(G) ASD组和 TD 组之间比较的代表特定代谢平衡的指数。
02
微生物 GABA/Glu 比值作为 ASD 诊断的独立指标
为了验证在初步筛查中发现的 ASD 特异性代谢改变,并增强研究人群的地理多样性,他们建立了一个新的、地理上不同的队列,称为验证队列(图 2 A)。该队列的逻辑回归分析表明,性别和特定食物(如水果、蔬菜、深色蔬菜、真菌和藻类)的消费量成为与该队列的 ASD 诊断相关的重要混杂因素(图 2 B)。然后,他们进行了代谢组学分析,重点关注神经递质代谢物,共检测到 21 种代谢物,包括 GABA、Glu 和 Gln。为了控制地理、年龄、性别和饮食习惯等潜在混杂因素,他们应用了 INT 方法来标准化代谢物水平。PLS-DA 图显示 ASD 组和 TD 组之间存在不同的代谢组学特征(图 2C)。值得注意的是,ASD 组的 GABA 和 GABA/Glu 比率始终升高(图2D),证实了筛选阶段的结果。
此外,为了评估微生物 GABA/Glu 比率对 ASD 的临床诊断效用,他们进行了受试者工作特征分析。GABA/Glu 比率显示出强大的诊断潜力,曲线下面积为 0.759(图 2 E)。总之,这些结果表明微生物 GABA/Glu 比率是诊断 ASD 的可靠且独立的生物标志物。
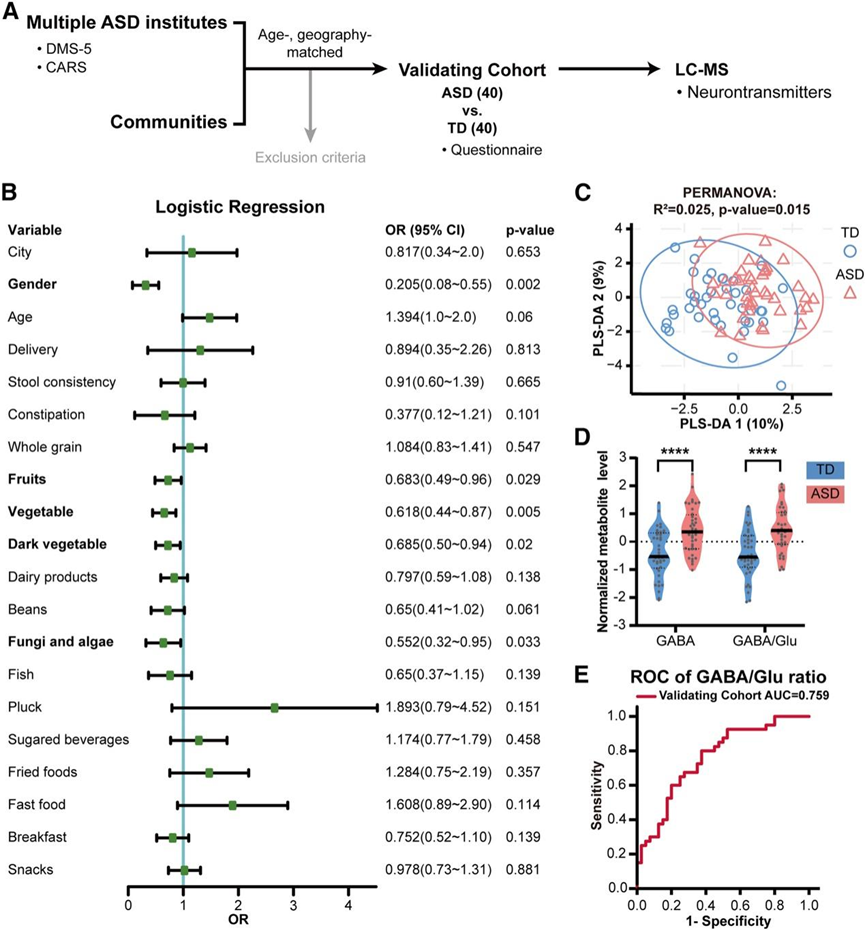
图2. 肠道微生物 GABA/Glu 比值作为与 ASD 诊断相关的独立指标。
(A) 验证队列的实验设计工作流程。(B) 逻辑回归确定了验证队列中与 ASD 诊断相关的 5 个混杂因素。(C) 基于 PLS-DA 图的神经递质分析,揭示了 ASD 组和 TD组之间的显著区别。(D) 与 TD 组相比,验证队列显示 ASD 组的 GABA 和 GABA/Glu 比率增加。(E) ROC 分析表明 GABA/Glu 比率是验证队列中 ASD 诊断的有效指标。
03
GABA/Glu 比率升高与 ASD 相关的 GM 失调有关
为了找出 ASD 和 TD 患者之间 GM 组成的根本差异,以及微生物 GABA 代谢的变化,他们对筛查队列的粪便样本进行了 16S rRNA 基因测序(图 3 A)。利用细菌分类群的相对丰度,进行了 β 多样性和 α 多样性分析。基于 β 多样性分析的主坐标分析描绘了 ASD 组与 TD 组不同的 GM 谱(图 3 B)。然而,在 α 多样性分析中,Chao 指数(表明群落丰富度)和 Shannon 指数(表明群落多样性)均显示两组之间的水平相当(图 3 C)。
随后,为了识别与 ASD 相关的特定细菌属,他们利用了微生物组多变量关联线性模型 2 (MaAsLin2) 和线性判别分析效应大小 (LEfSe) 工具。调整年龄和性别后,MaAsLin2 揭示了 10 个属与 ASD 诊断现在相关(图 3 D)。独立于混杂因素运行的 LEfSe 确定了 ASD 组和 TD 组之间 26 个差异富集的属(图 S1 B)。值得注意的是,这两种方法一致确定了几个属,包括大肠杆菌/志贺氏菌、巨单胞菌、巨球菌、八叠球菌、Sarcina、魏斯氏菌和韦荣球菌,与 ASD 显著相关,这些发现与之前的报告一致,支持ASD患者存在明显的微生物群落改变。
接下来,他们研究了 GM 失调与 GABA 代谢失衡之间的潜在联系,使用 Pearson 相关性分析评估了上述 ASD 组和 TD 组之间的 7 个差异属。在调整年龄和性别后,确定了两个与 GABA/Glu 比率显著相关的属,包括大肠杆菌/志贺氏菌和巨球菌(图 3E)。有趣的是,在这些属中,大肠杆菌/志贺氏菌是唯一已知的能够在人体肠道中产生 GABA 的属,这意味着 GABA/Glu 比率升高可能与 ASD 患者中大肠杆菌或志贺氏菌的过度表达在生物学上有关。考虑到粪便样本的个体差异可能会掩盖ASD 患者真正的GM 菌群失调特征,他们假设 GABA/Glu 代谢失衡恶化可能会使这种菌群失调特征更加明显。令人惊讶的是,GABA/Glu 比率较高的 ASD 个体表现出最明显的 GM 菌群失调,大肠杆菌/志贺氏菌的丰度显著升高(图 3F)。总之,这些发现表明,微生物 GABA/Glu 代谢失衡与 ASD 中的 GM 菌群失调密切相关,尤其是大肠杆菌/志贺氏菌的过度表达。
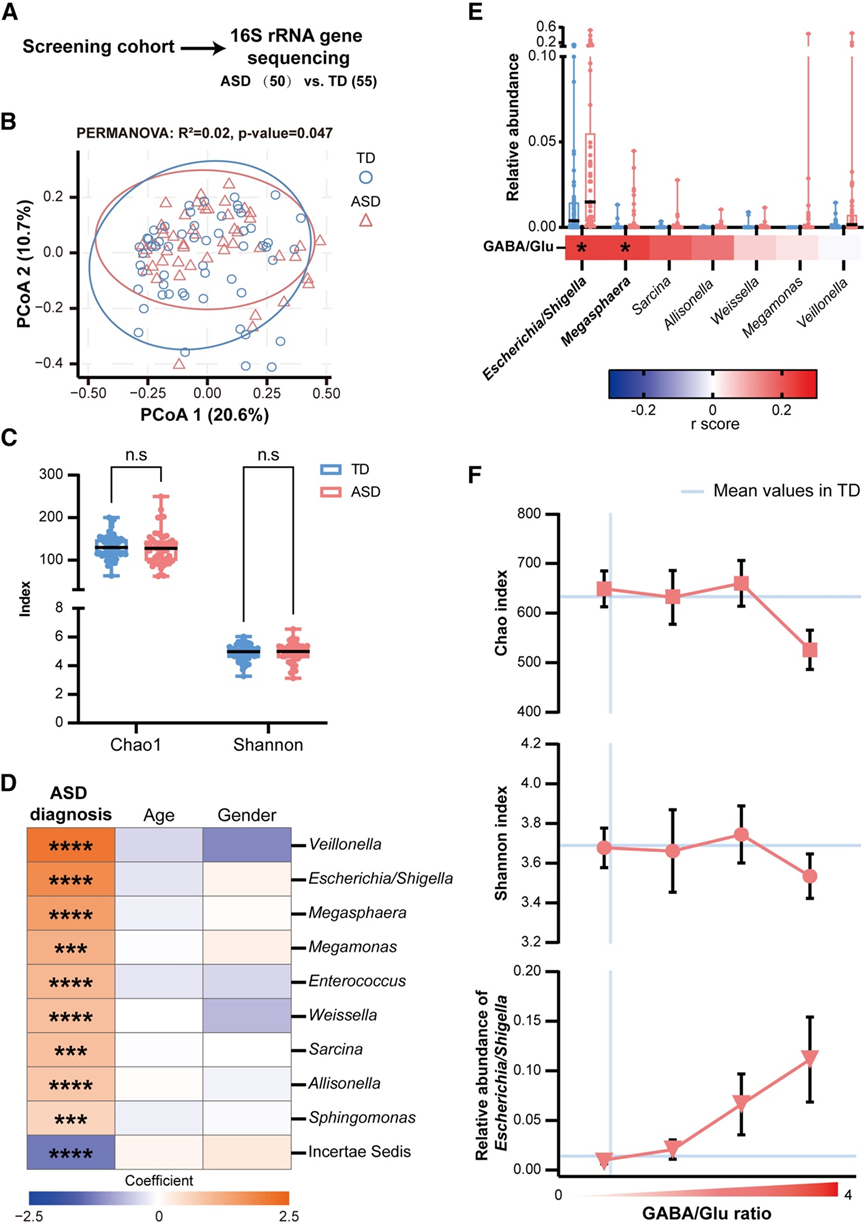
图3. GABA/Glu 比率升高与 ASD 中 GM 结构失调改变相关。
(A) 工作流程描绘了用于 16S rRNA 测序的筛选队列样本。(B) 基于微生物 β 多样性的 PCoA 图,显示了 ASD 组和 TD 组之间肠道微生物成分的显著差异。(C) 微生物 α 多样性分析表明 ASD 组和 TD组之间的 Chao 指数和 Shannon 指数相当。(D) MaAsLin2 分析在调整年龄和性别后确定了 10 个与 ASD 诊断显著相关的 GM 属。(E) 箱线图描绘了与 GABA/Glu 比率相关的属的相对丰度(上)。热图显示 GM 属与 GABA/Glu 比率之间的 Pearson 相关性(r 分数)(下)。(F) 根据 GABA/Glu 比率分类的自闭症患者的Chao 和 Shannon 指数以及大肠杆菌/志贺氏菌的相对丰度。
04
GABA 代谢失衡与 ASD 中 GM 群落整体功能低下有关
为了阐明与 GABA 代谢失衡相关的 GM 菌群失调的分子机制,他们对粪便样本进行了宏基因组分析和相关的定量聚合酶链式反应 (qPCR) 验证(图 4 A)。他们从筛选队列中选择了 7 名 GABA/Glu 比率相对较高的 ASD 受试者(hASD,平均 GABA/Glu = 1.172 ± 0.523)和 8 名年龄和性别匹配的 TD 受试者(GABA/Glu 比率接近基线正常)(nTD,平均 GABA/Glu = −0.437 ± 0.697)。从这些参与者中采集了第三轮粪便样本,这些参与者均为男性,年龄在 3 至 5 岁之间(图 4 A)。
随后,他们比较了两组 GM 的结构和功能特征。细菌分类分析证实了明显的结构改变(图 4B),同时与神经正常的同龄人相比,hASD 儿童的 GM 丰富度和多样性均显著下降(图 4C)。令人惊讶的是,KEGG通路分析显示,与细胞代谢和体内平衡相关的多种分子通路丰度显著降低。具体来说,这些信号类别包括蛋白质加工、寿命调控、三羧酸 (TCA) 循环以及谷氨酸、天冬氨酸、丙氨酸和组氨酸的代谢(图 4D)。能量和氨基酸代谢、蛋白质稳态、存活和生长的这些中断表明 hASD 中 GM 的生存能力受损。
鉴于 GM 处于动态环境中,具有各种细胞外应激源,如氧化应激,这些压力源会影响微生物活力和群落结构,他们比较了两组之间几种应激反应基因的丰度。这些分析显示,hASD组中gor、gpx、sod1和katG等基因的丰度显著增加。这些基因编码参与解毒超氧化物和过氧化氢的酶,这是在细胞外应激条件下触发的关键细胞内过程。应激反应基因表达的增加表明 GM 中氧化应激超载,可能反映了肠道环境受损。为了进一步研究这些应激相关变化与 GABA 代谢之间的联系,他们对 GABA/Glu 比率和应激反应基因丰度进行了 Pearson 相关性分析。值得注意的是,观察到应激反应基因与 GABA/Glu 比率之间存在显著的相关性,这表明异常的 GABA 代谢可能表明 GM 群落存在应激且功能失调。
在已鉴定的 ASD 相关途径中,谷氨酸、天冬氨酸和丙氨酸代谢类别包括一系列参与 GABA 代谢调节的酶编码基因,例如用于 GABA 降解的gabT(GABA 氨基转移酶)和gabD(琥珀酸半醛脱氢酶),以及分别用于合成谷氨酸和谷氨酰胺的gltD(谷氨酸合酶)和purF(酰胺磷酸核糖基转移酶)。为了进一步揭示 ASD 关联的 GM 中 GABA 代谢失衡的分子基础,他们分析了这些基因的丰度(图 4 E)。与 nTD 相比,hASD 中gabT和gabD显著增加,而gltD和purF显著下降。鉴于gabT和gabD的转录在微生物(如大肠杆菌和芽孢杆菌)中依赖于 GABA,这些结果表明,充足的微生物 GABA 供应可确保 ASD 患者 GM 群落中 GABA 的消耗。此外,参与谷氨酸、天冬氨酸和丙氨酸代谢相互作用的其他基因,包括aspB、argG、asdA和ala,在 hASD 中持续下降。此外,Pearson 相关性分析显示,在调整年龄和性别后,大多数上述基因与 GABA/Glu 比率显著相关(图 4 E)。这些分子水平的结果与代谢组学发现的 GABA/Glu 比率增加一致,证实了 ASD 患者的微生物 GABA 代谢受到了干扰。
为了更好地了解大肠杆菌在 GABA 代谢中的作用,他们将宏基因组学数据与毒力因子数据库进行了映射,该数据库包括已知的参与宿主肠上皮定植、微生物-宿主通讯和相互反应的细菌因子。他们确定了一组 21 种可用的大肠杆菌特异性粘附素进行分析,这些粘附素已知可促进细菌在肠上皮的定植。通过比较 hASD 组和 nTD 组之间这些粘附素的丰度,他们发现 7 种分子,例如 P 菌毛、S 菌毛和 F1C 菌毛,在 hASD 组中显著增加(图 4 E)。值得注意的是,在调整年龄和性别后,每种分子的丰度都与 GABA/Glu 比率显著相关(图 4 E),这意味着微生物 GABA/Glu 比率受大肠杆菌种群定植状态的影响。其余粘附素的丰度呈上升趋势,但统计学上并不显著。
为了建立潜在的大肠杆菌-GABA 轴,他们分析了大肠杆菌和志贺氏菌属的相对丰度,这两个属无法通过 16S rRNA 基因测序单独区分。hASD患者的大肠杆菌丰度始终高于 nTD 对照组,而志贺氏菌的相对丰度在这两组中仍然很低(图 4 F)。为了证实大肠杆菌可能有助于 GABA 的产生,他们通过 qPCR 检查了参与微生物 GABA 产生途径的关键酶,重点关注属特异性的谷氨酸脱羧酶 (GAD) 基因gadA和gadB。这两个基因在大肠杆菌中的丰度均显著增加(图 4 G)。综上所述,这些发现表明,大肠杆菌的过度表达可能通过gad基因导致 GABA 过量,从而导致 ASD 儿童的 GABA/Glu 比率升高。
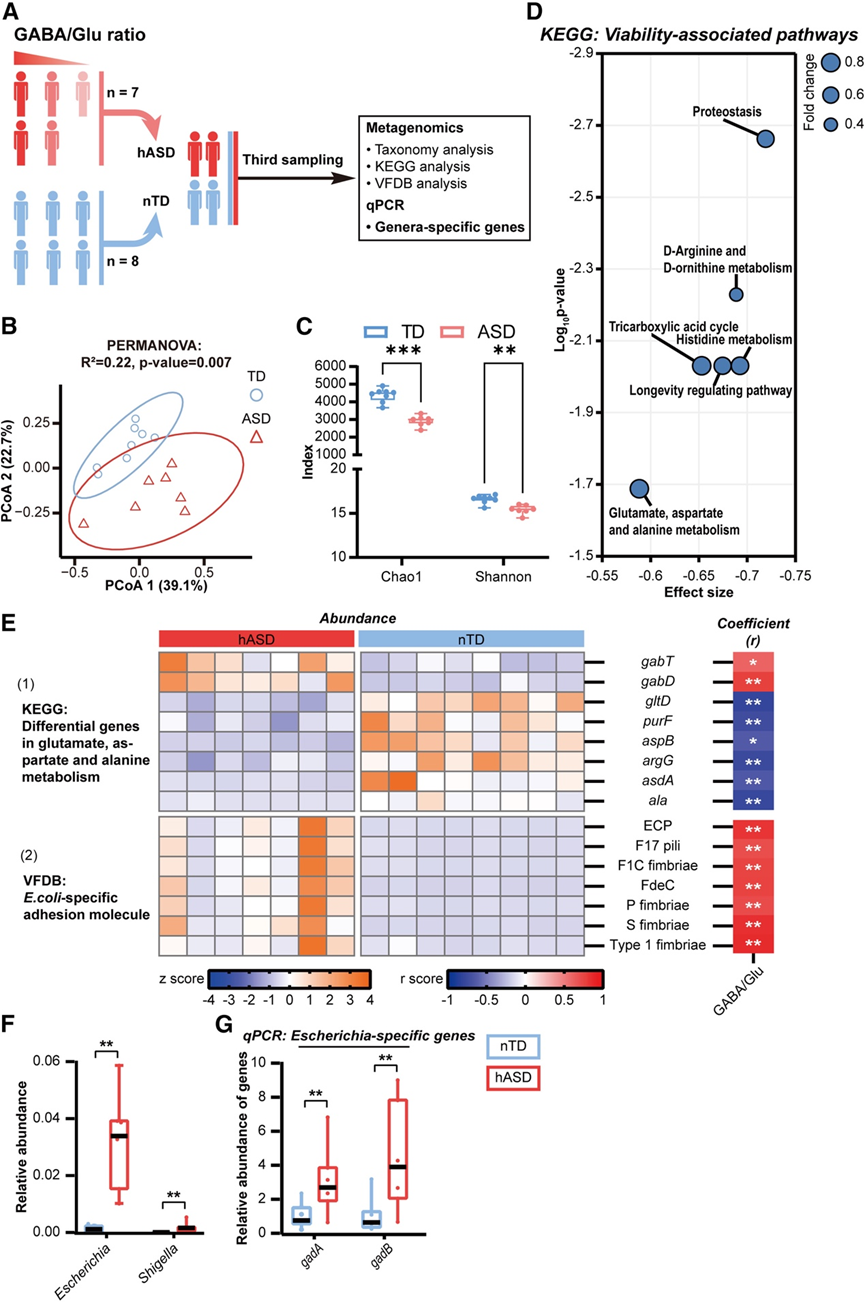
图4. GABA/Glu 失衡与 ASD 中GABA 过量产生和大肠杆菌过度生长有关。
(A)实验方案。(B-C) 与 nTD 组相比,hASD 组显示明显的 GM 结构并且Chao 指数和 Shannon 指数显著下降。(D) KEGG 分析显示,与 nTD 组相比,hASD组中多种与活力相关的通路的丰度显著下降。(E) (1) 通过 KEGG 分析确定的 GABA 代谢相关基因及其与 GABA/Glu 比率的关联;(2)通过 VFDB 分析确定的大肠杆菌特异性粘附素及其与 GABA/Glu 比率的关联。(F) 与 nTD 组相比,hASD 组中的大肠杆菌和志贺氏菌含量较高。(G) qPCR 结果表明,与 nTD 组相比,hASD 组中大肠杆菌特异性gadA和gadB基因丰度显著增加。
05
大肠杆菌细菌攻击导致小鼠出现社交障碍,与 GABA 代谢改变有关
为了阐明 GM 菌群失调(以大肠杆菌过度表达为特征)对宿主行为的影响,他们对雄性 C57BL6/J 小鼠进行了大肠杆菌攻击实验。为了研究大肠杆菌在体外产生 GABA 的能力,他们首先测试了一种商业无致病性大肠杆菌菌株从谷氨酸产生 GABA 的能力。他们对大肠杆菌菌株进行了基因改造,以敲除gadA、gadB或两个基因(图 5 A)。随后,他们使用 GABA 检测试剂盒测量了野生型和敲除菌株的 GABA 水平。结果显示,与野生型菌株相比,敲除菌株的 GABA 水平显著降低(图 5 B),证实了大肠杆菌依赖gad产生 GABA。
在随后的体内实验中,从出生后第21天至第25天(P21-P25)给模型灌胃野生型大肠杆菌,以模拟学龄前儿童大肠杆菌过度生长的情况(图5C)。经过7天的定植期后,粪便微生物组DNA的qPCR显示,大肠杆菌的丰度(图5D)和大肠杆菌特异性gad基因的丰度(图5E)在大肠杆菌攻击后显著增加。此外,三室测试(图 5 F)显示,大肠杆菌攻击组小鼠的社交偏好正常(图 5 G),但社交认知明显不足(图 5 H),表明大肠杆菌移植导致社交活动大幅减少,支持这一观点的后续社交互动测试(图 5 I)表明,大肠杆菌攻击组小鼠与陌生小鼠互动的时间显著减少(图 5 J)。
在旷场测试中(图 5 K),两组的梳理时间相当(图 5 L),表明大肠杆菌攻击组小鼠没有重复行为。比较在中心花费的时间(图 5 M)、行进距离(图 5 N)和平均速度(图 5 O),表明两组之间没有显著差异。这些研究结果表明大肠杆菌在调节社会行为方面具有特殊的作用,与焦虑、识别记忆异常或运动活动改变无关。
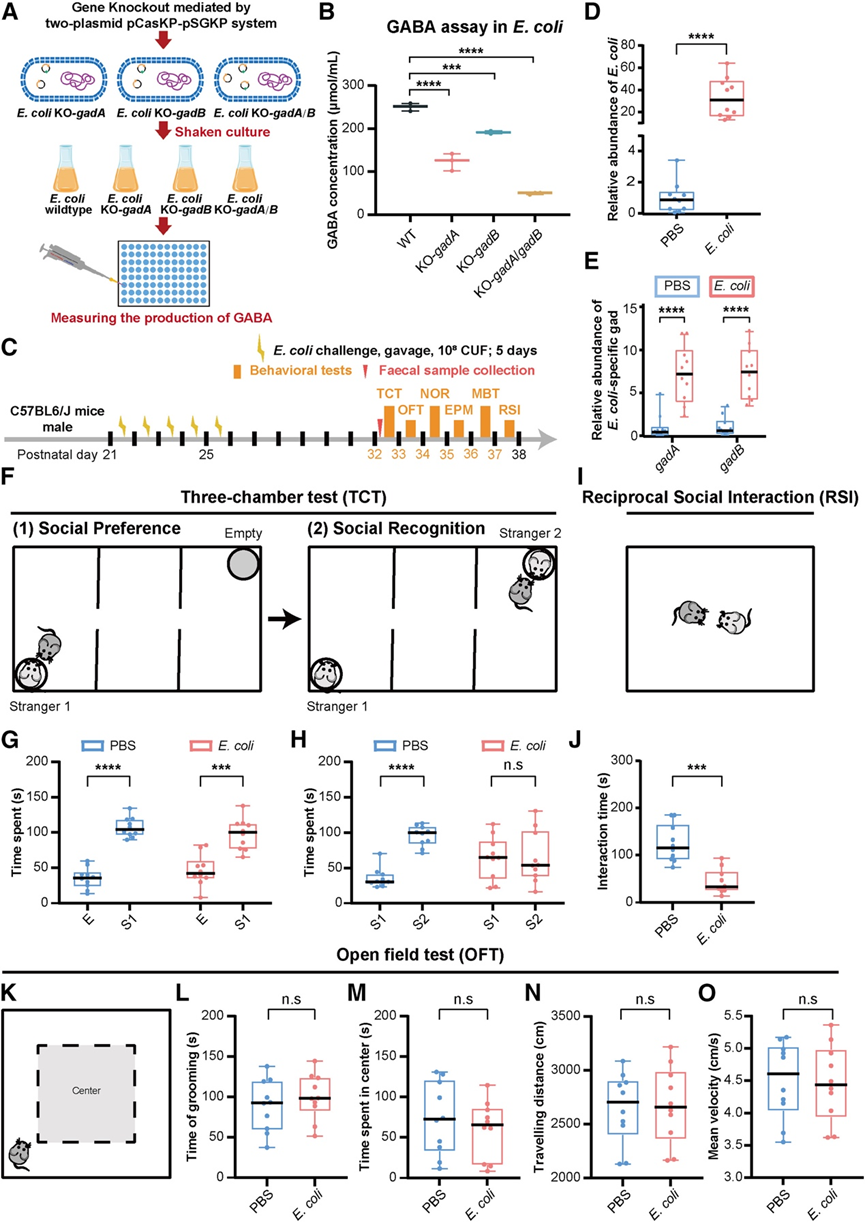
图5. 肠道大肠杆菌的挑战导致小鼠社交缺陷。
(A) 体外试验的实验工作流程:大肠杆菌的基因改造和 GABA 定量。(B) 大肠杆菌菌株培养基中 GABA 水平的比较分析。(C) 体内实验方案:给小鼠施用野生型大肠杆菌菌株,然后进行一系列行为评估。(D-E)与 PBS 组相比,大肠杆菌攻击组的 (D) 肠道大肠杆菌和 (E)大肠杆菌特异性gad的相对丰度显著增加。(F) 三室试验(TCT)图。(G-H) 受到大肠杆菌攻击的组表现出正常的社交偏好和社会认知缺陷。(I) 相互社会互动(RSI)图表。(J) 与 PBS 组相比,大肠杆菌处理的组嗅探陌生老鼠的时间明显减少。(K) 旷场测试(OFT) 图。(L-O) 接受大肠杆菌攻击的组表现出与 PBS 组相当的梳理时间、在中心花费的时间、行进距离和平均速度。
+ + + + + + + + + + +
结 论
本文表明,遗传变异、年龄、性别和体重指数显著影响这种变异。本研究使用基于质谱的简化和高度定量的蛋白质组学工作流程,分析了 2147 名儿童和青少年的血浆,鉴定了 1216 种蛋白质。值得注意的是,其中 70% 的水平与上述至少一个因素有关,蛋白质水平也具有预测作用。QTL调控至少三分之一的蛋白质;从几个百分点到高达 30 倍,这表明遗传因素对血浆蛋白水平有显著影响,从儿童期一直持续到成年期。通过孟德尔随机化和共定位分析,本研究确定了 33 种心脏代谢特征的 41 个致病基因,强调了蛋白质 QTL 在药物靶标识别和疾病理解中的价值。
+ + + + +



 English
English


