文献解读|Nat Aging(17.0):肌肉减少症的多组学分析确定支链氨基酸分解代谢中断是致病机制和治疗靶标
✦ +
+
论文ID
原名:Multi-omic profiling of sarcopenia identifies disrupted branched-chain amino acid catabolism as a causal mechanism and therapeutic target
译名:肌肉减少症的多组学分析确定支链氨基酸分解代谢中断是致病机制和治疗靶标
期刊:Nature Aging
影响因子:17.0
发表时间:2025.02.05
DOI号:10.1038/s43587-024-00797-8
背 景
骨骼肌是体内最丰富的组织,约占身体总质量的40%。肌肉质量和力量在青年时期达到顶峰,在50岁左右下降,肌肉质量每十年下降15-30%,肌肉力量下降更为明显。肌肉减少症的特征是肌肉质量和功能的逐渐丧失,导致老年人身体虚弱、功能下降和死亡率增加。其潜在的机制是复杂的,涉及炎症、缺乏运动、蛋白质合成受损、胰岛素抵抗、线粒体功能障碍和内分泌变化。导致身体残疾和丧失独立能力,给个人、社会和经济带来沉重负担。然而,肌肉减少症的病理生理机制仍然不完全清楚,也没有批准的治疗方法。
实验设计
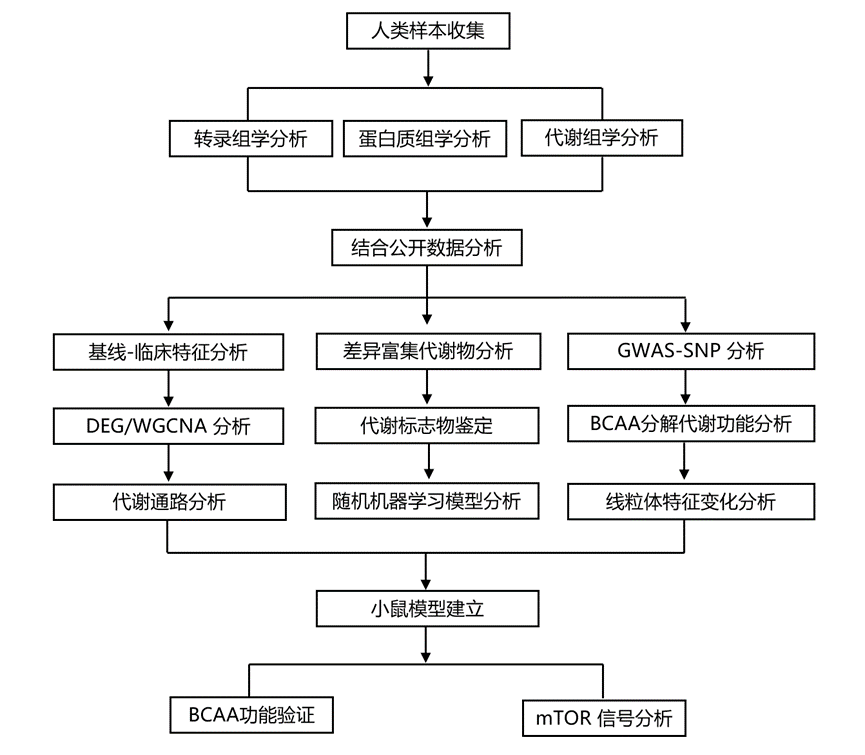
结 果
01
S患者不同于PS和HA参与者
研究团队在四川大学华西医院招募了60名年龄匹配和性别匹配的参与者,其中20名诊断为肌肉减少症(S), 20名可能患有肌肉减少症(PS),20名健康老年人(HA)对照(图1a)。肌肉功能低,肌肉质量正常,肌肉力量和肌肉质量均低时诊断为S。收集股外侧肌样本,他们进行多组学分析(转录组学、代谢组学和蛋白质组学),剖析肌肉减少症的分子基础(图1a)。然后,他们使用来自西藏省华西医院成都分院的20个S和20个HA对照以及实验小鼠模型验证了实多组学数据。
这三个组的参与者在基线特征和生化特征上相似,除了S组血浆白蛋白水平明显低于HA组。S组的身体质量指数(BMI)、骨骼肌指数(SMI)、第三腰椎(L3)的SMI、上臂围和小腿围明显低于HA和PS组,HA和PS组之间无显著差异。在三个阶段中,握力和步态速度逐渐降低,虚弱指数逐渐升高。采用小麦胚芽凝集素(WGA)染色法检测股外侧肌肌纤维。平均横截面积(CSA)随着肌肉减少症的进展而下降(图1b), II型肌纤维的比例也逐渐下降(图1c)。为了评估不同阶段肌肉减少症参与者之间的差异,他们使用三元图和欧几里得距离。从图中可以看出,PS和HA患者之间存在一些重叠,但S患者与两组之间存在明显差异(图1d)。基于握力、SMI、小腿围和步态速度等关键临床指标的欧氏距离计算显示,S组受试者与PS组(32%)和HA组(44%)差异显著,而HA组与PS组差异较小(17%)(图1e)。此外,肌肉减少症的进展与各种特征呈负相关,包括重度精神障碍、肌肉质量和肌肉力量(图1f)。这些结果表征了肌肉减少症从HA到PS,最后到S的进展。
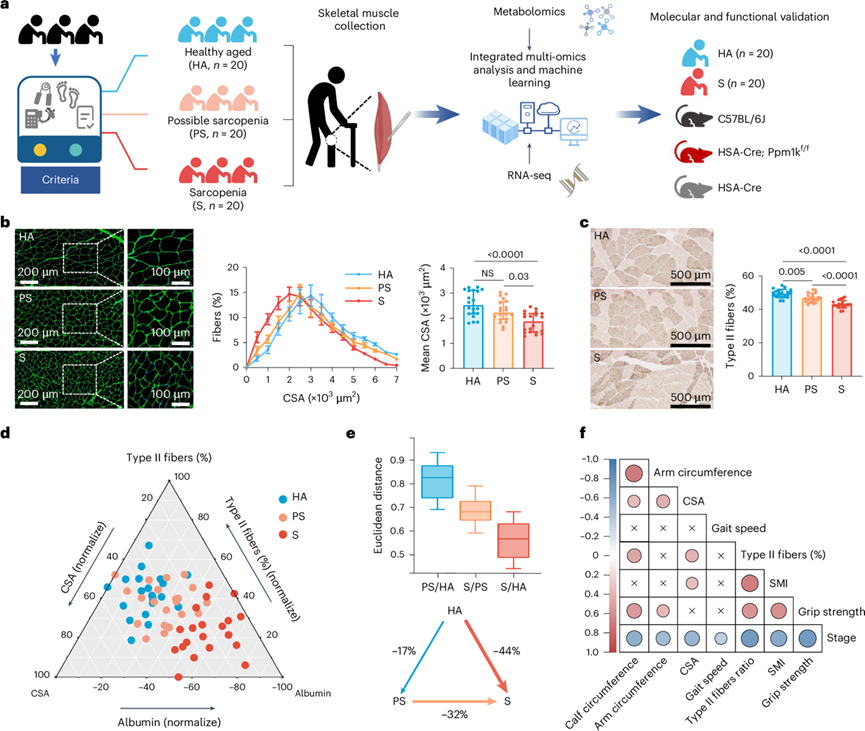
图1. S 阶段与 HA 和 PS 阶段不同。
(a) 实验设计工作流程概述。(b) HA、PS 和 S 参与者的代表性 WGA 染色、骨骼肌 CSA 分布和骨骼肌平均 CSA。(c) HA、PS 和 S 参与者的骨骼肌中 ATPase 染色和 II 型纤维比率[II 型纤维 (%)]的代表性图像。(d) 三元图显示基于 II 型纤维 (%)、CSA 平均值和血清白蛋白浓度的 HA、PS 和 S组的 空间分布。(e) HA、PS 和 S 组之间的整体差异。(f) 临床表型之间的线性关系。
02
代谢的转录变化标志着肌肉减少症
为了解剖肌肉减少症的分子基础,他们收集了参与者的股外侧肌活检,并进行了高覆盖率的转录组分析(RNA-seq)。他们在HA, PS和S参与者中鉴定出453个差异表达基因(DEG)(图2a,图S1a)。在S和HA之间共鉴定出320个DEG(198个上调,122个下调),S和PS之间鉴定出142个DEG(88个上调,54个下调),PS和HA之间仅鉴定出71个deg(14个上调,57个下调),表明S参与者在转录上不同于HA和PS组(图S1a)。大多数deg与疾病轨迹呈线性相关(图S1b),其中69.5%与代谢有关(图2a)。KEGG、GO分析和Reactome数据库分析表明,S/PS、S/HA和PS/HA基因中变化最大的代谢相关基因(图2b,图S1c)。总之,肌肉减少症与显著的代谢变化有关。
接下来,他们分析了所有代谢基因(2111个基因),以比较这些参与者的代谢特征(图S1d)。主成分分析(PCA)和欧几里得距离分析证实了HA和PS组之间具有很强的相似性,表明了密切的转录谱(图2d-e)。相比之下,与HA和PS样品相比,S样品表现出不同的代谢基因表达模式(图2d-e)。然而,所有基因的PCA在三个阶段之间没有明显的分离(图S1e)。加权基因共表达网络分析(WGCNA)鉴定出9个模块(图2f,图S1f),其中黑色、棕色和绿色模块与HA组呈正相关,与S组呈负相关(图2f)。对这些模块进行KEGG分析发现,在氧化磷酸化、支链氨基酸(BCAA)分解代谢、糖酵解、TCA循环、脂肪酸代谢和丙酮酸代谢等代谢途径中都有富集,这表明HA和S样品在这些途径上存在显著差异(图2g)。
他们根据HA、PS和S组基因的表达模式,应用mFuzz对所有基因进行聚类,并鉴定出5个聚类(图S1g)。与HA对照组相比,聚类1的基因在PS患者中下调,在S患者中进一步下调,表明与肌肉功能障碍严重程度呈负相关(图S1g)。聚类2和聚类4分别包含在PS患者中下调和上调的基因,提示肌肉减少症的早期变化(图S1g)。聚类3基因从HA到PS略有增加,随后在S组减少,提示在早期肌肉减少症中有潜在的代偿作用。聚类5基因在PS中保持不变,但在S中上调,表明S组中发生了特异性变化(图S1g)。KEGG分析显示,聚类1基因主要富集于氧化磷酸化、脂质代谢和BCAA分解代谢;聚类2基因在糖酵解和TCA循环中富集;聚类3基因与BCAA分解代谢、TCA循环和脂肪酸代谢相关(图2h)。与此一致的是,对这些聚类的GO分析进一步证实了肌肉无力、线粒体功能障碍和骨骼肌大小异常的基因富集。通路分析强调代谢是肌肉减少症最突出的分子特征,与先前的研究一致,表明肌肉减少症中线粒体氧化能力的改变。相比之下,聚类4和聚类5中的基因主要富集于炎症、MAPK信号通路、PI3K通路和细胞衰老(图S1i)。在肌肉减少症的进展过程中,参与这些代谢通路的大多数基因发生下调。
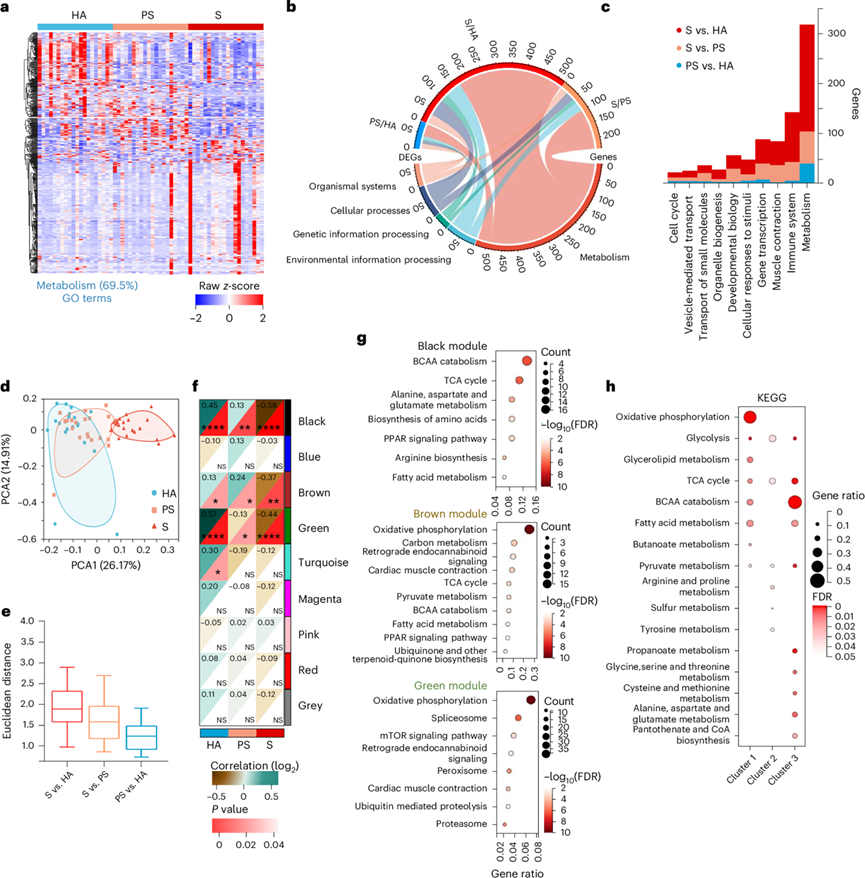
图2. 代谢改变是肌肉减少症的转录标志。
(a) 热图展示了HA、PS和S患者中的453个DEG。(b) 通路富集分析。(c)GO分析。(d) HA、PS和S组代谢基因的PCA图。(e) PS/HA(蓝色)、S/PS(橙色)和S/HA(红色)的欧氏表达距离。(f) 热图表示选定的9个模块与不同阶段之间的相关性。(g) 黑色、棕色和绿色模块的KEGG通路富集分析。(h) KEGG通路富集分析。
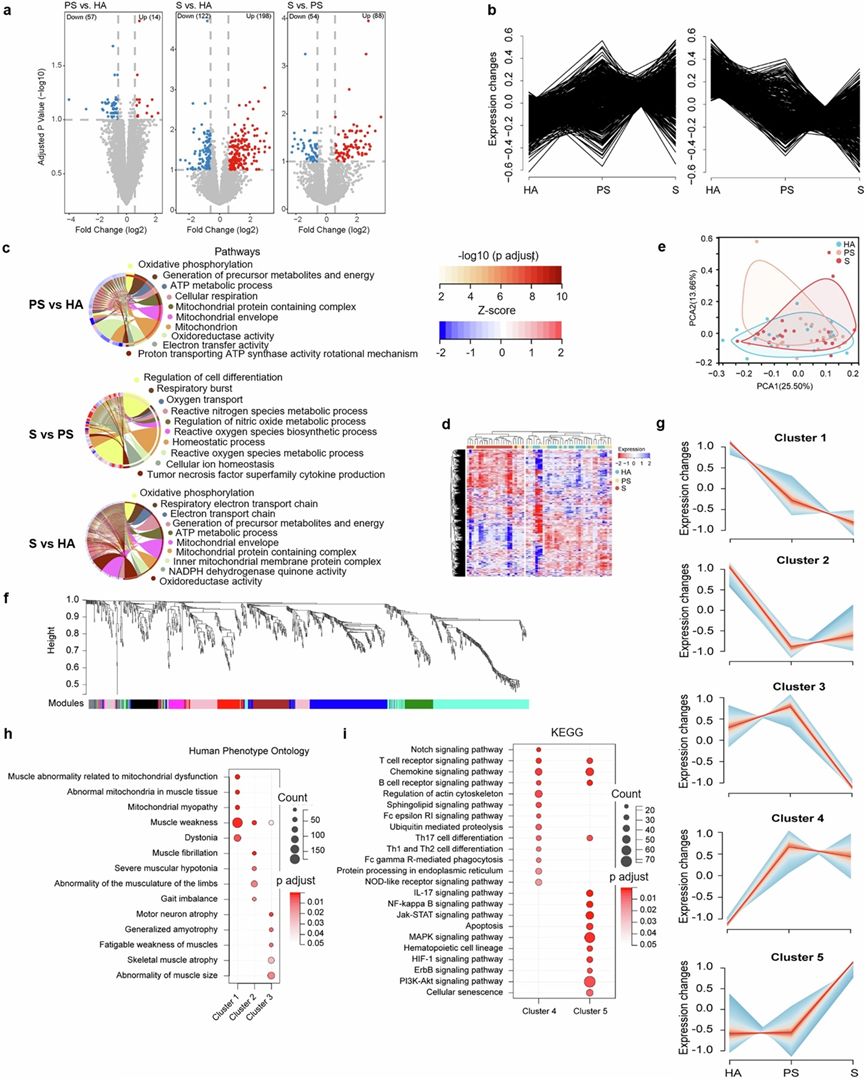
图S1. HA、PS 和 S 之间的转录差异。
(a) PS/HA、S/PS 和 PS/HA 中 DEG 的火山图。(b) DEG 与疾病严重程度呈线性相关。(c)GO分析。(d) 热图显示使用完全链接的HA、PS 和 S 组中代谢基因的双向层次聚类。(e) HA、PS 和 S组所有基因的 PCA 图。(f) 加权基因共表达网络分析(WGCNA)树状图表明三组中9个不同的共表达模块的表达。(g) mFuzz将三个阶段的基因表达模式分为五个聚类,包括三个向下模式的聚类(聚类1、2和3)和两个向上模式的聚类(聚类4和5)。(h-i) 对聚类1、2和3中的基因进行通路富集分析。
03
与转录组一致来验证代谢
为了验证肌肉减少症的代谢改变,他们进行了非靶向质谱分析,检测到1500种代谢物,包括脂质、有机酸和衍生物。偏最小二乘判别分析(PLS-DA)证实HA、PS和S组之间存在明显的分离(图3a-b)。与疾病进展一致,S组的代谢谱与HA和PS组的代谢谱显著不同(图3a-b)。他们鉴定了308个差异富集代谢物(DAM),通路富集分析显示,在肌肉减少症中,氨基酸(包括BCAA)代谢和脂肪酸代谢是变化最显著的通路(图3c)。45种代谢物的层次聚类显示,S组与HA/PS组之间存在显著差异(图3d)。进一步的差异代谢物分析发现,HA和PS之间有239个DAM,HA和S之间有289个DAM,PS和S之间有65个DAM。代谢物集富集分析证实各组间代谢物差异一致,主要涉及糖酵解、脂肪酸代谢、BCAA分解代谢、TCA循环和丙酮酸代谢(图3e)。这些发现表明在肌肉减少症中存在显著的代谢紊乱。
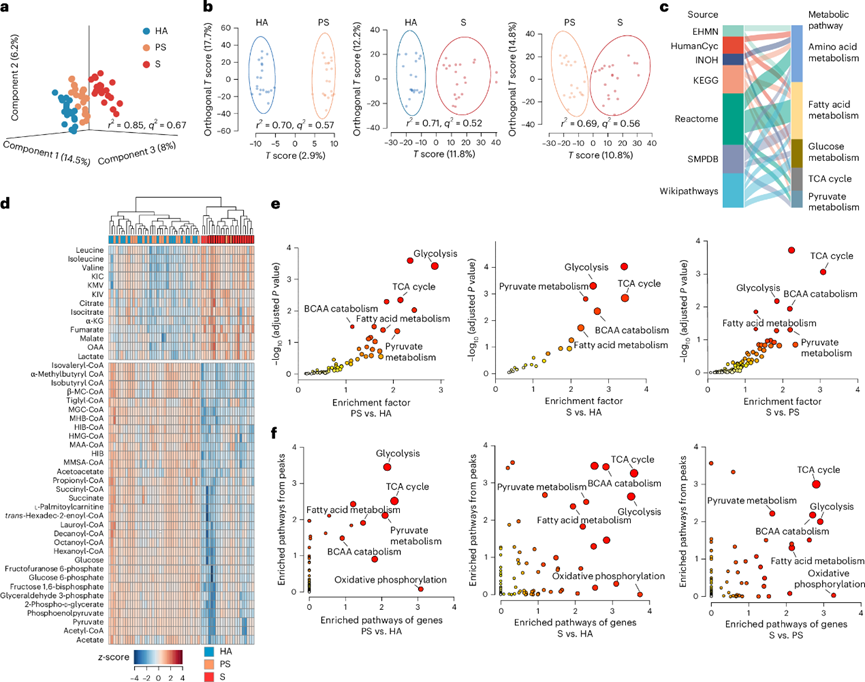
图3. 肌肉减少症的代谢特征与转录组一致。
(a) PLS-DA显示不同阶段(HA、PS和S)代谢物组之间分离良好。(b) 正交PLS -DA多元分析显示三个阶段代谢特征的差异。(c) 基于七个数据库的308个DAM代谢通路富集分析。(d) 基于完全链接双向层次聚类的HA、PS和S组中参与调控代谢通路的45种代谢物热图。(e) 代谢物集富集分析(MSEA)。(f) 使用 MetaboAnalyst 对 HA、PS 和 S 中的差异代谢物和 DEG 进行联合通路分析。
接下来,综合转录组学和代谢组学分析揭示了肌肉减少症进展过程中BCAA分解代谢、TCA循环、脂肪酸降解、糖酵解和丙酮酸代谢的显著变化(图3f)。肌肉减少症患者骨骼肌中参与BCAA分解代谢的关键酶BCAT2和BCKDHB水平显著降低,导致BCAA和BCKA显著积累(图4a)。此外,糖酵解和脂肪酸β-氧化的下游代谢物和酶也减少(图4a)。这伴随着TCA循环中酶的减少,导致线粒体氧化代谢的全面下降和肌肉减少症的代谢功能障碍,基因的破坏进一步证明了线粒体功能障碍。
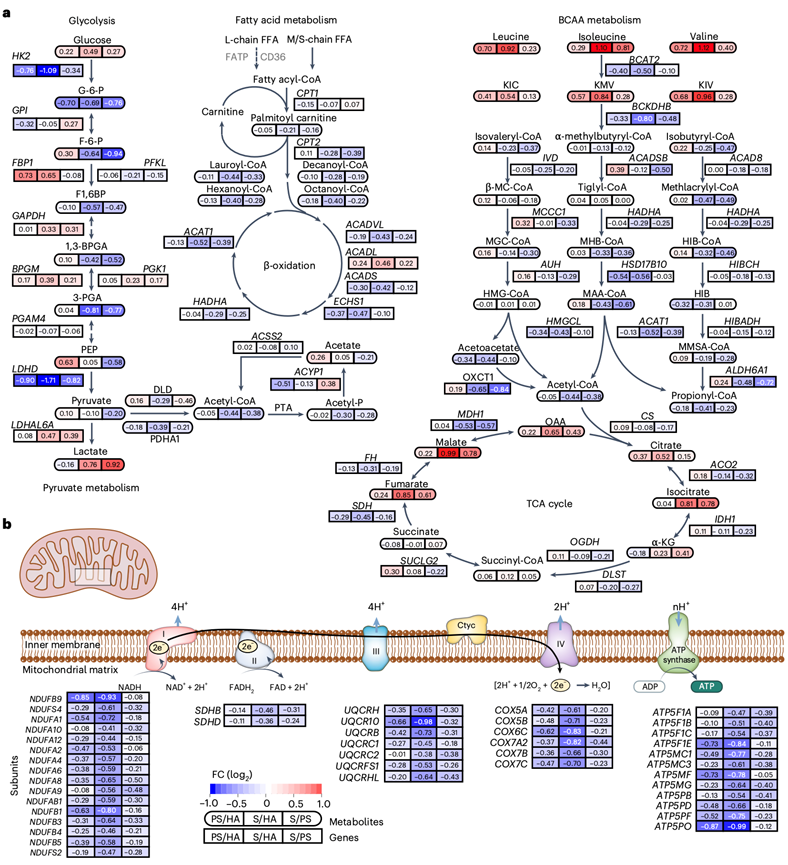
图4. 多组学分析揭示了肌肉减少症的代谢和能量供应中断。
(a) 结合转录组和代谢组的综合网络分析显示了三个阶段的整体代谢变化。(b) 与 a相同的线粒体电子传递链(ETC)。ETC 中的复合物(上)的示意图和编码 ETC 亚基的基因的 mRNA 表达(下)。
04
BCAA分解代谢功能障碍可能导致肌肉减少症
为了避免环境干扰,他们使用60名参与者和另外60名来自GEO研究(GSE111006、GSE111010和GSE111016)的参与者的转录组学数据训练了一个随机机器学习模型。外部数据的基因集富集分析(GSEA)证实了基因与肌肉减少症之间的关联。随机森林分析显示,当决策树数量约为500时,错误率稳定。随机森林分类器的曲线下面积(AUC)值为81.7%,表明机器学习模型是可靠的。通过随机森林分析,他们确定了36个最有可能影响肌肉减少症的基因(图5a)。36个基因的基因网络分析表明,这些基因具有很强的生物学相互作用,表明这些基因具有生物学相关性。此外,KEGG通路富集分析显示,这些基因在BCAA分解代谢和脂肪酸代谢中显著富集(图5b)。
在涉及681301个个体的全基因组关联分析研究(GWAS)中,他们发现428个全基因组单核苷酸多态性(SNP)与瘦体重(lean mass)显著相关。在这些SNP中,167个鉴定为先导SNP。进一步发现,与非肌肉减少症相比,在肌肉减少症中鉴定的167个snp和734个DEG之间有13个基因重叠(图5c)。值得注意的是,在这些基因中,有11个与代谢相关,其中包括5个与BCAA代谢相关的基因。随后的分析显示,在这些主要snp中,有6个位点(rs7767703、rs12209419、rs9443745、rs3792994、rs4801776和rs71352704)与瘦体重呈负相关(图5d)。这些发现表明BCAA代谢对肌肉生理有重要影响。此外,这6个snp也显示出与其他肌肉相关特征的显著相关性(P < 0.0001),如全身无脂质量、握力、步行速度、BCAA浓度和胆固醇。
为了全面分析肌肉减少症的分子相互作用,他们整合了主要snp、随机森林分析中的前50个mrna和代谢组学中所有差异富集的代谢物(图5e)。他们进行了OmicsNet分析,发现BCAA分解代谢是最显著富集的通路(图5f)。此外,还证明了snp的基因组数据、BCKDHB和BCAT2的mRNA表达水平和代谢物谱之间存在直接相关性(图5f)。mRNA表达与差异代谢物谱之间也存在相关性(图4)。值得注意的是,所有三种成分—snp、BCKDHB和BCAT2 mRNA和代谢物—都与肌肉减少症有关。相关分析证实,BCAA分解代谢与肌肉质量和握力呈正相关,表明BCAA分解代谢受损与低肌肉质量和低肌肉力量都有关。基于这些发现,他们推断BCAA分解代谢功能障碍可能驱动肌肉减少症的发展,BCAA分解代谢通路中的BCKDHB和BCAT2基因可能作为治疗肌肉减少症的潜在治疗靶点。
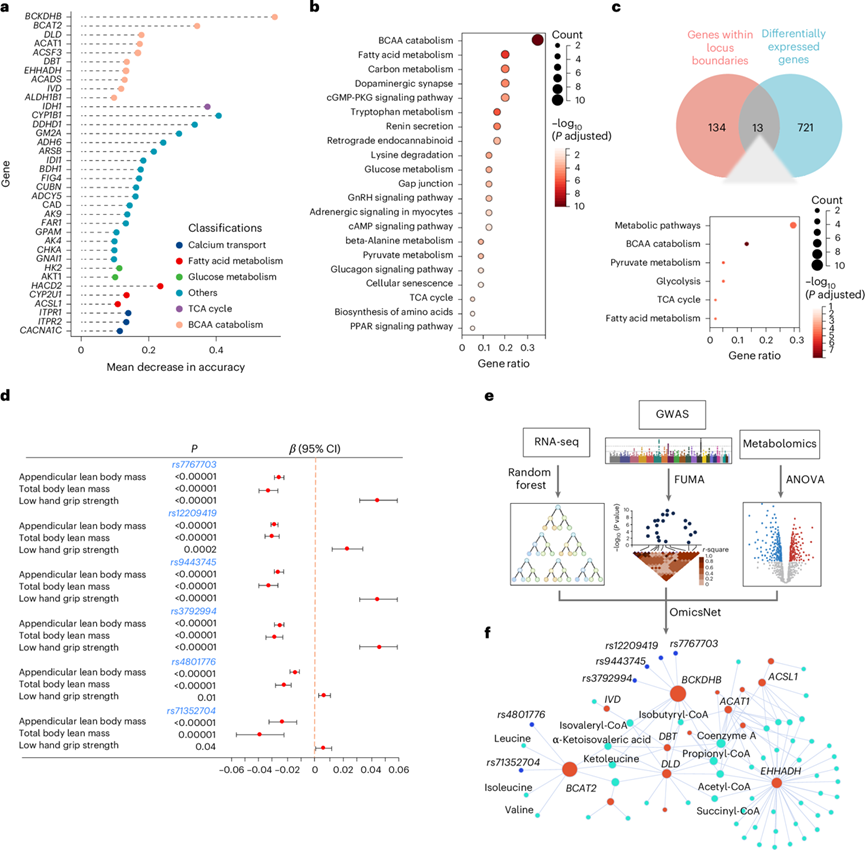
图5. 使用机器学习模型将 BCAA 分解代谢功能障碍与肌肉减少症的临床特征联系起来。
(a) 通过KEGG富集途径对随机森林分析中优先排序的前36个基因进行排序。(b) 36个基因的KEGG通路富集分析。(c) 与基因座边界内重叠基因相关的代谢途径的KEGG聚类分析以及肌肉减少症和非肌肉减少症之间差异表达的mRNA。(d) 通过肌肉骨骼知识门户的 LD 评分回归分析估计的 SNP。(e) 肌肉减少症多层组学网络模块识别的分析流程示意图。(f) BCAA 分解代谢的共表达中心网络。
05
代谢改变通过单独的队列验证
为了证实关于肌肉减少症代谢改变的发现,他们招募了一个由来自不同中心的健康老年对照组(n = 20)和肌肉减少症患者(n = 20)组成的复制队列。与对照组相比,肌肉减少症患者骨骼肌中BCAT2、BCKDHB、PPM1K、BCKDK和DBT的表达显著降低(图6a-b)。此外,这些基因与SMI、握力和纤维呈正相关(图6c)。肌肉减少症患者骨骼肌中BCAA水平升高,而血清中BCAA水平无显著差异,与既往研究一致(图6d)。此外,骨骼肌中BCAA水平与SMI、握力和纤维呈负相关(图6e)。
为了进一步研究肌减少症中BCAA分解代谢的扰动,他们使用结合了定量蛋白质组学和靶向代谢组学数据分析了本研究队列的一个子集(n = 6)。多组学分析一致显示,与对照组相比,肌肉减少症患者参与BCAA分解代谢的酶显著减少(图6f),代谢产物显著升高,证实了肌肉减少症患者的BCAA分解代谢受到干扰。此外,参与脂肪酸代谢的两种线粒体酶CPT1B和HADHB在肌肉减少症肌肉中也下调。肌肉减少症患者己酸和辛酸升高,而脂肪酸酶降低,表明肌肉减少症患者的脂肪酸氧化减少。
此外,他们观察到肌肉减少症中参与葡萄糖代谢和TCA循环的各种酶和代谢物减少,提供了代谢功能受损的证据。与这些发现一致,肌肉减少症患者骨骼肌的线粒体功能和基因表达下降(图6g)。透射电镜证实线粒体超微结构和质量严重破坏;肌肉减少症样本中的线粒体尺寸增大,嵴缩小,提示线粒体完整性丧失(图6h-1)。因此,与HA对照组相比,在肌肉减少症患者中观察到健康线粒体数量显著减少,损伤线粒体数量相应增加(图6h-i)。此外,人体骨骼肌Z线两侧的线粒体数量减少(图6h-i)。与线粒体功能和完整性降低一致,线粒体膜蛋白和mRNA表达的显著降低,进一步证明了线粒体活性受损。
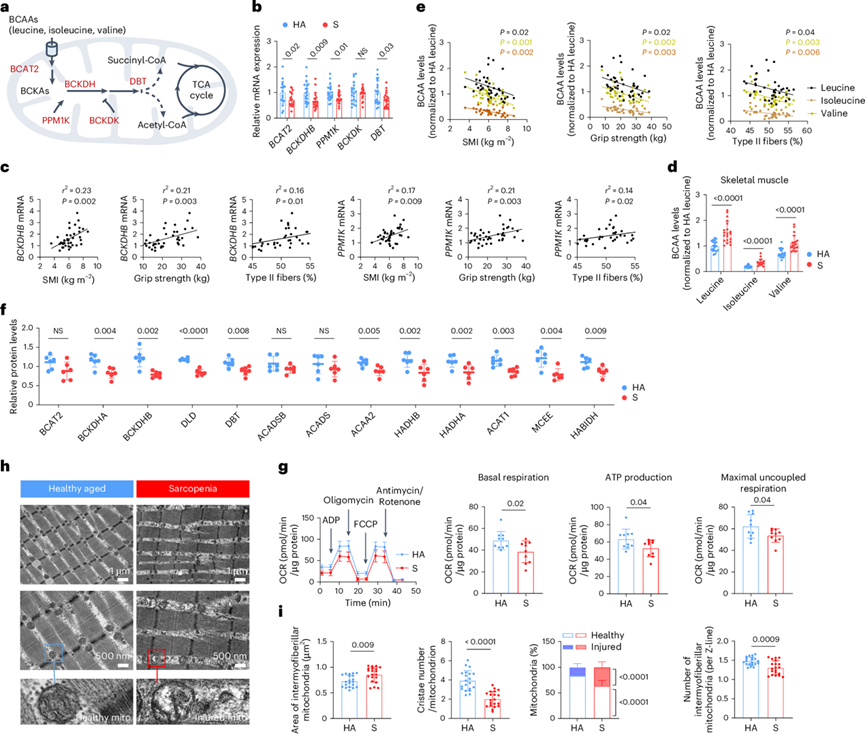
图6. 复制队列的分析证实了肌肉减少症的代谢改变。
(a) BCAA 分解代谢途径中关键酶(红色)和代谢物(黑色)的示意图。(b) HA和 S 患者中所示基因的 mRNA 表达。(c) BCKDHB和PPM1K mRNA 与临床特征的 Pearson 相关性分析。(d) HA 和 S 组骨骼肌中的 BCAA 浓度。(e) 骨骼肌中 BCAA 浓度与临床特征的 Pearson 相关性分析。(f) 通过定量蛋白质组学分析确定参与 BCAA 分解代谢的蛋白质丰度。(g) 对新鲜从HA 和 S 患者中分离的骨骼肌线粒体进行 Seahorse 分析。(h) 代表性透射电子显微镜图像显示 HA 和 S 患者股外侧肌纵切面的肌原纤维间线粒体。(i) 肌原纤维间线粒体平均面积、每个线粒体的平均嵴数、健康和受损线粒体的百分比以及每条纤维Z线的线粒体数量的定量。
06
BCAA分解代谢缺乏会降低肌肉力量和质量
久坐行为会导致小鼠肌肉力量和质量与年龄相关的下降,并伴随着分子和细胞的变化,类似于在肌肉减少症中观察到的变化。为了研究小鼠模型中的肌肉减少症,将8个月大的C57BL/6J小鼠分别进行不运动和正常活动以建立模型,并喂食4个月的鼠粮(CD)和高BCAA饮食(HBD)。不运动小鼠的Bckdhb和Bcat2水平降低,表明BCAA代谢中断。不运动小鼠骨骼肌中的BCAA水平在CD时升高,并在HBD喂养时进一步升高。值得注意的是,CD和HBD对照组小鼠的BCAA水平相似,这表明增加的BCAA可以在正常的BCAA分解代谢的肌肉中有效缓冲。与对照组相比,不运动老鼠表现出肌肉力量、耐力和质量的降低,而HBD喂养进一步降低了这些参数,证实了由于分解代谢缺陷导致的高BCAA积累导致肌肉功能障碍。
为了研究BCAA分解代谢受损对肌肉减少症的影响,他们在C57BL/6J背景下,在人α-骨骼肌动蛋白(HAS)的控制下,建立了骨骼肌特异性Ppm1k敲除(KO)小鼠模型(图7a)。与野生型(WT)对照相比,KO小鼠骨骼肌中BCAA分解代谢的正调节因子Ppm1k显著降低(图7b)。此外,在KO小鼠中,BCKDH-E1αS293的磷酸化水平显著升高(图7b)。8个月大的WT和KO小鼠分别饲喂CD或HBD 4个月(图7a)。饲喂CD的KO小鼠骨骼肌中的BCAA水平升高,并在饲喂HBD后进一步升高(图7c)。KO小鼠的肌肉力量、质量和耐力显著降低,高浓度BCAA喂养进一步降低(图7d-f)。小鼠胫骨前肌(TA)主要由快速收缩(II型)肌纤维组成,KO小鼠肌纤维CSA显著降低,高浓度BCAA喂养后进一步降低(图7g)。一致地,TA肌肉的免疫染色证实KO小鼠的快速收缩肌纤维尺寸减小,纤维空间扩大(图7h)。补充BCAA进一步加重了KO小鼠的肌病(图7h)。此外,与WT相比,KO小鼠中与快肌收缩肌球蛋白相关的基因显著减少,而与慢肌收缩肌球蛋白无关(图7i)。骨骼肌和脂肪组织的相互作用参与了肌肉减少症的发病机制。值得注意的是,KO小鼠的脂肪细胞大小增加。饲喂HBD导致WT和KO脂肪组织中脂肪细胞大小呈增加趋势,表明肌肉中BCAA分解代谢缺陷也影响脂肪形态。总之,这些结果表明,BCAA分解代谢中断有助于小鼠肌肉和脂肪病理。
为了测试促进BCAA分解代谢是否能减轻KO小鼠的肌肉功能障碍,他们用BCKDH激活剂BT2治疗KO小鼠1周(图7j)。BT2处理显著降低KO小鼠骨骼肌BCAA浓度(图7k)。与给药小鼠相比,它还显著增加了握力、耐力、肌肉质量和快肌纤维大小,并减轻了脂肪细胞的增大(图7l-o)。此外,为了验证在自然衰老相关肌肉萎缩中的发现,他们用BT2处理19月龄小鼠1个月(图7p)。老年小鼠显示与BCAA分解代谢相关的基因表达减少。用BT2刺激BCAA分解代谢可显著增加骨骼肌质量和功能,降低肌肉萎缩标志物的表达(图7q-u)。这些结果共同表明,提高BCAA分解代谢可显著改善肌肉质量和功能。
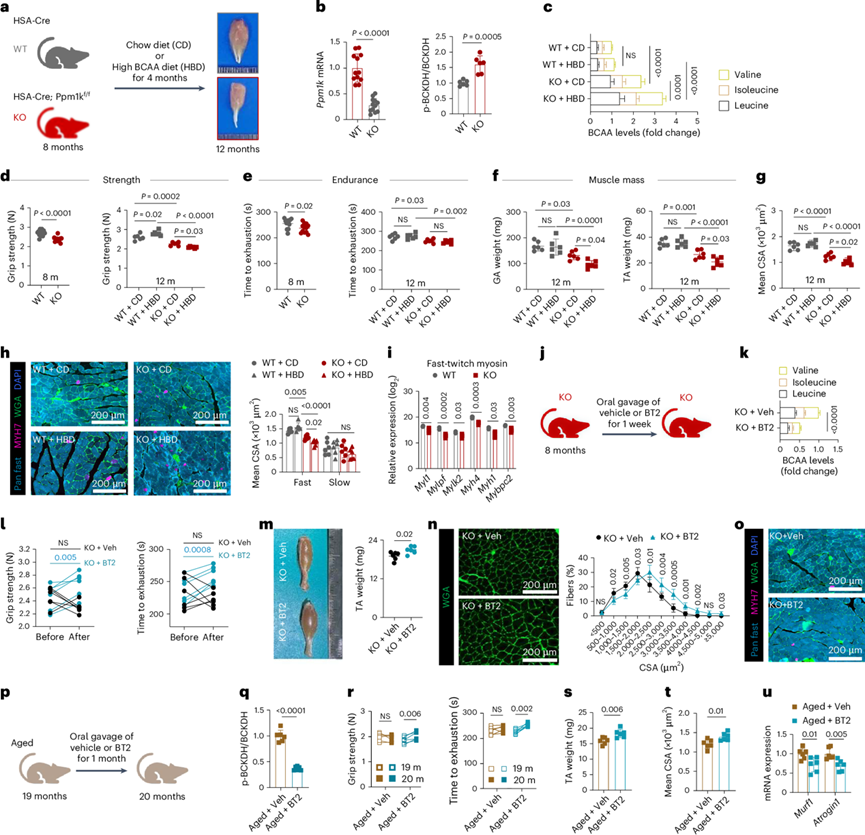
图7. BCAA 分解代谢缺乏会降低肌肉强度和质量。
(a)实验流程图。(b) WT 和 KO 小鼠骨骼肌组织中的Ppm1k mRNA 表达和 BCKDH-E1a 磷酸化。(c) 骨骼肌组织中的 BCAA 浓度。(d-e) WT 和 KO 小鼠在 4 个月 CD 或 HBD 之前和之后的握力和最大运动耐力。(f) GA和TA肌肉重量。(g) 平均 TA 肌纤维 CSA。(h) TA 肌肉图像。(i) 来自转录组的指示基因的相对表达。(j)实验计划。(k) 骨骼肌组织中的 BCAA 浓度。(l) 握力和最大运动耐力。(m) TA 肌肉重量。(n) TA 肌肉的 WGA 染色图像(左)和纤维 CSA 的定量(右)。(o) TA肌肉图像。(p)实验计划。(q) 肌肉组织中的 BCKDH-E1a 磷酸化。(r) 握力和最大运动耐力。(s) TA 肌肉重量。(t) 平均纤维 CSA。(u) Murf1和Atrogin1表达。
07
过量的BCAA通过异常的mTOR信号导致肌肉减少症
失调的mTOR信号是肌少症发生的主要原因。他们假设BCAA分解代谢缺陷可能影响mtor相关信号,从而导致肌肉减少症(图8a)。事实上,WT和KO小鼠骨骼肌样本的RNA-seq分析揭示了几种合成代谢途径的改变,包括mTOR、自噬、胰岛素抵抗、PI3K-Akt和氧化磷酸化(图8b)。此外,在人和小鼠肌肉样本中,BCAA积累激活mTOR,导致S6激酶(p70S6K)和S6磷酸化增加,这是蛋白质合成的关键效应物(图8c-f)。此外,过量BCAA持续激活mTOR也会损害胰岛素敏感性、自噬过程和线粒体功能(图8c-g)。然而,在KO和hbd喂养的小鼠中未观察到全身葡萄糖耐受不良。
有趣的是,KO小鼠表现出肌肉线粒体呼吸的进行性减少,而HBD倾向于加剧线粒体功能的下降。相比之下,肌肉中BCAA水平相似的WT小鼠在CD和HBD下都保持了相似且相对稳定的线粒体功能(图7c)。这些发现表明,过量的BCAA,特别是在BCAA分解代谢受损的情况下,可能对线粒体健康产生有害影响。与在人类参与者中观察到的线粒体变化一致,KO小鼠骨骼肌中z线附近的健康线粒体数量也减少了。此外,肌少症患者和小鼠肌肉中BCAA分解代谢受损导致ATP-柠檬酸裂解酶(ACLY)和下游脂肪生成酶Co-A羧化酶(ACC)活性降低或磷酸化。这种损伤伴随着心磷脂水平下降和线粒体应激指标生长分化因子15 (GDF15)升高。饲喂HBD并没有进一步影响mTOR信号或线粒体变化,这表明过量的BCAA可能已经达到饱和点(图8e-g)。
为了确定BCAA分解代谢功能障碍对肌肉的有害影响是否通过持续的mTOR激活介导,他们用雷帕霉素处理KO小鼠(图8)。雷帕霉素处理1个月显著降低mTOR磷酸化,恢复胰岛素敏感性,改善KO肌肉的自噬功能(图8i-j)。线粒体功能和形态也有显著改善(图8k)。虽然没有减少BCAA积累,但雷帕霉素处理显著增强了肌肉力量、耐力、质量和肌纤维大小,并减少了肌肉萎缩的标志物(图8l-n)。这些结果共同表明,抑制mTOR激活可以对抗bcaa相关的骨骼肌萎缩。此外,用BT2刺激KO小鼠的BCAA分解代谢可导致类似的mtor相关失调逆转(图8o- q)。在补充BT2的老年小鼠中,一致观察到mTOR激活受到抑制,肌肉萎缩减少,线粒体功能和形态改善(图8r-t)。总之,这些发现表明,BCAA分解代谢受损导致BCAA积累和持续的mTOR激活,这反过来又导致mTOR信号失调,最终导致骨骼肌萎缩。因此,增强BCAA分解代谢可能为肌肉减少症的治疗提供了一种有希望的方法。

图8. 过量的 BCAA 通过异常的 mTOR 信号导致肌肉减少症。
(a) 说明由 BCAA 分解代谢调节的 mTOR 信号传导的示意图。(b)通路富集分析。(c-d) 代表性免疫印迹和定量显示来自 HA 和 S 患者的骨骼肌组织中的 mTOR 信号传导。(e-g) 代表性免疫印迹和定量显示来自接受特定处理的 WT 和 KO 小鼠的骨骼肌以及线粒体耗氧率(OCR)中的 mTOR 信号传导。(h)实验示意图。(i-k) 代表性免疫印迹和定量显示用载体或雷帕霉素处理的 KO 小鼠的骨骼肌中的 mTOR 信号传导以及线粒体 OCR。(l) 握力、最大运动耐力和 TA 肌肉重量。(m) 用载体或雷帕霉素处理的 KO 小鼠的 TA 肌纤维 CSA 平均值。(n) Murf1和Atrogin1的相对 mRNA 表达。(o-q) 代表性免疫印迹和定量显示用载体或 BT2 处理的 KO 小鼠的骨骼肌中的 mTOR 信号传导以及线粒体 OCR。(r-t) 代表性免疫印迹和定量显示骨骼肌中的 mTOR 信号传导,以及用载体或 BT2 处理的老年小鼠的线粒体 OCR 。
+ + + + + + + + + + +
结 论
本研究使用多组学方法对肌肉强度受损和肌肉减少症患者的骨骼肌分子和代谢特征进行了全面分析。在发现和复制队列中,发现BCAA分解代谢中断是肌肉减少症的主要途径,导致 BCAA 积累和肌肉健康状况下降。机器学习模型分析进一步支持了 BCAA 分解代谢功能障碍在肌肉减少症中的因果作用。使用小鼠模型验证了 BCAA 分解代谢缺陷会通过失调的 mTOR 信号传导损害肌肉质量和力量,而通过 BT2 增强 BCAA 分解代谢可预防老年小鼠和缺乏Ppm1k(骨骼肌中 BCAA 分解代谢的正调节因子)的小鼠的肌肉减少症。这项研究强调了改善 BCAA 分解代谢是肌肉减少症的潜在治疗方法。
+ + + + +



 English
English


