文献解读|Signal Transduct Target Ther(40.8):大规模单细胞转录组图谱揭示细菌性肺炎的全免疫全景
✦ +
+
论文ID
原名:A pan-immune panorama of bacterial pneumonia revealed by a large-scale single-cell transcriptome atlas
译名:大规模单细胞转录组图谱揭示细菌性肺炎的全免疫全景
期刊:Signal Transduction and Targeted Therapy
影响因子:40.8
发表时间:2025.01.06
DOI号:10.1038/s41392-024-02093-8
背 景
细菌性肺炎是一个重大的公共卫生问题,是发病率、死亡率和医疗保健成本的显著增加因素。2021年中国的一项研究报告称,细菌性肺炎的年龄标准化死亡率为每 100000 人约 4.2 人死亡,是第五大死亡原因。撒哈拉以南非洲、南亚和东南亚的死亡率甚至更高。由于抗生素滥用和耐药性、人口老龄化、免疫抑制剂的广泛使用以及慢性病患病率上升等因素,严重细菌性肺炎的发病率有所增加。大约五分之一的肺炎住院患者需要重症监护病房 (ICU) 入院,其中三分之一的患者需要机械通气。住院患者的死亡率特别高,尤其是重症肺炎患者,死亡率高达 38%。目前,除了抗生素和辅助治疗外,细菌性肺炎还缺乏有效的治疗方法。因此,更好地了解细菌性肺炎(特别是严重疾病)的发病机制对于开发新的治疗策略至关重要。
实验设计
结 果
01
细菌性肺炎患者 BALF 免疫细胞分析概述
为了表征细菌性肺炎的免疫状况,研究团队收集来58 例患者和 16 例健康对照 (HC) 的支气管肺泡灌洗液 (BALF) 样本并进行单细胞转录组分析(scRNA-seq)(图1a)。将 58 例诊断为细菌性肺炎的患者分为两组临床组:轻度细菌性肺炎 (MBP) 和重度细菌性肺炎 (SBP)。大多数病原体是流行的细菌性肺炎病原体,例如鲍曼不动杆菌、铜绿假单胞菌和金黄色葡萄球菌等。共获得了 444146 个高质量单细胞,平均有 3500 个唯一分子标识符 (UMI),代表 1164 个基因。在这些细胞中,60084 个细胞 (13.5%) 来自 HC,94590 个细胞 (21.3%) 来自 MBP,289472 个细胞 (65.2%) 来自 SBP 。
使用基于图的均匀流形近似和投影 (UMAP) 聚类,他们根据典型基因标记的表达确定了 8 种主要细胞类型的转录组谱:浆母细胞、巨噬细胞、中性粒细胞、CD4+ T、CD8+ T、自然杀伤 (NK) 细胞、树突状细胞 (DC) 和上皮细胞(图1b)。在 UMAP 空间中,淋巴样细胞(T 和 NK细胞)与巨噬细胞和中性粒细胞明显区分开来,而上皮细胞呈现出与免疫细胞不同的转录组模式(图1b)。当按疾病水平着色时,UMAP 表示按细菌感染后的严重程度分离,特别是重症患者与健康对照者相比,表明细菌感染引起的转录组变化(图1c)。他们首先在 8 个主要细胞聚类中鉴定出 45 种细胞亚型(补充图2f)。进一步的亚聚类分析揭示了总共 65 种亚型,涵盖了各种呼吸道细胞类型(图1b),这些亚型可用于后续分析。
每个细胞聚类显示出不同的样本来源和在疾病严重程度中的富集(图1c)。为了分析不同疾病组的独特免疫特征,他们研究了每个个体的免疫细胞组成(图1d)。值得注意的是,BALF 中中性粒细胞的百分比显著增加,尤其是在患有严重细菌性肺炎的患者中(图1d-e)。与BALF 中中性粒细胞的升高相反,细菌性肺炎患者的大多数其他主要免疫细胞类型均减少(图1d)。重要的是,他们还根据 RO/E说明了不同患者组中每种细胞亚型的偏好:观察到的细胞频率与预期细胞频率的比率(用于减轻技术变化对疾病相关细胞组成的影响),其中增殖的 B(B_01_Plasmablast)、CD4+ T(CD4T_13_Pro)和 CD8 + T(CD8T_05_Pro)细胞在轻度患者中比重度病例和健康对照组更富集(图1d)。BALF 中的血浆 B 细胞(B_01_Plasmablast)表现出编码免疫球蛋白 G1 (IgG1)、IgG3、IgG4 或 IgGM 恒定区基因的高表达,表明它们在分泌抗原特异性抗体中的作用。 这些发现表明有效的 B 细胞活化和抗体产生可能在细菌性肺炎中发挥重要作用。总体而言,数据显示细菌性肺炎患者的每种疾病状态可能表现出独特的免疫图谱。
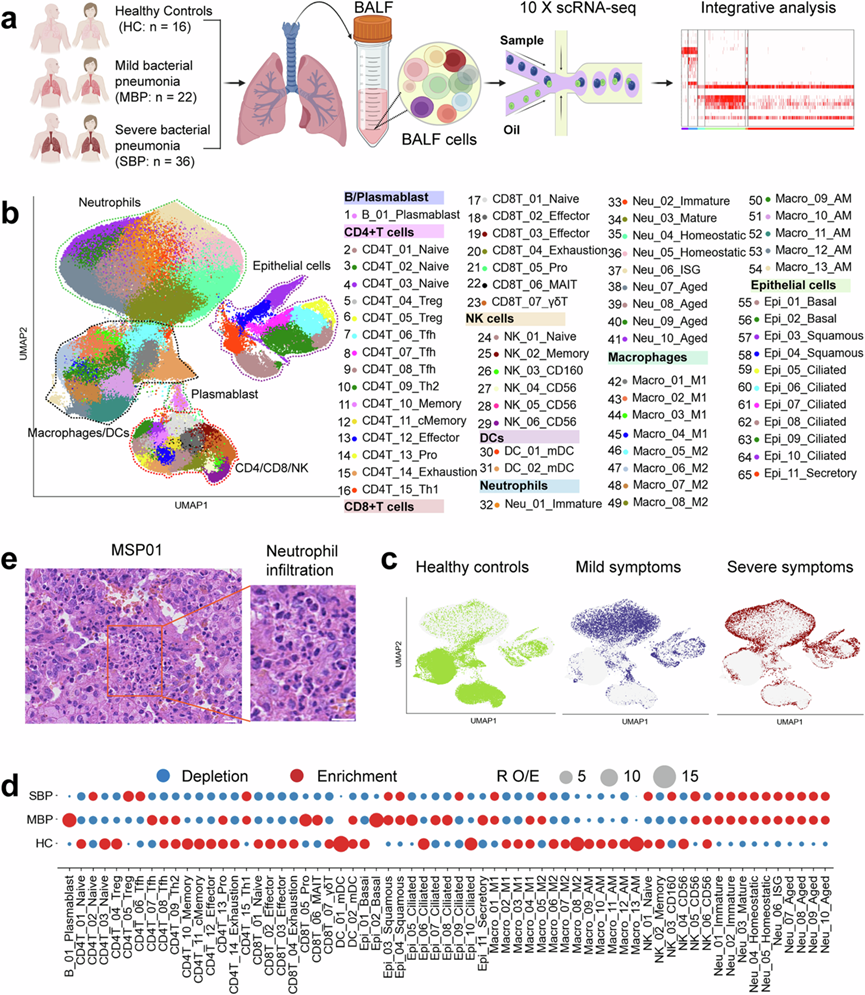
图1. BALF 单细胞转录组研究的研究设计和结果概述。
(a) 概述整体研究设计的图表,其中包括 74 名个体,包括 58 名患者(22 名轻度疾病患者和 36 名重度疾病患者)和 16 名健康供体。(b) 来自74个样本的 65 种细胞亚型(右)的聚类结果(左)。(c) 健康供体的 UMAP 投影,显示轻度和重度。(d) 通过RO/E估计的主要细胞聚类的疾病偏好。(e) 严重细菌性肺炎 (MSP01) 患者肺切片的苏木精和伊红染色代表性图像。
02
巨噬细胞和中性粒细胞是细菌性肺炎患者肺部炎症反应的主要驱动因素
宿主对病原微生物的炎症反应对于解决细菌性肺炎至关重要。为了研究细胞因子产生的潜在来源,他们分别分析细胞因子基因和已知炎症反应基因的表达,为每个免疫细胞建立了细胞因子评分和炎症评分。使用Scanpy 中的 sc.tl.score_genes 函数定义细胞因子和炎症评分,使用带有 Bonferroni 校正的 Kruskal-Wallis 检验对所有亚型的这些评分进行成对比较,从而识别出高炎症细胞群,这两个分数用作评估不同免疫细胞群潜在炎症影响的指标。在细菌性肺炎患者中,他们观察到细胞因子和炎症基因显著上调,表明存在炎症反应(图2a)。重度细菌性肺炎患者的细胞因子和炎症评分明显高于轻度细菌性肺炎患者,表明重度患者肺部存在炎症细胞因子风暴。
根据 BALF 的 scRNA-seq 数据,14 种细胞亚型(包括 6 种中性粒细胞亚型、7 种巨噬细胞亚型和 1 种上皮细胞亚型)表现出显著升高的细胞因子和炎症评分(补充图5b),表明它们可能是炎症风暴的源头。进一步分析发现了 8 个炎症细胞聚类,包括 3 个巨噬细胞聚类(Macro_02_M1、Macro_04_M1 和 Macro_10_AM)和 5 个中性粒细胞聚类(Neu_01_Immature、Neu_02_Immature、Neu_04_Homeostatic、Neu_05_Homeostatic、Neu_06_ISG),重症患者的细胞因子和炎症评分明显高于轻症患者和健康供体(图2a)。这些发现表明,这些细胞聚类可能是重症患者中观察到的细胞因子风暴的主要贡献者。他们进一步研究了重症患者中这八个细胞亚群的相对丰度,并观察到显著增加,进一步表明它们与重症病例中观察到的炎症反应增强有关。
随后的分析显示,四个炎症亚群(包括 Macro_02_M1、Neu_01_Immature、Neu_04_Homeostatic 和 Neu_05_Homeostatic)贡献了超过 80% 的炎症和细胞因子评分(图2b),表明这些细胞是重症患者炎症的主要驱动因素。这一发现与之前对 COVID-19 等其他传染病的研究一致,其中巨噬细胞和中性粒细胞也确定为细胞因子风暴的主要驱动因素。对已识别亚群中的炎症特征进行分析,发现每个炎症细胞聚类都有不同的促炎细胞因子基因表达谱(图2c),包括CXCL1/2/3/8、S100A8/9/12、IL1RN、PPBP等。此外,他们观察到重症患者中关键炎症细胞因子表达升高,包括CXCL1/2/3和S100A8/9/12。这些发现表明,多种机制可能驱动重症肺炎的炎症风暴。四种主要炎症细胞亚群中细胞类型特异性促炎细胞因子表达升高,进一步验证了它们在驱动重症患者炎症风暴中的核心作用(图2c)。
10 种促炎细胞因子(CXCL1 /2/3/8、S100A8/9/12、IL1RN、FGF13和TNFSF12)主要在 Macro_02_M1、Neu_01_Immature、Neu_04_Homeostatic 和 Neu_05_homeostatic 中表达,是炎症风暴的关键驱动因素,占重症患者细胞因子评分的 99% 以上(图2d)。S100A8 /A9和CXCL8是最重要的贡献者,占细胞因子评分的约 92%。重症患者表现出S100A8/A9和CXCL8基因表达升高(图2e)。队列中的 BALF 分析显示,重症患者的S100A8/A9复合物和CXCL8(也称为 IL-8)浓度明显较高(图2e),这强调了高炎症细胞亚群和分子(CXCL8和S100A8/A9)作为减轻重症感染性肺炎患者免疫发病机制的可能治疗靶点的重要性。
重症患者中出现的细胞因子风暴可能是由炎症细胞亚型之间复杂的细胞串扰引起的,由各种细胞因子的释放所介导。为了进一步研究这种现象,他们检测了这些患者中八种不同的炎症细胞亚型之间的配体-受体相互作用模式(图2f),揭示了这些亚型中几种值得注意的配体-受体相互作用,特别是强调了炎症巨噬细胞之间增强的相互作用(图2f)。这些炎症巨噬细胞表达多种受体,包括SLC7A1、CCR5、CCR2、IL15RA、HAVCR2等,表明对其他细胞分泌的各种细胞因子有反应性(图2g)。值得注意的是,本研究证实了炎症巨噬细胞与其他炎症细胞聚类之间的相互作用主要依赖于趋化因子及其相应的受体(图2g)。这些发现为重症肺炎中炎症细胞亚群之间复杂相互作用网络的潜在机制提供了分子层面的见解。
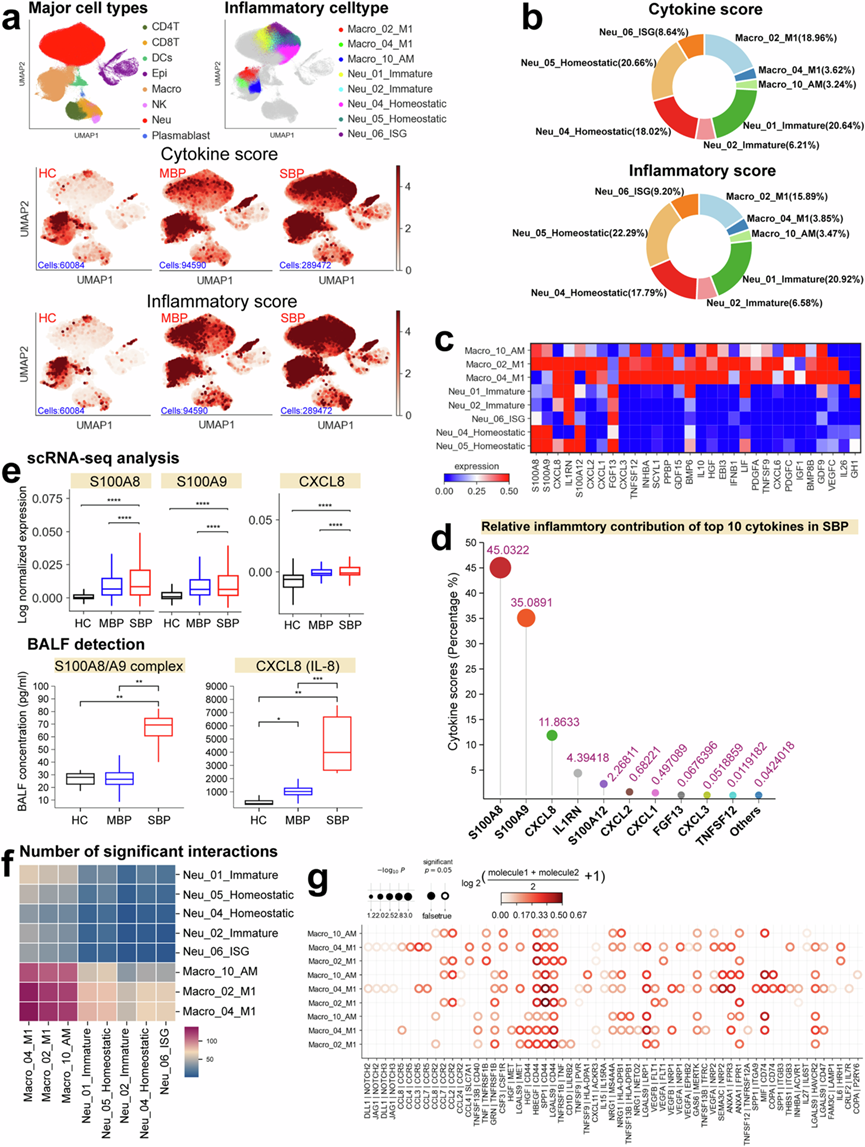
图2. 髓系细胞是重症患者产生促炎细胞因子的主要贡献者。
(a) BALF 的UMAP投影。根据八种主要细胞类型(左上)、八种高炎症细胞亚型(右上)、细胞因子评分(中间)和炎症评分(下)着色。(b) 饼图描绘了重症患者每种炎症细胞亚型对细胞因子和炎症评分的相对贡献。(c) 热图描绘了已识别的每种高炎症细胞亚型中细胞因子的表达。(d) Lollipop图描绘了重症患者前十大细胞因子的相对贡献。(e) 基于健康对照、轻度患者和重度患者的scRNA -seq 和血浆分析的细胞因子表达箱线图。(f) 八种高炎症细胞亚型之间显著相互作用总和的热图。(g) 重症患者炎症巨噬细胞之间相互作用的点图。
03
轻度患者中观察到Tfh和Th2细胞扩增,但重度患者未观察到
共鉴定出15种CD4+ T细胞亚型,包括三种幼稚T细胞(CD4T_01_Naive、CD4T_02_Naive和CD4T_03_Naive)、两种调节性T细胞(CD4T_04_Treg和CD4T_05_Treg)、三种滤泡辅助T细胞(CD4T_06_Tfh、CD4T_07_Tfh和CD4T_08_Tfh)、Th2T细胞(CD4T_09_Th2)、记忆性T细胞(CD4T_10_Memory)、中央记忆性T细胞(CD4T_11_cMemory)、增殖性T细胞(CD4T_13_Pro)、耗竭性T细胞(CD4T_14_Exhaustion)和Th1T细胞(CD4T_15_Th1)(图3a)。疾病偏好性分析显示,Tfh、Th2 和增殖的 CD4+ T 细胞在轻度患者中富集,而 Treg 亚群(CD4_05_Treg)在重度患者中主要扩增(图1d),这表明 Tfh 和 Th2 反应可能参与控制细菌感染。
CD4T_06/07/08_Tfh 细胞表现出与滤泡辅助 T 细胞 (Tfh) 一致的转录谱(例如,高表达可诱导共刺激分子;ICOS),表明它们在促进保护性 B 细胞免疫反应中具有潜在作用。Tfh 细胞对于产生最佳抗体反应和确保在病原体感染期间产生高质量的中和抗体至关重要。与此一致,他们还观察到轻度症状个体的浆母细胞明显扩增(图1d),并且这些个体中 Tfh 细胞的增加与浆母细胞扩增之间存在很强的正相关性(图3b)。然而,在病情严重程度增加的情况下,这种相关性会减弱。Th2 细胞的主要功能是促进 B 细胞活化,它们分泌的细胞因子可增强 B 细胞增殖、分化和抗体产生。有趣的是,在轻度患者中,Th2 细胞扩增与浆母细胞增多之间存在很强的相关性。与重度患者和健康对照者相比,与 Th2 极化和 B 细胞活化相关的关键基因和转录因子在轻度患者中表现出更高的表达水平(图3c)。综上所述,这些发现表明,轻度患者的 T 细胞和 B 细胞之间存在协调反应,从而产生有效的体液免疫来对抗细菌,而重度患者似乎没有结合这种免疫。
病原体感染可导致淋巴细胞耗竭。因此,他们对 CD4 + T 细胞中编码典型耗竭标志物的基因表达进行了分析。在CD4+T 细胞聚类中,两种亚型(CD4T_13_Pro 和 CD4T_14_Exhaustion)表现出明显更高的耗竭评分,其中轻度患者的耗竭评分最高。重度患者没有出现明显的 CD4+ T 细胞耗竭,这表明 CD4 + T 细胞耗竭可能不是严重细菌性肺炎的重要诱因。有大量证据表明,T 细胞耗竭的激活与持续的 I 型干扰素 (IFN) 信号传导和 CD4+ T 细胞辅助不足密切相关。在轻度患者中,CD4T_14_Exhaustion 和 CD4T_13_Pro 聚类内发现的耗竭特征似乎与持续的 I 型 IFN 信号传导和 CD4+ T 细胞辅助不足有关,正如预期的那样(图3d)。在轻度病例中,耗竭的 CD4+ T 细胞持续显示抑制基因表达升高,包括PDCD1、HAVCR2、LAG3、CTLA4和TIGIT,以及与耗竭相关的转录因子,如PTPN6/11和PRDM1(图3e)。
为了确定疾病特异性上调基因的相关生物学功能,他们对生物通路进行了GO分析。在 CD4 + T 细胞中,他们检测到轻度和重度病例与对照组分别上调了 2654 个和 694 个基因,而两组疾病之间的比较中有 638 个基因上调(图3f)。差异表达基因(DEG)的丰度表明轻度患者的 CD4+ T 细胞内存在相当大的差异。轻度细菌性肺炎患者上调的 DEG 相关通路主要与抗菌防御和免疫保护有关,包括中性粒细胞活性和抗原处理,而重度患者的上调 DEG 则与炎症反应、细胞凋亡、组织损伤和免疫抑制更相关(图3g)。与炎症反应和免疫抑制相关的基因(例如CXCL8、ID2、HSPB1和PER1)在重症患者中高度表达(图3h)。此外,他们观察到 Treg 细胞的特定亚群(CD4T_04_Treg)在具有严重症状的患者中表现出高表达水平的 TGF-β。Treg 细胞因其在产生 TGF-β 中的作用而闻名,TGF-β 有助于抑制 CD4+ T 细胞,抑制 T 细胞细胞因子的产生,并下调效应细胞的免疫反应。因此,Treg 细胞的调节功能似乎与重症患者免疫耐受的发展和细菌感染的持续有关。总之,这些研究结果表明,轻度症状患者的 CD4+ T 细胞反应主要支持免疫保护,而在重症病例中,它有助于炎症反应和免疫抑制。
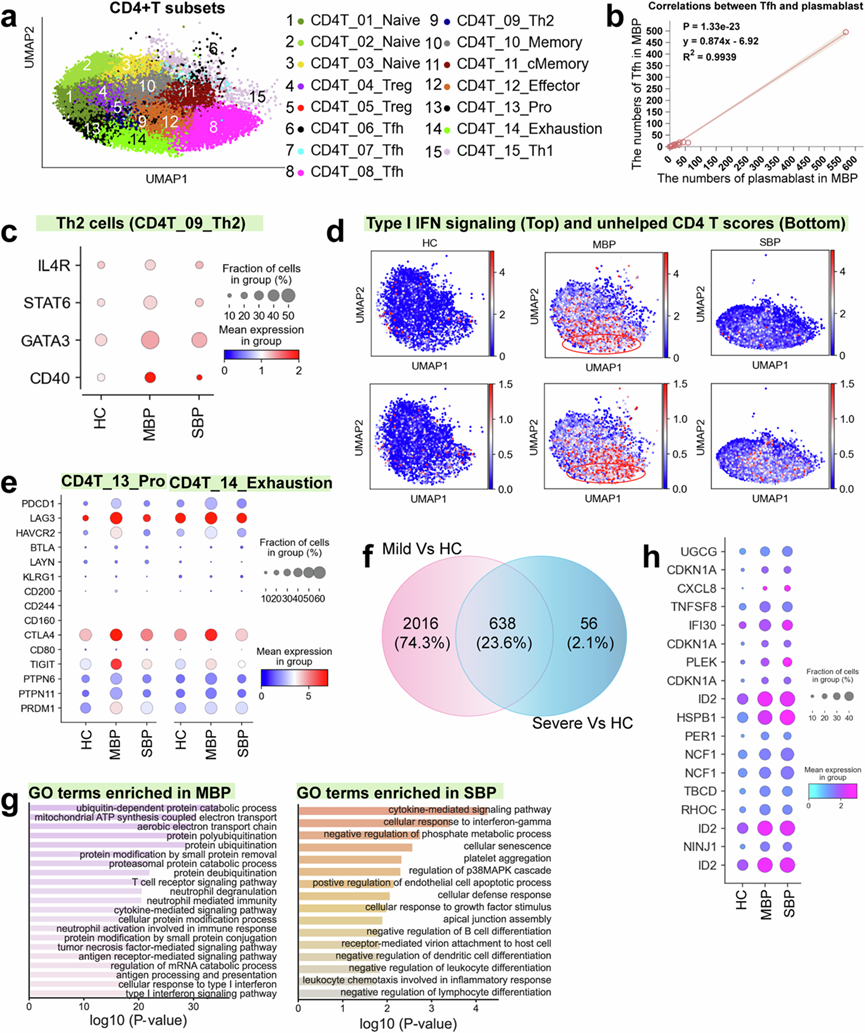
图3. CD4+ T 细胞亚群的免疫学特征。
(a) 来自 74 个样本的15 种 CD4+ T 细胞类型(右)的聚类结果(左)。(b) 轻度患者浆母细胞与 Tfh 细胞的相关性。(c) 点图显示不同疾病条件下 Th2 细胞中选定基因的表达。(d) UMAP说明每个 CD4 + T 细胞特征分数。(e)点图显示不同疾病条件下 CD4_13_Pro 和 CD4T_14_Exhaustion 中的细胞耗竭相关标志物。(f) 维恩图显示 CD4+ T 细胞中上调基因的数量。(g)GO分析。(h) 点图显示不同疾病条件下 CD4+ T 细胞相关基因。
04
CD8+ T 细胞的激活与细菌性肺炎的疾病严重程度降低有关
本研究鉴定出7 个 CD8+ T 细胞亚群:幼稚 (CD8T_01_Naive)T细胞、效应 (CD8_02/03_Effector) T细胞、耗竭 (CD8_04_Exhaustion) T细胞、MAIT (CD8_06_MAIT) T细胞、γδT (CD8_07_γδT) 和增殖 (CD8_05_Pro) T细胞(图4a)。CD8T_05_Pro 亚群鉴定为高度增殖,其MKI67和TYMS水平升高,同时存在各种效应基因(例如NKG7、GZMA和PRF1),支持将其归类为增殖效应 CD8 + T 细胞。疾病偏好分析表明,粘膜相关不变 T (MAIT) 细胞和增殖 CD8+ T 细胞主要见于症状轻微的患者,而症状严重患者则观察到所有 CD8+ T 细胞亚群的耗竭(图1d)。症状严重患者的 CD8T_05_Pro 细胞及其祖细胞(CD8T_02_Effector)丰度降低表明这些病例中 CD8 + T 细胞介导的适应性免疫反应受到一定干扰(图1d)。这些发现凸显了轻度和重度细菌性肺炎之间 CD8+ T细胞聚类的重要差异。
进行了基于分区的图形抽象 (PAGA) 分析,以检测七个 CD8 + T 亚聚类的发展轨迹(图4b)。分析将增殖亚聚类 (CD8_05_Pro) 和耗竭亚聚类 (CD8T_04_Exhaustion) 确定为两个不同的分支。PAGA 图显示两个节点 (CD8T_02/03_Effector) 表现出高度连通性,表明它们可能充当 CD8 + T细胞亚型之间的跨分化“桥梁”。这些效应状态 (CD8T_02/03_Effector) 似乎起到中间阶段的作用,将各种亚型从幼稚 (CD8T_01_Naive) 连接到更活跃的 CD8 + T 细胞亚聚类(例如,CD8T_04_Exhaustion 和 CD8T_05_Pro)。有趣的是,CD8T_02_Effector 和 CD8T_03_Effector 之间存在显著的连接性。还观察到了向衰竭和增殖子集的发展轨迹(图4b)。该轨迹与各种 CD8+ T 细胞聚类中的功能评分相关,例如,CD8T_01_Naive 和 CD8T_06_MAIT 具有较高的幼稚评分,而 CD8T_04_Exhaustion 和 CD8T_05_Pro 聚类具有较高的衰竭评分。在 CD8T_05_Pro 聚类中观察到最高的细胞毒性评分,而在 CD8T_04_Exhaustion 聚类中观察到最高的炎症评分。
两个亚聚类(CD8T_04_Exhaustion 和 CD8T_05_Pro)表现出明显的衰竭状态,表明细菌感染可能导致 CD8 + T 细胞衰竭,这是导致抗菌感染反应失衡的一个关键因素。有趣的是,重症患者的衰竭评分并没有高于轻度患者,这表明 CD8+ T 细胞衰竭可能不是严重细菌感染的主要因素。与健康患者相比,患者(尤其是轻度症状的患者)的 CD8T_04_Exhaustion 和 CD8T_05_Pro 细胞始终显示出各种衰竭基因(例如LAG3、HAVCR2、CTLA4和PDCD1)的表达水平增加(图4d)。PDCD1与PD-L1/PD-L2结合,而HAVCR2(Tim-3)与半乳糖凝集素 9 结合。这种结合随后导致酪氨酸蛋白磷酸酶SHP1和/或SHP2通过其胞内结构域募集,包括基于免疫受体酪氨酸的转换基序 (ITSM) 和基于免疫受体酪氨酸的抑制基序 (ITIM)。因此,这些相互作用抑制了 PI3K-AKT 和 LAT-Zap70 等关键信号通路,导致细胞增殖减少和细胞因子产生减少。此外,PRDM1 水平升高与衰竭细胞的多功能性降低和抑制性受体表达增加有关。与健康供体相比,患有细菌感染(尤其是轻度感染)的个体的衰竭 CD8+ T 细胞的关键转录因子(如PRDM1和PTPN6/11)的表达水平明显更高。重要的是,通过流式细胞技术确认了细菌性肺炎患者的CD8 + T 细胞耗竭表型(图4e)。
CD8 + T 细胞中耗竭程序的发育与持续的 I 型干扰素 (IFN) 信号密切相关,耗竭的 CD8 + T 细胞具有与 I 型 IFN 信号传导相关的基因显著富集,这表明 CD8T_04_Exhaustion 和 CD8T_05 _Pro 细胞的耗竭状态与持续的 I 型 IFN 信号传导之间存在直接联系(图4f)。此外,CD8 + T 细胞中的耗竭程序也与受损的 CD4 + T 细胞介导的支持密切相关,这有助于在感染中维持强大的 CD8 + T 细胞免疫反应。因此,他们分析了耗竭的 CD8 + T 细胞 (CD8T_04_Exhaustion 和 CD8T_05 _Pro) 是否表现出 CD4 + T 细胞帮助减少的迹象。正如预期的那样,CD8T_04_Exhaustion 和 CD8T_05_Pro 均显示出转录本的显著上调,这些转录本通常与缺乏足够 CD4 + T 细胞辅助的 CD8 + T 细胞有关(图4e)。总之,这些数据表明,在 CD8T_04_Exhaustion 和 CD8T_05_Pro 亚群中观察到的耗竭可能是由持续的 I 型 IFN 信号传导以及缺乏足够的 CD4 + T 细胞所驱动的。
虽然表现出耗竭和“无助”的特征,耗竭的 CD8+ T 细胞亚群显示出明显的细胞毒性特征基因正向富集和细胞毒性转录本表达水平升高(例如CST7、GNLY、PRF1、GZMA / B、NKG7)(图4g),这表明这些耗竭亚型可能是异质性的。虽然耗竭的 CD8 + T 细胞的增殖和产生细胞因子的能力可能降低,但细胞毒性能力通常仍然完好无损。与健康对照组相比,患者,尤其是轻度组的患者在耗竭的 CD8+ T 细胞中显示出更高水平的细胞毒性特征基因表达。与在耗竭的 CD8+ T 细胞中的发现类似,他们还观察到 CD8T_07_γδT 细胞群中细胞毒性基因的显著表达。效应 CD8 + T 细胞表现出细胞溶解功能,使它们能够通过涉及穿孔素、颗粒酶和颗粒溶素的颗粒介导机制直接消除病原体或受感染的细胞。因此,CD8 + T 细胞中各种细胞溶解分子的表达增强可能与轻度疾病患者的免疫保护有关。这些发现表明 CD8 细胞已经完全激活,尤其是在症状较轻的个体中。
为了进一步研究细菌性肺炎患者 CD8 + T 细胞的特征,他们研究了轻度和重度疾病患者相对于健康对照者的 DEG。在 CD8 + T 细胞中,观察到在轻度和重度病例中分别有 2012 个 (76.2%) 和 42 个 (1.5%) 个基因上调(图4h)。此外,在两组疾病中,共有 588 个 (22.3%) 个基因同时上调(图4h)。值得注意的是,症状轻微的个体在 CD8+ T 细胞内的 DEG 丰度方面表现出更大的可变性(图4h)。从BALF中分离出的CD8+ T细胞,尤其是CD8T_04_Exhaustion和CD8T_05_Pro,在轻症患者中高表达各种活化标志物(例如CD69、CD38、CD25(IL2RA)和PDCD1),进一步表明轻症患者的CD8 + T细胞具有更高的活化程度(图4i)。相反,重症患者CD8 + T细胞中的DEG表现出与炎症反应和细胞凋亡相关的基因表达升高(图4i)。
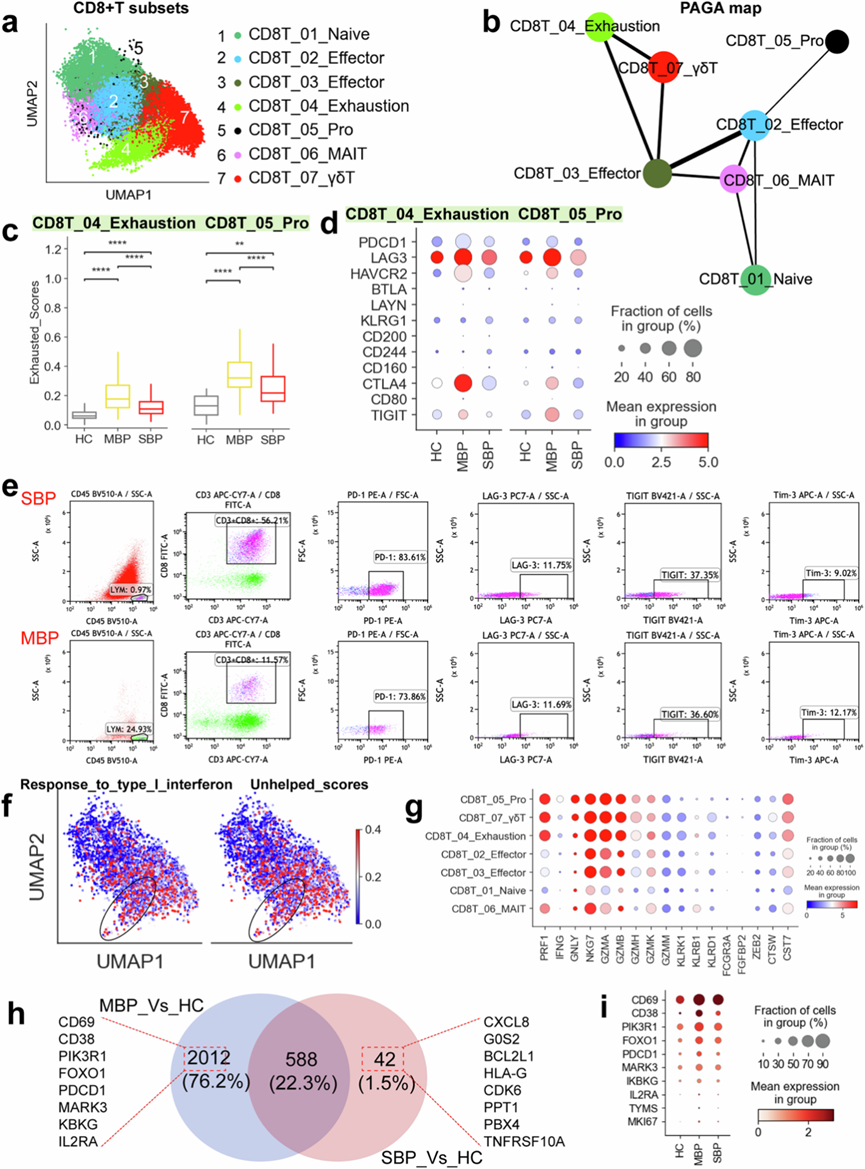
图4. CD8+ T 细胞亚群的免疫学特征。
(a) 来自 37 个样本的七种 CD8 + T 细胞类型(右)的聚类结果(左)。(b) CD8+ T 细胞伪时间的 PAGA 分析:列出了相关的细胞类型和相应的状态。(c) 箱线图显示不同疾病条件下 CD8_04_Exhaustion 和 CD8_05_Pro 亚群中的耗竭分数。(d) 点图显示不同疾病条件下 CD8_04_Exhaustion 和 CD8_05_Pro 亚群中的细胞耗竭相关标志物。(e)流式细胞分析。(f) UMAP说明每个 CD8+ T 细胞的特征分数。(g) 点图显示细菌性肺炎患者CD8+ T 细胞亚群中的细胞毒性相关基因。(h) 维恩图说明 CD8+ T 细胞中上调基因的数量。(i) 点图显示不同疾病条件下CD8+ T 细胞中的活化相关基因。
05
中性粒细胞反应失调是导致严重细菌感染的潜在因素
亚聚类分析发现中性粒细胞区室内存在显著的多样性,鉴定出 10 种转录上不同的细胞亚型。这些亚型包括两个未成熟聚类、一个成熟聚类、四个老化聚类、一个干扰素刺激基因 (ISG) 相关聚类和两个稳态聚类(图1b和图5a)。所有中性粒细胞亚群在细菌感染个体中均富集(图1d-e),证实了浸润中性粒细胞的显著参与。这种丰度的增加强调了中性粒细胞在对抗细菌病原体中的关键作用,并强调了它们作为先天免疫系统基本要素的功能。当使用 UMAP 在疾病水平上可视化中性粒细胞时,中性粒细胞根据疾病严重程度分组(图5b),表明中性粒细胞对不同程度的细菌感染有不同的反应。PAGA 轨迹分析揭示了中性粒细胞的三种不同命运,其中 Neu_03_mature、Neu_06_ISG 和 Neu_07_Aged 代表不同的终点(图5c)。发育轨迹与细胞成熟、干扰素反应和细胞衰老相关(图5c),这意味着中性粒细胞在细菌感染后可能会经历不同的发育和功能变化。这些发现表明中性粒细胞根据细菌感染的严重程度表现出不同的反应。
从细菌感染患者的 BALF 样本中获得的中性粒细胞存在发现含有不同的 LDN(低密度中性粒细胞),分别称为 Neu_01_Immature 和 Neu_02_Immature(图5a)。LDN 主要在患病期间产生(例如紧急髓系造血期间的严重感染和脓毒症),与表现出免疫抑制和炎症的免疫反应受损密切相关。严重细菌感染患者的未成熟中性粒细胞高度表达一系列促炎分子,例如S100A8 /9/12、CCL3/4、IL1B和CXCL8(图5d-e),这些分子已确定为结核病和 COVID-19 等严重传染病中炎症细胞因子风暴的主要诱导物。未成熟中性粒细胞表现出PADI4表达增高(图5d),PADI4 是与 NET(NETosis;中性粒细胞胞外陷阱形成)有关的关键因素。最近的研究表明 NET 在严重传染病的发病机制中发挥了重要作用。此外,还发现未成熟中性粒细胞表达BPI基因,该基因此前已与严重感染的不良后果有关。精氨酸酶 1 (ARG1) 是 T 细胞活化的抑制剂,它在患有严重细菌性肺炎的患者的未成熟中性粒细胞中高度表达(图5d)。这些发现表明,未成熟中性粒细胞可能通过促进中性粒细胞胞外陷阱 (NET) 的形成、引发过度炎症反应和抑制 T 细胞活化,参与患者严重细菌感染的发病机制。
由于未成熟中性粒细胞可能会阻碍 T 细胞活化,他们通过检测未成熟中性粒细胞和 T 细胞之间的相互作用来研究这种抑制的潜在机制。在症状严重的情况下,未成熟中性粒细胞(Neu_01/02_Immature)和效应 T 细胞(例如,CD8T_05_Pro、CD8T_02/03_Effector)之间存在显著的相互作用(图5f)。他们进一步评估了重症患者中参与这些相互作用的潜在配体-受体 (LR) 对的强度。值得注意的是,几对 LR 对,特别是 HLA-E_KLRK1、HLA-E_KLRC1、HLA-E_KLRD1 和 ICAM1-ITGAL,在该患者组中显示出很高的相互作用潜力。慢性乙肝和丙肝病毒感染的先前证据表明 HLA-E_KLRC/D/K1 信号传导在驱动 T 细胞功能障碍和支持病毒持续存在方面起着重要作用。此外,ICAM1-ITGAL 轴已证明可以抑制小鼠对感染的 T 细胞免疫反应并促进细粒棘球绦虫的免疫逃避。总的来说,这些发现为进一步研究严重细菌感染的发病机制和治疗干预措施提供了潜在的目标。
为了进一步探索细菌感染过程中中性粒细胞的功能差异,他们分析了轻度和重度感染患者中性粒细胞中的 DEG。与健康对照相比,轻度病例中有 1182 个基因上调,重度病例中有 1306 个基因上调(图5g),说明轻度和重度病例之间的基因表达存在明显差异。轻度和重度患者组均有 1085 个上调基因。然而,重度病例的特点是另外 221 个上调基因,表明其具有独特的基因表达特征。然后,他们重点研究在重度病例中特别上调的基因,研究它们在免疫损伤中的潜在作用。过表达的基因在与中性粒细胞活化和脱颗粒相关的途径中富集(图5h),表明在重度感染中中性粒细胞活性增强。这种过度活化会导致 NET 的产生,从而加剧炎症和组织损伤,最终导致疾病严重程度增加(图5i)。中性粒细胞活化和脱颗粒途径在重症患者中表现出显著上调的表达水平(图5i)。此外,中性粒细胞中过表达的基因也与炎症反应和 T 细胞抑制有关(图5h),进一步支持中性粒细胞在严重感染中加剧炎症和抑制适应性免疫的作用。与这些发现一致的是,与中性粒细胞活化、脱颗粒、炎症和 T 细胞抑制相关的基因在严重细菌感染患者中明显上调。总之,这些发现表明中性粒细胞异质性及其基因表达谱可能在对细菌感染的免疫反应中发挥重要作用,中性粒细胞活性增强可能与疾病严重程度和免疫系统失调有关。
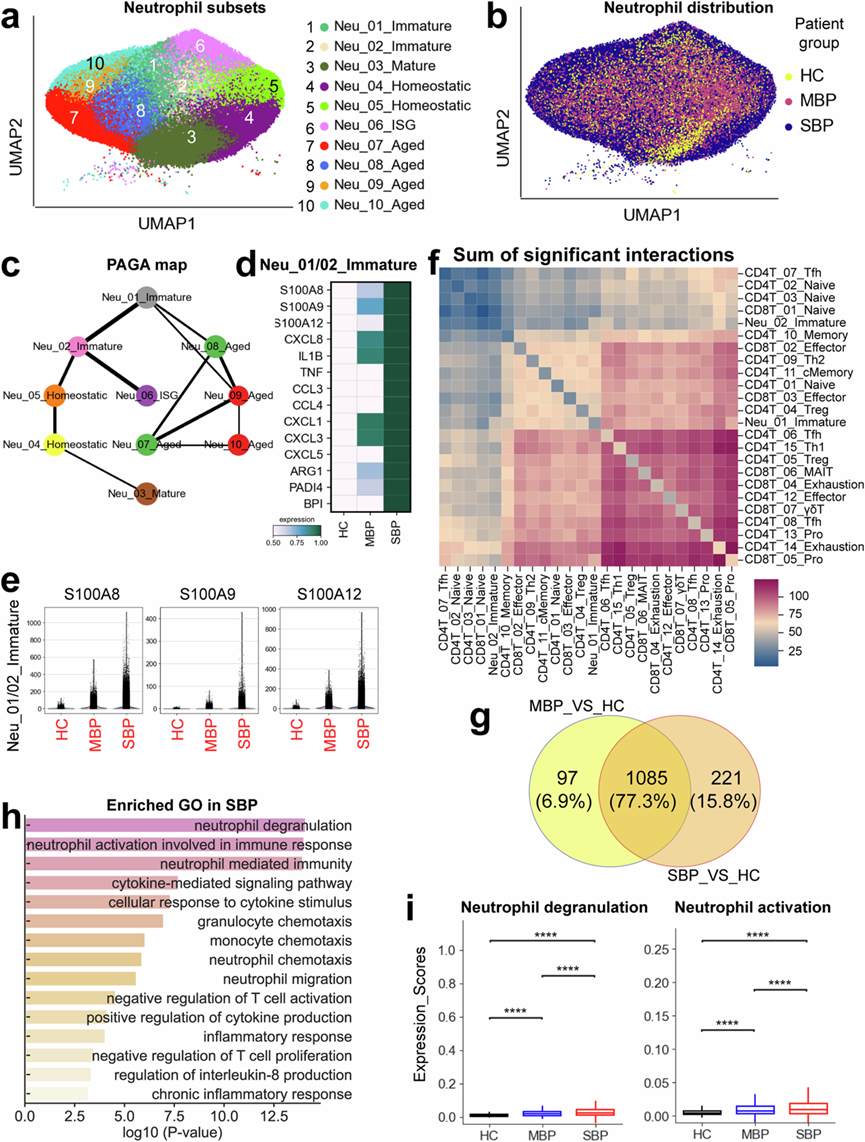
图5. 中性粒细胞的免疫学特征。
(a) 74个样本的中性粒细胞亚型(右)的聚类结果(左)。(b) 显示疾病分布的中性粒细胞聚类的 UMAP 图。(c) 中性粒细胞伪时间的 PAGA 分析:列出了相关的细胞类型和相应的状态。(d) 不同疾病条件下未成熟中性粒细胞亚群中选定基因的热图。(e) 不同疾病条件下未成熟中性粒细胞亚群中 S100A8、S100A9 和 S100A12 的小提琴图。(f) 重症患者中未成熟中性粒细胞聚类(Neu_01/02_Immature)与 T细胞亚型之间显著相互作用总和的热图。(g) 维恩图说明中性粒细胞中上调基因的数量。(h) GO分析。(i) 箱线图显示不同疾病条件下中性粒细胞的功能评分。
06
巨噬细胞反应失调是导致严重细菌感染的潜在因素
他们分析了来自三种不同疾病状态的 98,221 个巨噬细胞,发现与健康对照者相比,细菌感染患者的巨噬细胞群发生了显著重塑(图6a)。为了进一步探索它们的异质性,他们重新聚类了 13 种巨噬细胞亚型(图1b,图6a)。根据最新的分类和常用标记,根据MARCO、FABP4、MRC1、SPP1 和 FCN1 的表达模式将巨噬细胞分类。这些类别包括经典的单核细胞样巨噬细胞组(Macro_01/02/03/04_M1)、M2 样巨噬细胞组(Macro_05/06/07/08_M2)和肺泡样巨噬细胞组(Macro_09/10/11/12/13_AM)。在健康个体中,AM 样群体占肺巨噬细胞的 70% 以上,而在细菌性肺炎患者中,M1 和 M2 样巨噬细胞占主导地位,占肺巨噬细胞总数的约 80%(图6b)。细菌性肺炎患者的各种 AM 样亚群也显著减少,表明感染后巨噬细胞组成发生显著变化。
鉴于细菌感染患者的巨噬细胞向 M1 和 M2 样巨噬细胞的大量重塑(图6b),他们更详细地分析了这些细胞区室。鉴定为 Macro_03_M1 的巨噬细胞聚类表现出升高的IDO1和PD-L1(CD274)水平(图6c)。PD-L1和IDO1水平升高通常与巨噬细胞髓系抑制细胞 (MDSC)、中性粒细胞、粒细胞和单核细胞的免疫抑制活性有关。此外,在肺结核中,IDO1+巨噬细胞与抑制功能有关,这表明细菌感染中的 Macro_03_M1 亚聚类类似于巨噬细胞 MDSC (M-MDSC),凸显了其在免疫抑制和维持细菌感染中的潜在作用,可能导致疾病进展。除了在免疫抑制中的作用外,M-MDSC(Macro_03_M1)还会产生各种促炎细胞因子,这些细胞因子会加剧组织损伤。Macro_03_M1 和其他 M1 和 M2 样巨噬细胞聚类表现出各种促炎细胞因子的高表达(图6d)。他们发现重症患者的 M1 和 M2 样巨噬细胞大量表达经典促炎细胞因子基因,如S100A12、TNF、IL1B、IL6、CXCL8、CXCL1和CXCL3。通过根据这些上调的细胞因子定义促炎细胞因子评分(图6d),他们观察到严重细菌感染中的大多数 M1 样和 M2 样巨噬细胞亚群表现出明显升高的促炎细胞因子评分,这意味着它们是炎症反应的重要驱动因素,可能导致组织损伤和疾病严重程度增加。总之,这些发现强调 M1 样和 M2 样巨噬细胞可能在免疫抑制和炎症中发挥关键作用,导致细菌感染难以控制,并导致重症患者的预后更差。
为了更好地了解细菌感染患者和健康对照者之间 Macro_03_M1 聚类的功能差异,他们进行了 DEG 和 GO 分析。在 Macro_03_M1 聚类中,他们发现在轻度症状患者中上调了 333 个基因,在重度症状患者中上调了 426 个基因(图6e),说明随着病情的进展,基因活性显著增加。两组患者共有 233 个上调基因(图6e)。值得注意的是,重度病例还有 193 个上调基因(图6e)。GO 分析显示,在重度患者中,与免疫抑制相关的基因显著富集,例如“免疫反应的负调节”、“T 细胞活化/增殖的负调节”和“T 细胞介导的免疫的负调节”。这进一步支持了以下概念:M-MDSC(Macro_03_M1)代表具有强大免疫抑制能力的多样化髓样细胞亚群。1M-MDSC 能够直接抑制 T 细胞活化和功能,而 T 细胞是适应性免疫系统的重要组成部分。因此,Macro_03_M1 聚类的这种抑制可能导致重症患者对细菌感染的免疫反应降低。与这些数据一致,Macro_03_M1 聚类表现出与免疫抑制功能相关的多个基因表达升高(例如RIPOR1、SDC4、FGR和PNE)。在重症患者中,Macro_03_M1 还表现出激活的炎症和凋亡表型,与炎症和凋亡相关的各种基因(例如IL6、CXCL1、CXCL3、JUN和MAP3K5)的水平较高。因此,重症患者中的 Macro_03_M1 聚类以免疫抑制、炎症和凋亡的结合为特征,凸显了其在重症感染病理学中的多方面作用。
接下来,他们检测了 T 细胞和 Macro_03_M1 之间的细胞间相互作用。数据显示,Macro_03_M1 聚类主要与重症患者的耗竭 T 细胞和效应 T 细胞相互作用(图6g)。他们通过多色免疫组织化学 (IHC) 染色进一步证实了重症细菌性肺炎患者的巨噬细胞和耗竭 T 细胞之间的相邻空间关系(图6h)。接下来,他们评估了参与重症患者 Macro_03_M1 与耗竭 T 细胞和效应 T 细胞之间相互作用的潜在配体-受体 (LR) 对的强度。杀伤免疫球蛋白样受体家族 (KIR;例如 KIR3DL1/2) 和 HLA I 类 (HLA-I;例如 HLA-A/F/B) 之间的多种配体-受体对表现出很高的相互作用潜力。最近的研究表明,HLA-I_KIR 轴在介导 T 细胞功能障碍和抑制 T 细胞活化、细胞因子产生和细胞毒性方面起着关键作用。此外,几种趋化因子(例如CCL2/3/4/7/8)及其受体(例如CCR1/2/5/8)也表现出强烈的潜在相互作用。趋化因子和它们的受体(例如 CCL3_CCR5 轴)之间的相互作用对于引导 T 细胞到感染部位至关重要。在感染期间,通过 CCR5 的持续信号传导可导致 T 细胞持续活化,可能导致 T 细胞耗竭和功能下降。因此,了解 M-MDSC(Macro_03_M1)和 T 细胞亚型之间的这些相互作用可以为增强严重细菌性肺炎免疫功能的潜在治疗策略提供见解。
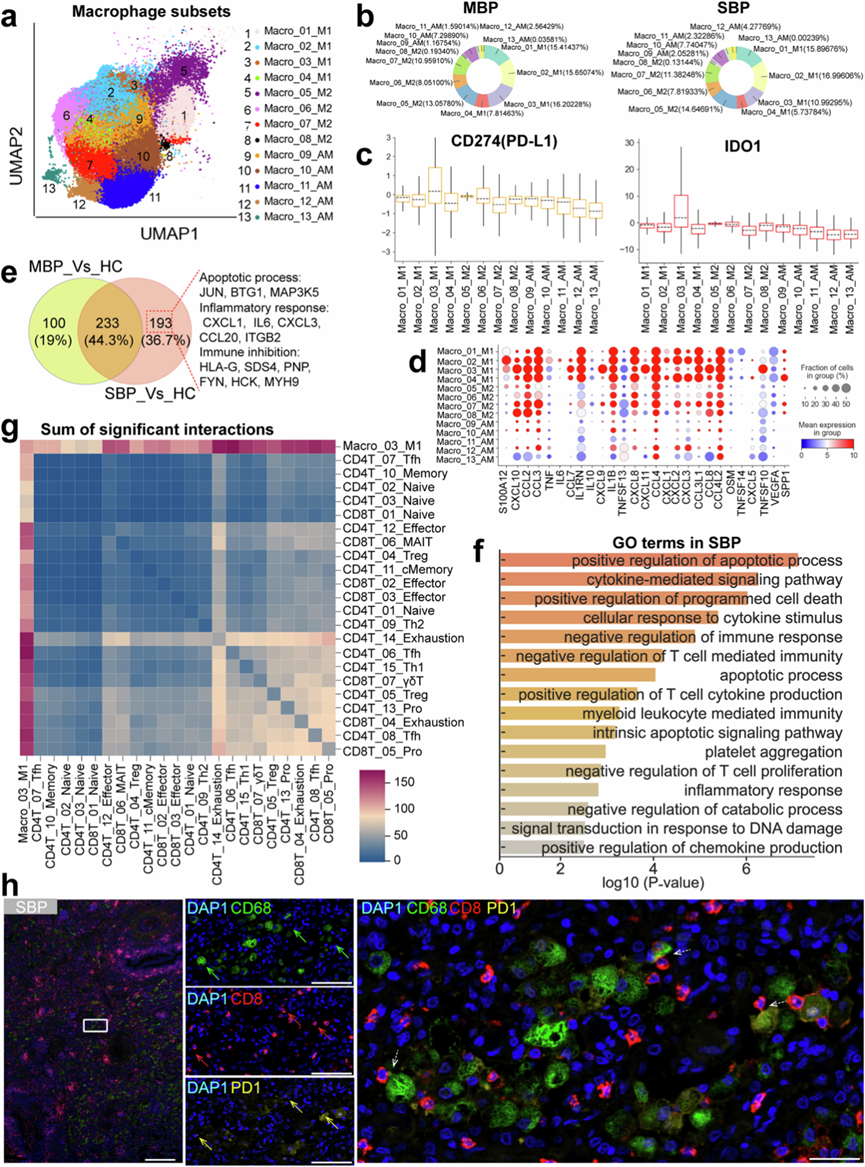
图6. 巨噬细胞的免疫学特征。
(a) 74个样本的巨噬细胞亚型(右)的聚类结果(左)。(b) 饼图描绘了轻度(左)和重度(右)患者中巨噬细胞亚型的相对百分比。(c) 箱线图显示巨噬细胞亚型中 PD-L1 和 IDO1 的表达分数。(d) 点图显示巨噬细胞亚型中与炎症相关的基因。(e) 维恩图说明 Macro_03_M1 中上调基因的数量。(f)GO分析。(g) Macro_03_M1和 T 细胞亚群之间显著相互作用总和的热图。(h) 显示了 SBP 组的代表性多色免疫组织化学 (IHC) 染色肺切片。
+ + + + + + + + + + +
结 论
本研究对来自 74 人大型队列的 444146 个支气管肺泡灌洗液细胞 (BALF) 进行了scRNA-seq,其中包括 58 名患有轻度 (n = 22) 和重度 ( n = 36) 疾病的患者以及 16 名健康捐赠者。采用酶联免疫吸附和组织学测定法对该队列进行验证。观察到细菌性肺炎中免疫反应的异质性,不同的免疫细胞特征与疾病严重程度有关。严重细菌性肺炎的特点是炎症细胞因子风暴,由S100A8 / A9和CXCL8的系统性上调引起,这主要是由于特定的巨噬细胞和中性粒细胞亚群所致。相比之下,轻度细菌性肺炎表现出有效的体液免疫反应,其特征是 T 滤泡辅助细胞和 T 辅助细胞 2 的扩增,促进 B 细胞活化和抗体产生。尽管两种疾病组都表现出 T 细胞衰竭,但轻度病例保持了强大的细胞毒性 CD8+ T 细胞功能,这可能反映了一种补偿机制。失调的中性粒细胞和巨噬细胞反应对严重疾病的发病机制有显著影响。未成熟的中性粒细胞会促进过度炎症并抑制 T 细胞活化,而特定的巨噬细胞亚群 (Macro_03_M1) 显示出类似于髓系抑制细胞 (M-MDSC) 的特征,会抑制 T 细胞并促进炎症。总之,这些发现突出了调节免疫反应和改善细菌性肺炎临床结果的潜在治疗靶点。
+ + + + +



 English
English


