文献解读|Cancer Cell(48.8):表面蛋白质组研究确定 DLK1 是神经母细胞瘤的免疫治疗靶点
✦ +
+
论文ID
原名:A proteogenomic surfaceome study identifies DLK1 as an immunotherapeutic target in neuroblastoma
译名:表面蛋白质组研究确定 DLK1 是神经母细胞瘤的免疫治疗靶点
期刊:Cancer Cell
影响因子:48.8
发表时间:2024.11.11
DOI号:10.1016/j.ccell.2024.10.003
背 景
神经母细胞瘤仍然是儿童中最致命的癌症之一。虽然采用了多模式强化疗法,但是高危神经母细胞瘤的存活率仍不到 50%,复发通常无法治愈。从诊断开始对神经母细胞瘤进行测序显示,复发性体细胞驱动突变很少。大约15 %的高危神经母细胞瘤含有间变性淋巴瘤激酶 (ALK) 基因的激活突变,ALK异常与较低的存活率相关。第三代变构 ALK 抑制剂 Lorlatinib在患有携带ALK突变的复发性疾病患者中显示出有希望的抗肿瘤活性,并且正在对新诊断患者进行评估(ClinicalTrials.gov:NCT03126916)。除了ALK之外,在高危神经母细胞瘤中,没有其他激酶适合进行酶抑制。癌症免疫疗法在 B 细胞恶性肿瘤中产生了显著的效果;然而,许多实体癌的最佳细胞表面靶点仍然难以捉摸。
实验设计
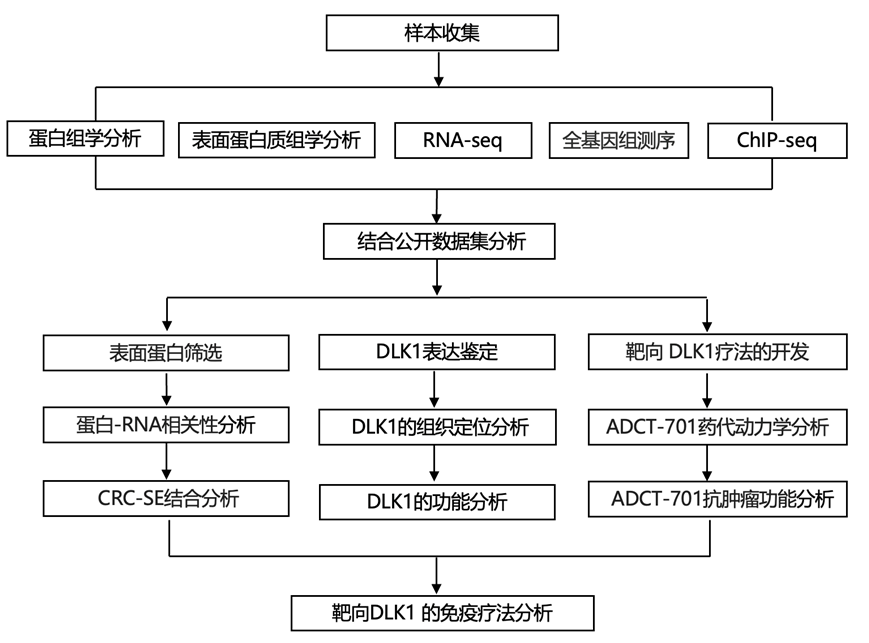
结 果
01
基于质谱的神经母细胞瘤表面蛋白组学(surfaceome)分析
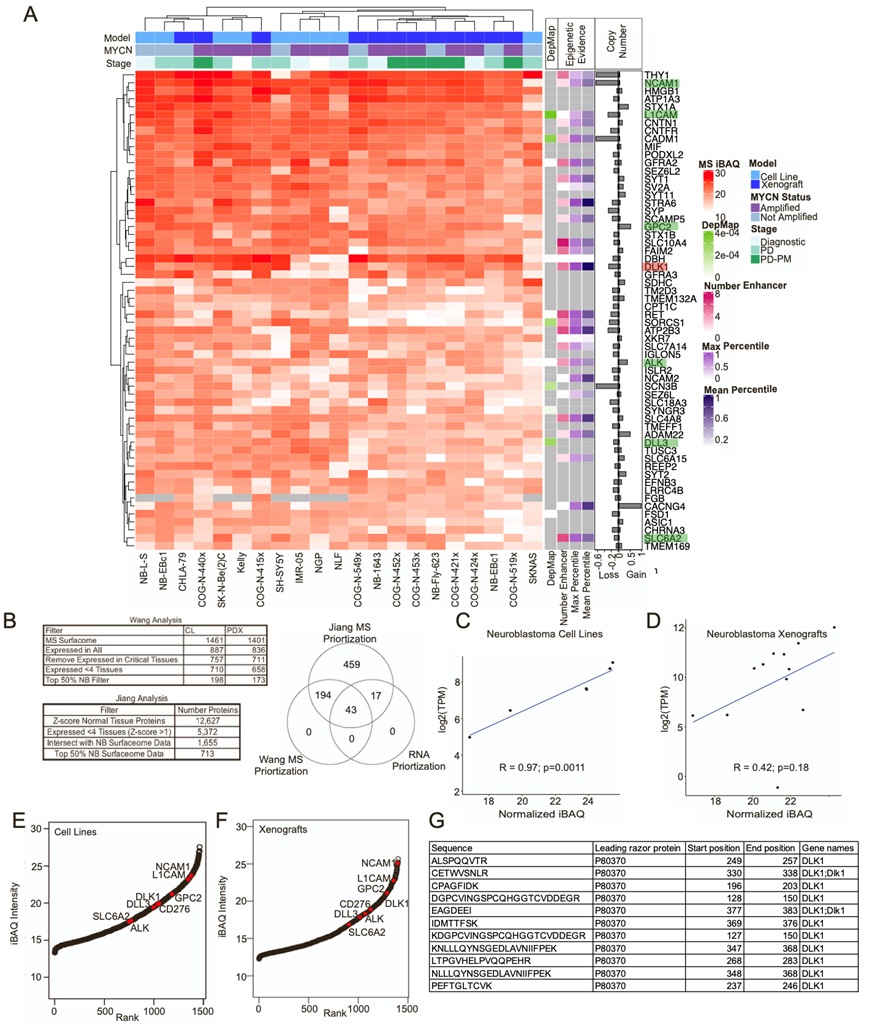
为了定量神经母细胞瘤的细胞表面蛋白质组(表面组),研究团队首先优化了蔗糖梯度质膜富集方法。他们将这种方法应用于遗传多样化的人源性神经母细胞瘤细胞系和异种移植 肿瘤。通过质谱 (MS) 共量化了细胞系中的7172 种蛋白质和异种移植模型中的 6831 种蛋白质。为了获得一组高置信度的表面蛋白,使用 COMPARTMENTS (Compartments >3) 和来自 CIRFESS (SPC >0) 的表面蛋白共识评分 (SPC) 过滤定量的蛋白质,分别在细胞系中产生 1461 种表面蛋白,在异种移植中产生 1401 种表面蛋白。他们观察到生物和技术重复之间具有很强的可重复性(图 S1A-D)。然后,他们筛选了基于质谱的蛋白质列表,以查找正在开发或之前研究过的表面蛋白,作为神经母细胞瘤的候选免疫治疗靶点。他们观察到NCAM1、L1CAM 、GPC2、CD276、SLC6A2、DLL3 和 ALK 位列细胞系和异种移植模型中前 50% 的表面蛋白,且已证实本研究方法的可行性(图S1E-I)。
为了评估表面蛋白的 RNA 和蛋白质之间的相关性,他们利用了匹配的转录组分析(RNA-seq)数据,在可评估的蛋白质中,细胞系中 63%的表面蛋白和异种移植模型中 43%的表面蛋白显示出正相关性(图S2 A-B)。在神经母细胞瘤中观察到表面蛋白的正相关性和负相关性(图 S2 C)。通过将高斯混合模型与 RNA 和质谱数据相结合,他们鉴定了在蛋白质水平上量化的低表达 RNA(图S2D-F)。
他们针对细胞系和异种移植模型独立开发了多组学数据整合和优先级排序流程(图 1 A-B)。然后,他们将范围限制为与神经母细胞瘤相比在正常组织中 mRNA 表达较低的蛋白质,通过基因型-组织表达 (GTEx)和RNA-seq数据进行分析,并排除在大脑和生殖器官以外的四种或更多组织中神经母细胞瘤与每种正常组织相比的差异倍数 (FC) <4 的蛋白质。接下来,评估蛋白质的 MS 丰度,保留在所有细胞系或异种移植模型中平均丰度 >50 百分位数的蛋白质,产生了 60 种独特的候选蛋白质。
他们还试图确定驱动蛋白质表达的潜在基因组或表观遗传机制。最近的研究表明,核心转录调节回路(CRC)与超级增强子 (SE) 结合以控制基因表达并维持神经母细胞瘤的细胞状态。因此,他们评估了十个神经母细胞瘤细胞系的 H3K27ac ChIP-seq数据。在给定基因位点具有 SE 的细胞系数量以及跨细胞系的平均和最大 SE 等级百分位数与前 60 个优先靶标的细胞系和异种移植的质谱数据叠加(图 S3 A-B)。
他们选择了 delta 样非典型 Notch 配体 1 基因DLK1作为多组学表面组中优先分析的蛋白质。在神经母细胞瘤细胞系中观察到 RNA 和蛋白质表达之间的高度相关性,在异种移植中相关性适中(图 S3C-D)。与神经母细胞瘤中已知靶标相比,DLK1 含量丰富,其中 9/11 个肽仅映射到人类(图S3E-G)。来自神经母细胞瘤患者肿瘤和 GTEx 中各种正常组织的 RNA-seq数据表明,除肾上腺、垂体和卵巢外,大多数正常组织中均不存在DLK1 mRNA 表达(图 1C)。DLK1表达与神经母细胞瘤中的MYCN扩增状态相关(图S4A)。对高风险患者肿瘤的匹配全基因组测序 (WGS) 数据进行进一步分析后发现,没有涉及DLK1 的局部扩增,这表明存在表观遗传过表达机制。
他们在 6/10 个神经母细胞瘤细胞系中观察到DLK1基因座的 SE (图 1 D,图S4 B)。事实上,DLK1基因座在整个细胞系组中排名最强的 SE 之一(图 S4 C-D)。SE 与更高的 mRNA(图 1 E)和蛋白质水平(图 1 F-G)相关。最后,他们可视化了DLK1基因位点处 CRC 因子(MYCN、GATA3、HAND2、ISL1、PHOX2B 和 TBX2)的 ChIP-seq数据(图 1 H),表明DLK1可能受神经母细胞瘤中的 CRC 调控。高表达DLK1与较差的总体生存率相关(图 1 I)。在两个独立的数据集中,高表达DLK1趋向于较差的结果,但未达到统计学意义(图 S4 E)。
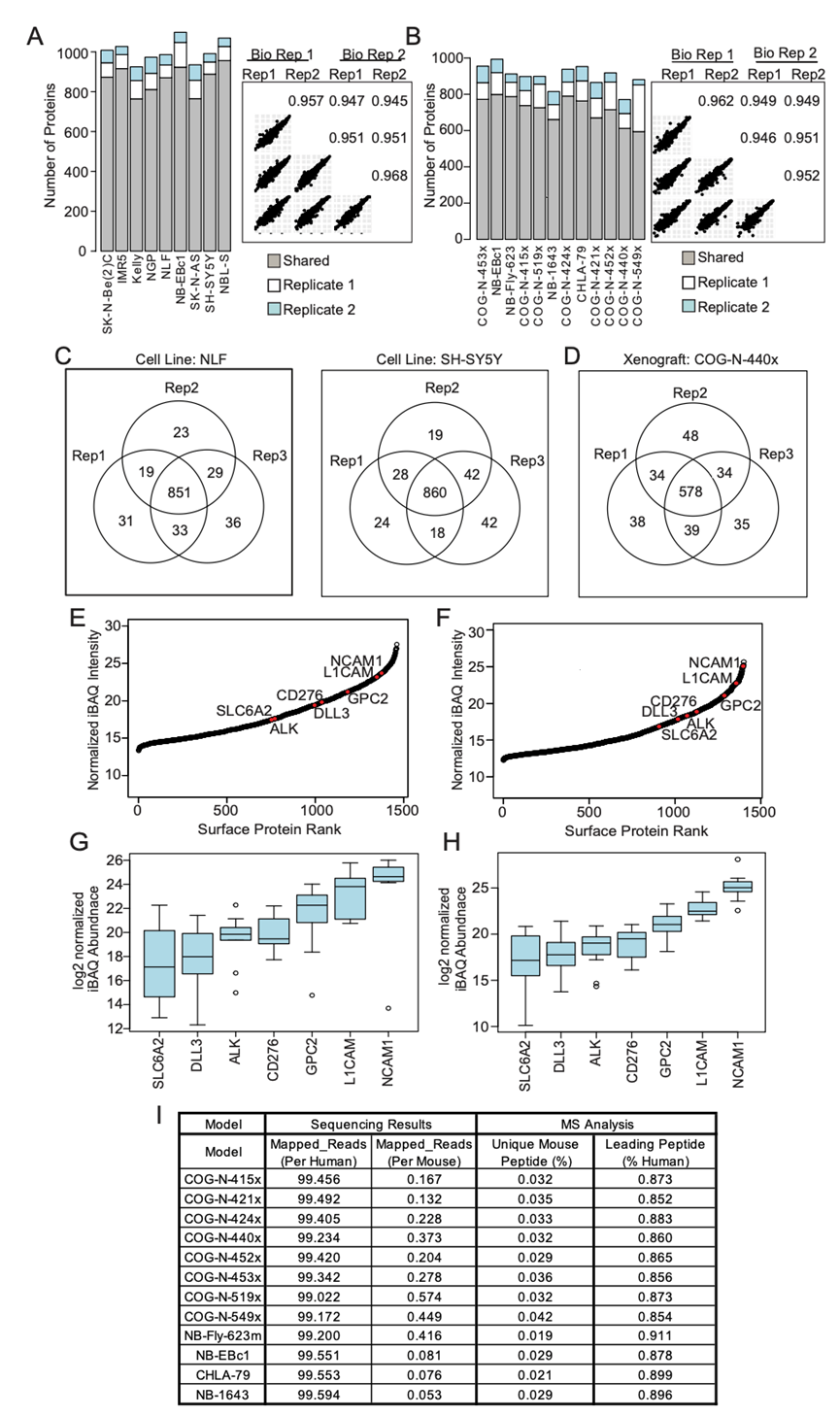
图S1. 蔗糖密度梯度方法学耦合质谱定义神经母细胞瘤表面蛋白组。
(A-B) barplot显示了细胞系和异种移植模型的两个生物重复之间蛋白质鉴定的可重复性。(C-D) 蛋白质的维恩图。 (E-F) 蛋白质根据平均标准化iBAQ丰度进行排序,最丰富的蛋白质位于曲线图的右侧。 (G-H) 箱线图显示了细胞系和异种移植物中已知表面蛋白的丰度。(I) 测序和质谱结果显示小鼠污染低。
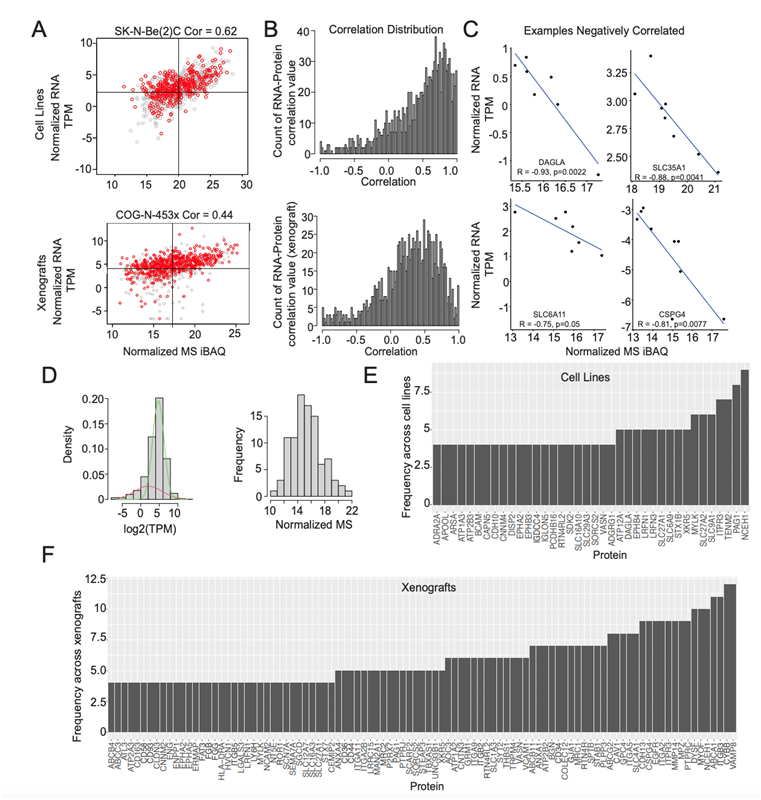
图S2. 神经母细胞瘤细胞系和异种移植模型表面组分析显示重复之间有很强的相关性,并证实RNA和蛋白质之间缺乏相关性。
(A) RNA和蛋白质的Pearson相关性。(B) 相关值的整体分布。(C) 负相关RNA和蛋白质的例子。(D) 将高斯混合模型(GMM)应用于RNA测序数据,并通过MS蛋白检测出重叠较低的RNA 。(E-F) 细胞系和异种移植物的低表达RNA和质谱蛋白鉴定的条形图。
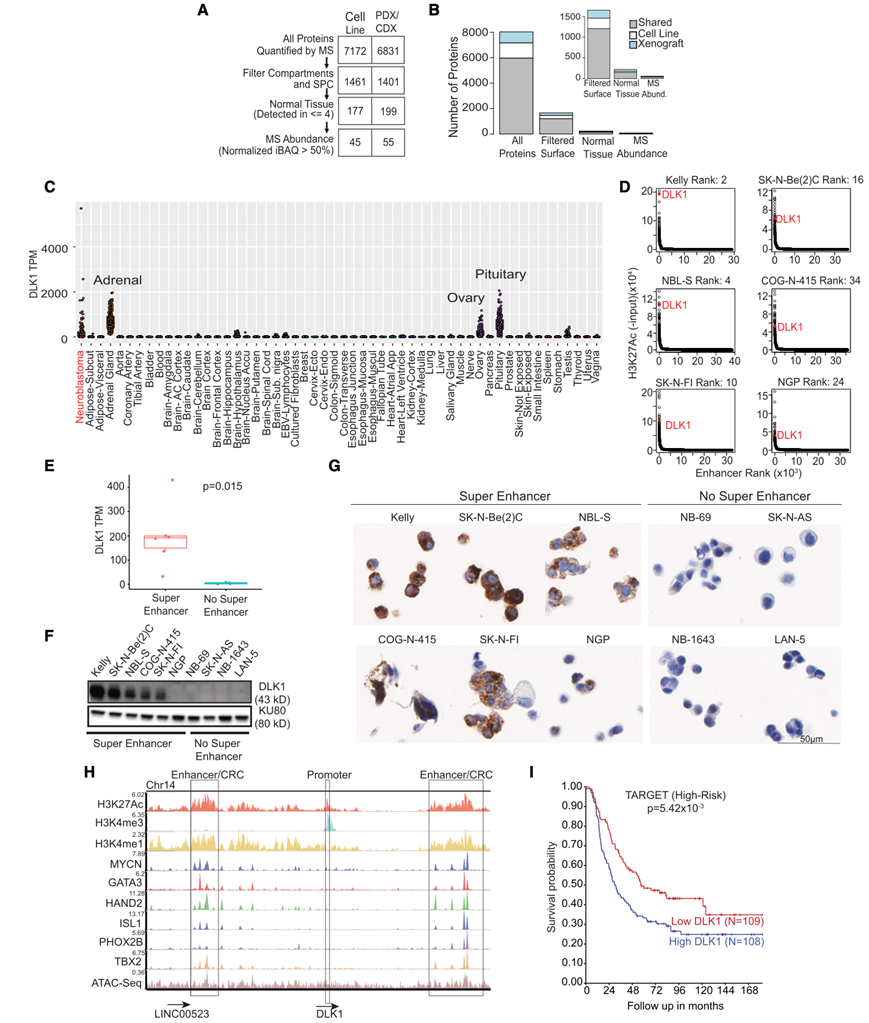
图1. DLK1 作为神经母细胞瘤免疫治疗候选靶点的优先顺序。
(A) 示意图显示质谱和 RNA-seq的整合,优先考虑细胞表面蛋白作为候选免疫治疗靶点。(B) 在每个优先排序步骤中在细胞系和异种移植中鉴定的蛋白质数量。(C) DLK1 RNA-seq数据表明,在神经母细胞瘤亚群中表达较高。(D) H2K27ac 信号的增强子等级图显示,神经母细胞瘤细胞系的一个子集具有超级增强子。(E-G) 通过 RNA 测序、免疫印迹和神经母细胞瘤细胞阵列的免疫组织化学测量,活性超增强子与更高的 DLK1 表达相关。(H) DLK1基因座的可视化,突出显示 SK-N-Be(2)C 中的 H3K27Ac、H3K4me1 和 H3K4me3 和 CRC 成员。(I) 高 DLK1 mRNA 表达与高风险神经母细胞瘤的较差无事件生存率相关。
图S3. 免疫治疗靶点和DLK1的优先排序。
(A) 优先目标的热图。(C-D)在两个独立的质谱数据集中进行了优先排序。(E-F)DLK1在细胞系中表现出强相关性,在异种移植物中表现出中度相关性。(G)与其他已知靶点相比,DLK1丰度列表的DLK1肽显示9/11是人类独有的。
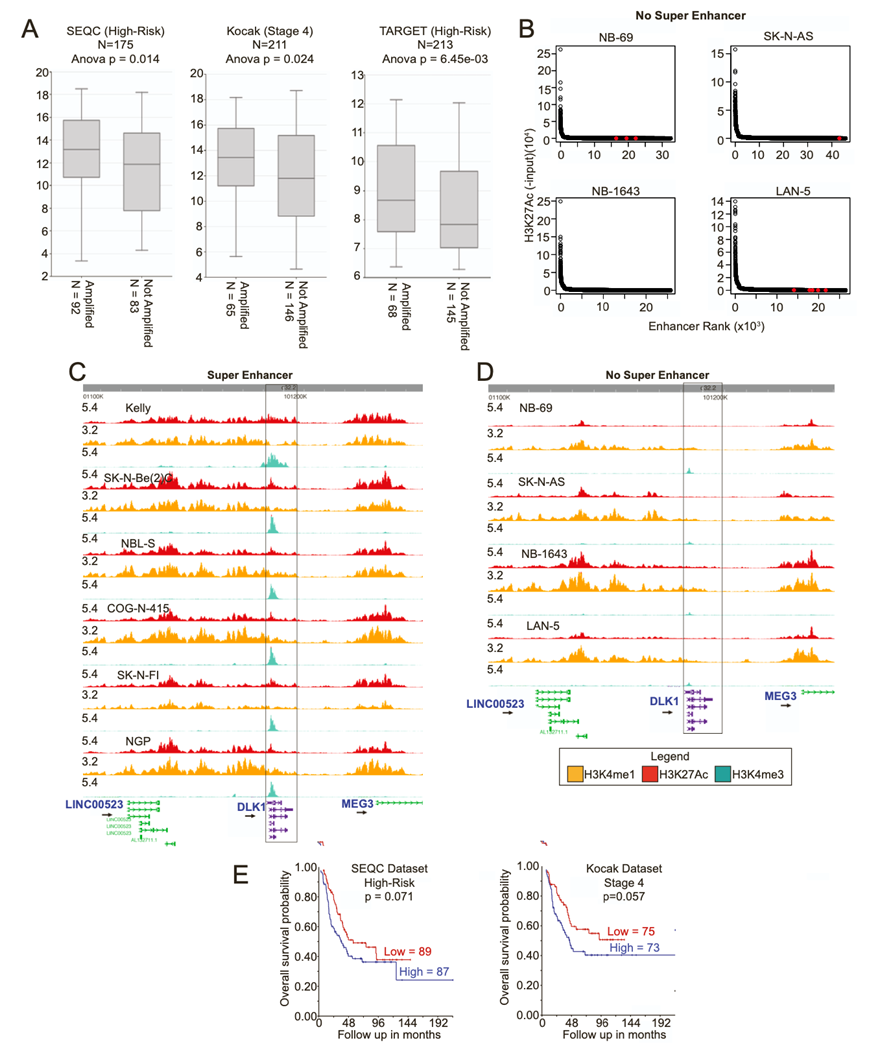
图S4. DLK1具有超级增强子,与MYCN状态无关,且与不良预后相关。
(A) DLK1和MYCN在三个队列高水平患者中的表达。(B) 增强子排名图根据LILY算法在细胞系中的峰值分数百分比对超级增强子进行排序。(C-D) 细胞系中DLK1位点的H3K27Ac, H3K4me1和H3K4me3的可视化。(E)生存分析。
02
DLK1 表面表达分析
为了评估 DLK1 是否适合免疫治疗靶向,他们试图验证其在神经母细胞瘤细胞表面的表达。为了确认 DLK1 的表面表达并证明 DLK1 抗体的特异性,他们对一组细胞系进行了免疫荧光 (IF) 和流式细胞分析,其中包括两种 DLK1 阳性神经母细胞瘤细胞系[SK-N-Be(2)C 和 NBL-S]、两种 DLK1 阴性神经母细胞瘤细胞系(NLF 和 NB-69)和两种 DLK1 阴性非神经母细胞瘤细胞系(HEK293T 和 SW620)。他们观察到 DLK1 与已知的细胞表面蛋白钙粘蛋白在 DLK1 阳性细胞中共定位,但在缺乏 DLK1 表达的细胞中则不显示共定位(图 2 A)。流式细胞分析证实 DLK1 的细胞表面表达仅限于具有高DLK1 mRNA 表达的细胞系(图 2 B)。
接下来,他们对儿童正常组织阵列和神经母细胞瘤异种移植(细胞和患者)阵列的样品进行了免疫组织化学 (IHC) 染色。为了评估表达和异质性,他们采用了改进的 H 分数(强度∗染色细胞百分比;范围 0-300)。总体而言,81.6% 的异种移植肿瘤的 H 分数高于 50。在正常儿童组织和神经母细胞瘤之间观察到 DLK1 的显著差异表达蛋白(图 2 C),并可视化 DLK1 阳性和阴性异种移植组织(图 2 D)。在肾上腺(1 个月龄患者)和垂体核心(70 个月龄患者)中均观察到 DLK1 表达。在神经母细胞瘤患者肿瘤中,抗体在肿瘤组织中的表现不如异种移植样本(异种移植中位数 = 200;肿瘤中位数 = 10)显著。其他正常组织显示出可忽略不计的染色。他们对整个肾上腺进行了染色以确定 DLK1 定位,在髓质嗜铬细胞中显示出强染色(H 评分:200–300)。为了识别其他 DLK1 阳性组织学,他们利用来自 Cancer Genome Atlas (TCGA) 和 Treehouse Childhood Cancer Initiative 的 RNA-seq数据来分析成人和儿童实体肿瘤中的 DLK1 表达。嗜铬细胞瘤/副神经节瘤、肾上腺皮质癌、肝母细胞瘤和几种肉瘤以及神经母细胞瘤的 DLK1 表达最高,而其他几种组织学类型在部分样本中表现出高表达(图 2 E)。
他们试图进一步探索高 DLK1 表达在神经母细胞瘤细胞分化中的作用,首先用全反式维甲酸 (ATRA) 处理神经母细胞瘤细胞系 SK-N-Be(2)C(MYCN扩增)和 SH-SY5Y(MYCN 未扩增),诱导终末分化。在抗体优化进行免疫印迹后,观察到 ATRA 诱导的分化导致 DLK1 蛋白表达降低(图 2 F)。接下来,他们在DLK1高表达细胞系 SK-N-Be(2)C 中进行了 shRNA 介导的DLK1沉默。使用两种针对 DLK1 的不同 shRNA (DLK1 _sh1;DLK1 _sh2 )沉默DLK1后,通过免疫印迹法进行确认,并与 shScrambled 对照 SK-N-Be(2)C 细胞进行比较[(DLK1 _sh1)和 S6B(DLK1 _sh2)](图2G)。转导后,与对照细胞相比, shDLK1处理的细胞中神经突形成增加(图 2G)。为了进一步分析这种表型,他们评估了神经突长度(分化)和细胞生长(增殖),与对照相比, sh DLK1细胞中神经突长度相对于细胞体显著增加(图 2H-I),细胞生长没有差异。最后,他们对 SK-N-Be(2)C shScrambled(对照)和 sh DLK1处理的细胞进行了完整的蛋白质组分析,发现 NOTCH3 上调和细胞周期下调与分化一致(图 2 J-K)。总体而言,这些数据证明 DLK1 表达在抑制细胞分化方面起着重要作用,可能维持肾上腺素能细胞状态。
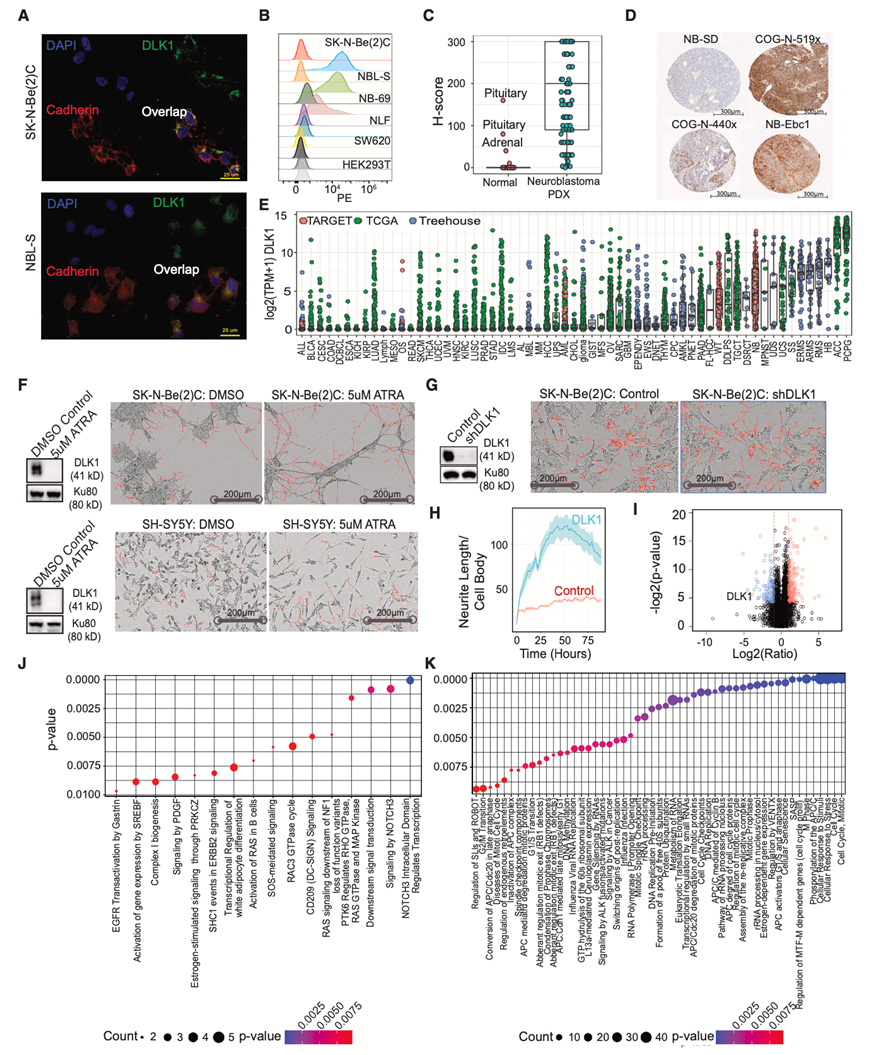
图2. DLK1 是一种在神经母细胞瘤中上调的细胞表面蛋白,在分化中发挥作用。
(A) 免疫荧光显示,在 DLK 表达高的细胞系中,DLK1(绿色)与细胞表面标志物钙粘蛋白(红色)共定位。(B)流式细胞分析。(C) 使用异种移植神经母细胞瘤和儿童正常组织的组织微阵列进行免疫组织化学分析。(D) 具有高和低 DLK1 表达的代表性神经母细胞瘤核心。(E) Treehouse 儿童癌症数据集中 DLK1 的表达。(F) 用全反式维甲酸 (ATRA) 处理的 SK-N-Be(2)C 和 SH-SY5Y 神经母细胞瘤细胞表现出 DLK1 表达缺失和诱导分化。用 DMSO 单独处理和用 5uM ATRA 处理的 SK-N-Be(2)C 和 SH-SY5Y 细胞的图像。(G) Western blot 表明 SK-N-Be(2)C 细胞中 DLK1 的敲低程度显著高于对照组。图中显示了对照组和 shDLK1 的图像。(H) Incucyte NeuroTrack 分析显示 shRNA DLK1 敲低后的分化表型(神经突长度)。(I) 对照和 shDLK1 细胞(生物和技术重复)的质谱分析表明 DLK1 是蛋白质组中第四大下调蛋白质。(J-K)DLK1 敲低显示 NOTCH3 上调和细胞周期下调,与分化一致。
03
ADCT-701 是一种靶向 DLK1 的 ADC,在体外表现出强大的内化和细胞毒性
为了研究靶向 DLK1治疗效果,他们采用了两种方法,包括使用和不使用吡咯并苯二氮卓 (PBD) 二聚体作为有效载荷的靶向 DLK1 的单克隆抗体。首先研究了靶向 DLK1 的单克隆抗体 HuBA-1-3D,这是一种针对人类 DLK1(非小鼠交叉反应)的人源化 IgG1 抗体,在四种神经母细胞瘤异种移植模型中具有抗肿瘤功效,这些模型具有高 DLK1 表达,但没有发现抗肿瘤功效的证据。接下来,他们测试了 ADCT-701,这是一种由 HuBA-1-3D 使用 GlycoConnect 技术与 PL1601 结合而成的抗体药物偶联物 (ADC),其中包含 HydraSpace、Val-Ala 可裂解接头和强效 PBD 二聚体细胞毒素 SG3199(图 3 A)。为了确定用于体外测试的细胞系并显示神经母细胞瘤以外的转化相关性,他们利用流式细胞确定神经母细胞瘤、急性淋巴细胞白血病 (AML)、横纹肌肉瘤 (RMS)、非小细胞肺癌 (NSCLC) 和肾细胞癌 (RCC) 中细胞表面蛋白拷贝数和抗体结合率 (EC50),这些细胞的表达水平各不相同(图 3B)。接下来,他们确定了八种细胞系的 IC50(图 3C)。为了验证 DLK1 依赖性内化,利用共聚焦显微镜确定 ADCT-701 或非靶向对照(绿色)与 LAMP1(溶酶体标记物,红色)的共定位。在 A204 细胞 (DLK1+) 中,观察到 ADCT-701 与 LAMP1 的强共定位(图 3 D),而非靶向对照 (B12-PL1601) 中则不存在这种共定位(图 3 E)。在 ADCT-701 处理的 DLK1 -细胞中未观察到这种共定位,表明存在 DLK1 依赖性内化(图 3 F)。最后,表面等离子共振 (SPR) 显示与人类和食蟹猴 DLK1 的结合相当(图 3 G)。
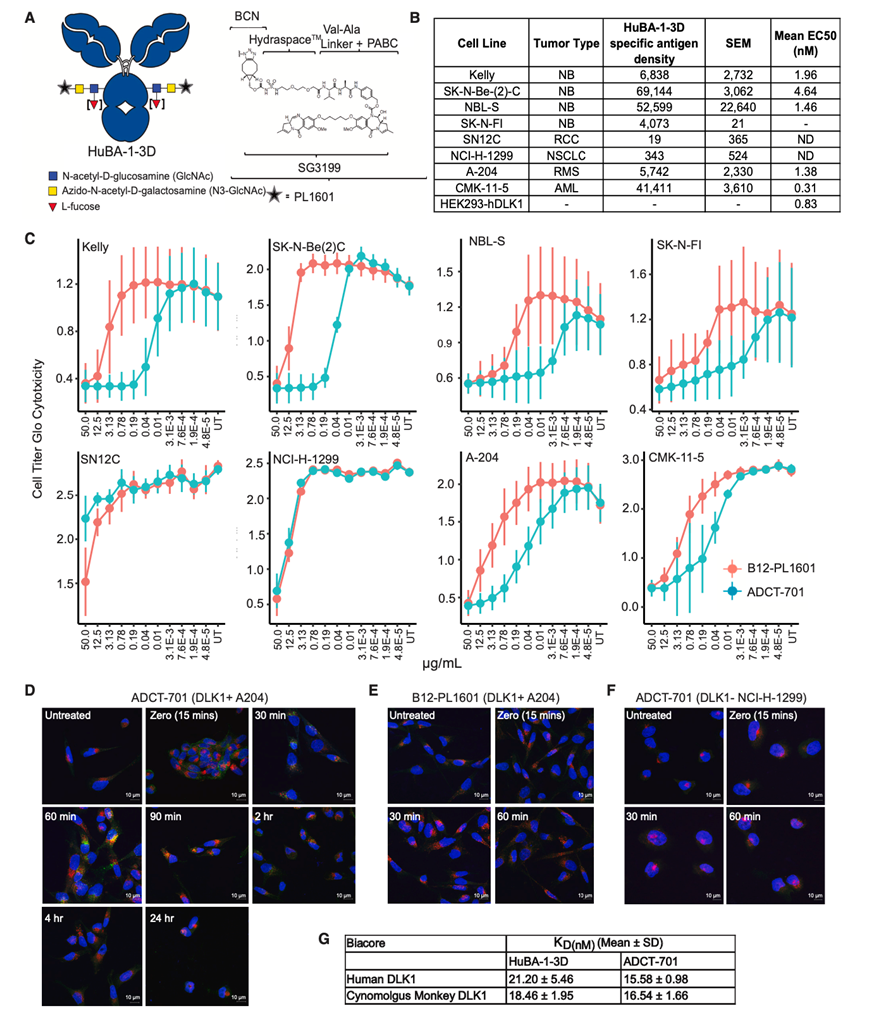
图3. ADCT-701 的表征显示结合、内化和细胞毒性。
(A) ADCT-701 药物结构由缬氨酸/丙氨酸连接体和 PBD 二聚体 SG3199 组成。(B)流式细胞分析。(C) DLK1 表达不同的细胞系的IC50。(D-E) 共聚焦显微镜显示 ADCT-701 与 A204 细胞(DLK1+ 细胞)中的 LAMP1 共定位,而非靶向对照 B12-PL1601 则不存在这种现象。(F) 共聚焦显微镜显示 NCI-H1299 (DLK1-) 细胞中没有 ADCT-701 内化。(G) 表面等离子体共振(SPR)显示出与人类和食蟹猴DLK1相当的结合。
04
ADCT-701 在人类神经母细胞瘤异种移植模型中表现出强效且特异的抗肿瘤活性
为了测试 ADCT-701 的疗效,他们根据 IHC 和 RNA-seq确定的高、中、低 DLK1 表达选择了十三个神经母细胞瘤异种移植肿瘤模型(图 4 A-B)。携带肿瘤的小鼠接受单剂量 1 mg/kg ADCT-701、B12-PL1601(一种靶向 HIV gp120 的非结合同种型对照抗体,与 PL1601 有效载荷结合,按照与 ADCT-701 相同的程序通过尾静脉注射生理盐水。高表达模型(Felix-PDX、COG-N-519x、Nb-EBc1、COG-N - 415x、NB-1691、COG-N-452x 和 COG-N-453x)表现出完全缓解,其中许多缓解在整个观察期(100 天)内都得以维持。NB-SD 和 COG-N-440x表现出进行性疾病。因此,ADCT-701 显示出强效且特异的抗肿瘤活性,这与神经母细胞瘤临床前模型中的 DLK1 表面表达相关(图 4 C)。在非肿瘤小鼠中单次静脉注射 1 mg/kg ADCT-701 后,对 ADCT-701 进行药代动力学 (PK) 分析,结果显示总抗体和 ADC(DAR ≥1)的曲线相当,表明体内稳定性高。未观察到毒性或体重减轻。
六种模型显示,在 ADCT-701 诱导的消退后,至少有一只小鼠的肿瘤重新生长(图 4 D)。两种肿瘤(COG-N-415x 和 Felix-PDX)在第二次注射 ADCT-701 后出现第二次完全缓解,这表明肿瘤保留了 DLK1 表达(图 4 D)。最初,COG-N-421x 显示病情稳定,COG-N-471x 显示完全缓解。为了评估 ADC 复发肿瘤中的 DLK1 表达,在肿瘤负荷终点之前收集这些样本,这些复发肿瘤在使用 ADCT-701 重新治疗时表现出短暂反应或病情稳定。第二次 ADC 治疗后收获的肿瘤通过 IHC 显示没有 DLK1 表达(COG-N-471x、COG-N-421x、COG-N-496x)。对于最初对 ADCT-701 治疗有反应的 DLK1 表达较高的模型,第二次给药后重新生长的肿瘤显示出强烈的 DLK1 染色(COG-N-519x 和 NB-1691),表明对该药物有耐药性。COG-N-519x 是 p53 突变,NB-1691 具有与 PBD 敏感性相关的 MDM2 扩增。综上所述,ADCT-701 在侵袭性神经母细胞瘤模型中表现出强效和特异性活性。
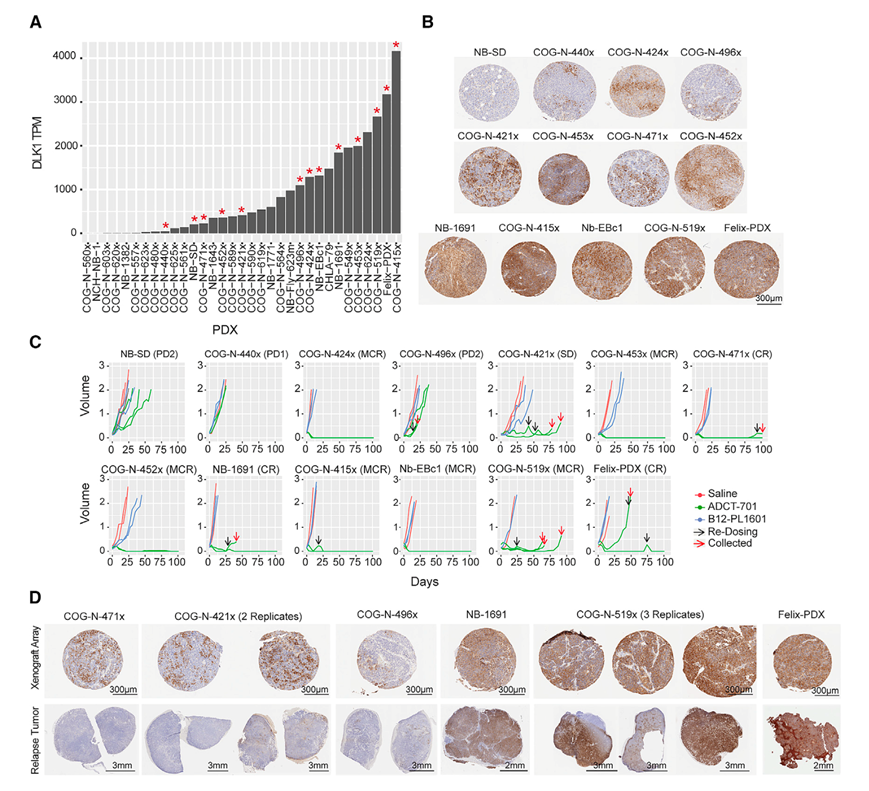
图4. ADCT-701 在表达 DLK1 的神经母细胞瘤模型中表现出特异性和强效的抗肿瘤活性。
(A) 通过 TPM 测量的 DLK1 RNA 水平。(B) 异种移植阵列的 DLK1 IHC 染色,不同模型中的 DLK1 表达各异。(C)检测盐水对照(红色)、非靶向对照 ADC-B12-PL1601(蓝色)和 ADCT-701(绿色)的肿瘤体积(cm 3)。 (D) CDX/PDX 阵列(上)的 IHC 与复发肿瘤(下)进行比较。
+ + + + + + + + + + +
结 论
本项研究对肿瘤和正常组织进行了综合蛋白质组学、转录组学和表观基因组学分析,以确定神经母细胞瘤(一种经常致命的儿童癌症)的生物学相关细胞表面免疫治疗靶点。蛋白质组学分析揭示了 60 个候选免疫治疗靶点,优先考虑DLK1进行进一步研究。DLK1 的高表达与SE直接相关。免疫荧光、流式细胞和免疫组织化学显示 DLK1 的细胞表面表达强劲。神经母细胞瘤细胞中短发夹 RNA 介导的 DLK1 沉默导致细胞分化增加。ADCT-701 是一种靶向 DLK1 的ADC,在表达 DLK1 的神经母细胞瘤异种移植模型中表现出强效且特异性的细胞毒性。由于在多种成人和儿童癌症中发现 DLK1 表达较高,本项研究证明了蛋白质组学方法的实用性,并证实 DLK1 可作为免疫治疗靶点。
+ + + + +



 English
English


