文献解读|Cell Host Microbe(30.3):源自老年人肠道微生物组的特定肠型能够对免疫检查点阻断疗法产生良好反应
✦ +
+
论文ID
原名:A specific enterotype derived from gut microbiome of older individuals enables favorable responses to immune checkpoint blockade therapy
译名:源自老年人肠道微生物组的特定肠型能够对免疫检查点阻断疗法产生良好反应
期刊:Cell Host & Microbe
影响因子:30.3
发表时间:2024.03.20
DOI号:10.1016/j.chom.2024.03.002
背 景
关于免疫检查点阻断(ICB)对老年癌症患者疗效的临床数据是有希望的,但尚无定论。免疫疗法彻底改变了癌症治疗,但不一致的反应仍然存在。越来越多的证据表明,肠道微生物群可能通过促进细菌易位或释放细菌来源的分子来增强抗原性并促进抗肿瘤免疫反应,从而影响程序性细胞死亡1 (PD-1)/程序性细胞死亡配体1 (PD-L1)阻断。有证据表明,PD-1/PD-L1阻断患者体内富含特定微生物,而其他微生物则与无反应性相关。然而,肠道微生物群在个体之间表现出显著的变异性,但对于其潜在的分子机制仍然是未知的。
实验设计
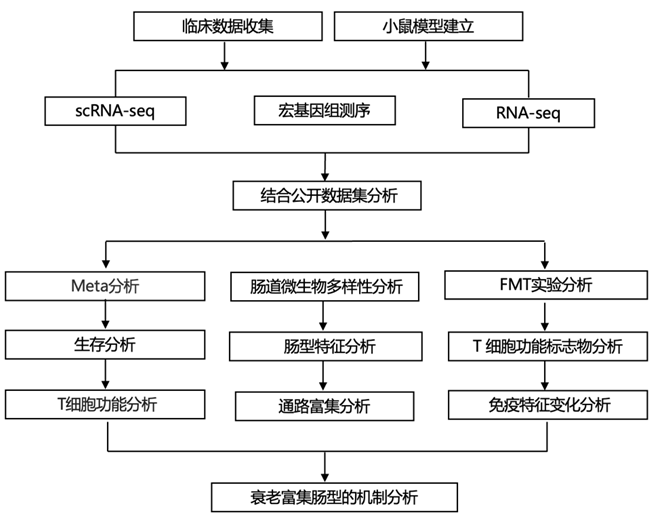
结 果
01
衰老过程与 ICB 治疗的反应和患者的生存时间相关
为了全面研究年龄、ICB 反应和生存之间的关系,研究者团队最初收集了 25 项涉及 ICB 治疗的研究的临床数据,其中包括 2985 名癌症患者的发现队列(图 1 A-B)。结果显示,随着年龄的增长,具有持久临床获益(DCB)和总体缓解率的患者百分比有所增加,与年轻患者(≤60岁)相比,老年患者(> 60岁)表现出更高的 DCB 和缓解率(图1C-D)。在黑色素瘤、非小细胞肺癌 (NSCLC) 和透明细胞肾细胞癌 (ccRCC) 等个体癌症类型中观察到 DCB 趋势。
为了减少个别研究之间的偏差,他们对这些研究进行meta分析,结果显示研究间不存在统计学上显著的异质性, 此外,他们观察到老年(>60岁)和年轻(≤60岁)患者之间的总体反应率存在显著差异,表明老年患者对 ICB 治疗表现出更高的反应(图1E)。重要的是,当与其他临床因素平衡时,包括性别、ICB 策略和使用 PSM 方法的癌症类型,老年患者和年轻患者之间的反应和 DCB 仍然存在显著差异(图 1 F)。
限制性立方样条(RCS) 的多元 Cox 模型用于生存分析,将传统的 Cox 比例风险回归扩展到包括多个预测变量,其中一些变量可能与风险率具有复杂的非线性关系。研究人员可以评估各种协变量(包括连续协变量)对生存的影响,同时适应非线性。他们利用这些模型来研究年龄和患者生存率之间的关系,并调整适用于发现队列中大多数患者的相关临床特征,如性别、药物使用和癌症类型(图 1 G)。RCS 分析显示,年龄和 PFS 之间几乎呈线性关联,风险比 (HR) 随着年龄的增长而不断降低(图 1 G)。随着患者年龄达到 60 岁左右,HR 开始下降至 1.00 以下(图 1 G)。患者的年龄和总生存期 (OS) 之间几乎呈线性相关,但随着年龄的增长,HR 不断增加(图 1H)。
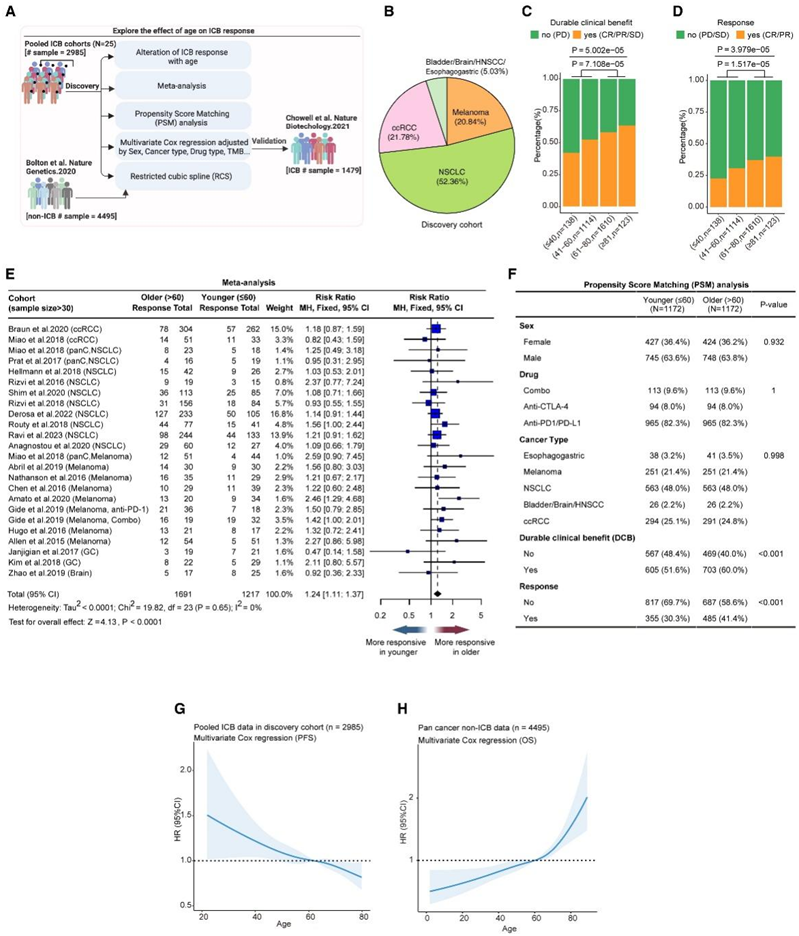
图1. 衰老与 ICB 治疗患者的 ICB 反应和生存时间相关。
(A) 临床数据分析的工作流程。(B) 饼图显示发现队列中癌症类型的比例。(C-D) 堆积图显示发现队列中每个年龄范围具有持久临床获益或缓解的患者比例。(E) 森林图显示老年 (>60岁) 和年轻 (≤60岁) 癌症患者之间 ICB 反应率差异的meta分析结果。(F) 通过在发现队列中进行倾向评分匹配分析,比较老年组和年轻组之间的临床差异的RCS。(G-H)对接受ICB治疗的癌症患者的无进展生存期(PFS)和未接受ICB治疗的癌症患者的总生存期(OS)进行多变量Cox比例风险回归分析。
02
衰老过程中 T 细胞会发生动态变化
在临床环境中,PD-1/PD-L1的表达水平已用作肿瘤突变负荷(TMB)的替代指标,以评估免疫治疗药物的适用性。为了在单细胞水平上验证 T 细胞与年龄相关的功能变化,他们从涵盖各种癌症类型的另外 169 个样本中收集了单细胞转录组分析(scRNA-seq)数据。来自老年患者的T细胞显示出更高的衰竭和细胞毒性评分(图2A),这在另一个非小细胞肺癌、结直肠癌(CRC)、胃癌(GC)和肝细胞癌(HCC)队列以及泛癌症水平上得到了进一步验证(图2B-N)。这些结果表明,T细胞功能的改变可能有助于在老年患者中观察到的对ICB治疗的反应性增强。
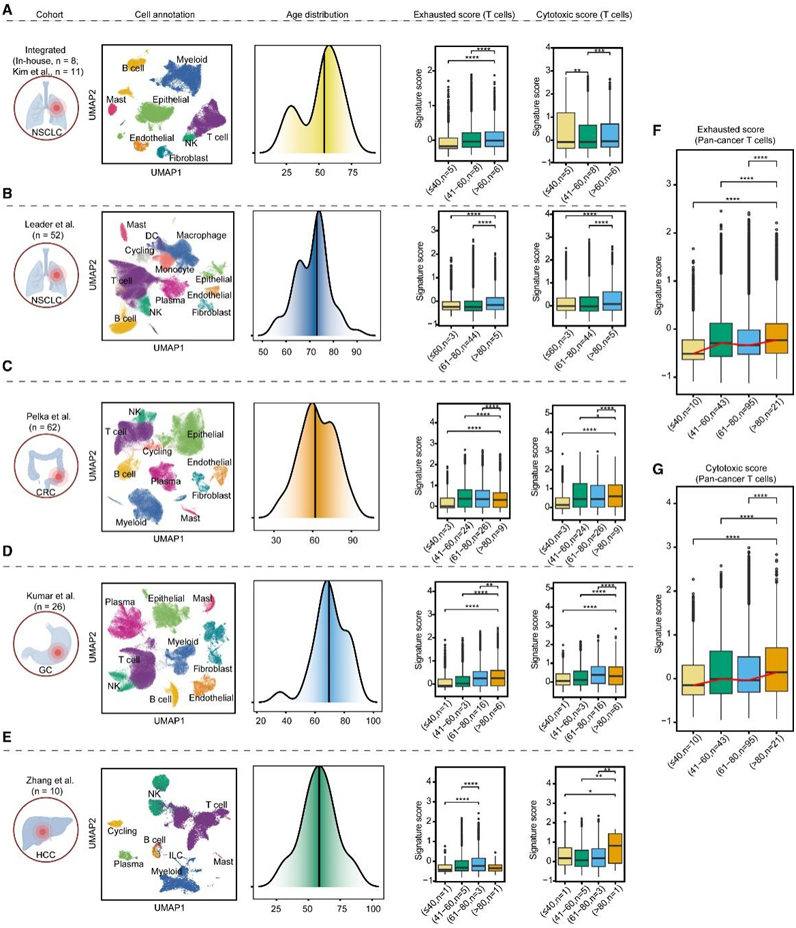
图2. 衰老过程中 T 细胞功能状态发生动态变化。
(A–E) 来自五项研究的 scRNA-seq 数据,包括整合性 NSCLC、独立 NSCLC、CRC、GC和 (HCC) 队列。(F-G) 箱线图显示了各个年龄组之间在泛癌水平上两个 T 细胞特征评分的差异。
03
与衰老相关的 T 细胞改变可能是由肠道微生物介导的
为了评估年龄相关的T细胞差异和对ICB的反应是否可以在动物模型中复制,他们在年龄较小(6-8周)和年龄较大(14个月)的雄性小鼠中建立了MC38移植瘤模型(图3A)。与对照组相比,抗pd -1治疗显著降低了年轻和老年小鼠的肿瘤生长(图3B)。重要的是,对肿瘤生长的抑制效率在老年小鼠中比在年轻小鼠中更为明显(图3B)。他们通过流式细胞分析观察到,与年轻小鼠相比,老年小鼠中PD-1标记的耗尽CD8+ T细胞的浸润增加(图3C)。与年轻的荷瘤小鼠相比,抗pd -1治疗在老年荷瘤小鼠中可能更有效。
鉴于越来越多的证据强调肠道微生物群在免疫调节和ICB治疗疗效中的关键作用,再加上肠道微生物群对衰老反应的波动性质,他们假设老年患者的肠道微生物群可能在增强ICB反应中发挥作用。为了验证这一点,他们在抗pd -1治疗前对上述荷瘤小鼠的粪便进行了宏基因组测序(图3A)。宏基因组数据表明,老年小鼠和年轻小鼠之间的肠道微生物群落存在显著差异,不同的α和β多样性表明,细菌类群如Akkermansia muciniphila差异富集,它们在ICB治疗应答者中富集(图3D-E)。
为了将肠道微生物群与年龄联系起来,它们收集了来自7个队列的807个样本的临床和宏基因组数据,这些患者接受了ICB治疗(图3F)。其中,它们分析了来自两项研究的25名抗pd -1难治性黑色素瘤患者的临床数据,这些患者接受了黑色素瘤应答者的粪便微生物群移植(FMT),随后接受了抗pd -1治疗。
此外,鉴于先前的研究表明抗生素(ATB)的使用主要是由于其杀死细菌的作用而对ICB治疗的疗效产生潜在影响,通过考虑ATB的使用来比较老年和年轻患者的反应率。研究结果显示,在未接受ATB的患者中,老年患者的反应率(65%)明显高于年轻患者(48%),而接受ATB的老年患者的反应率(35%)往往低于年轻患者(52%)(图3G)。最后,他们整合了宏基因组数据,考虑了来自个体队列的批次,并进一步与临床变量(包括ICB反应和年龄)联系起来(图3F)。在考虑ICB反应和年龄时,肠道微生物组组成(β多样性)不同(图3H-J)。总的来说,这些结果强调了肠道微生物群可能参与提高老年患者ICB反应率,并证明了肠道微生物群介导的ICB疗效的潜在作用。
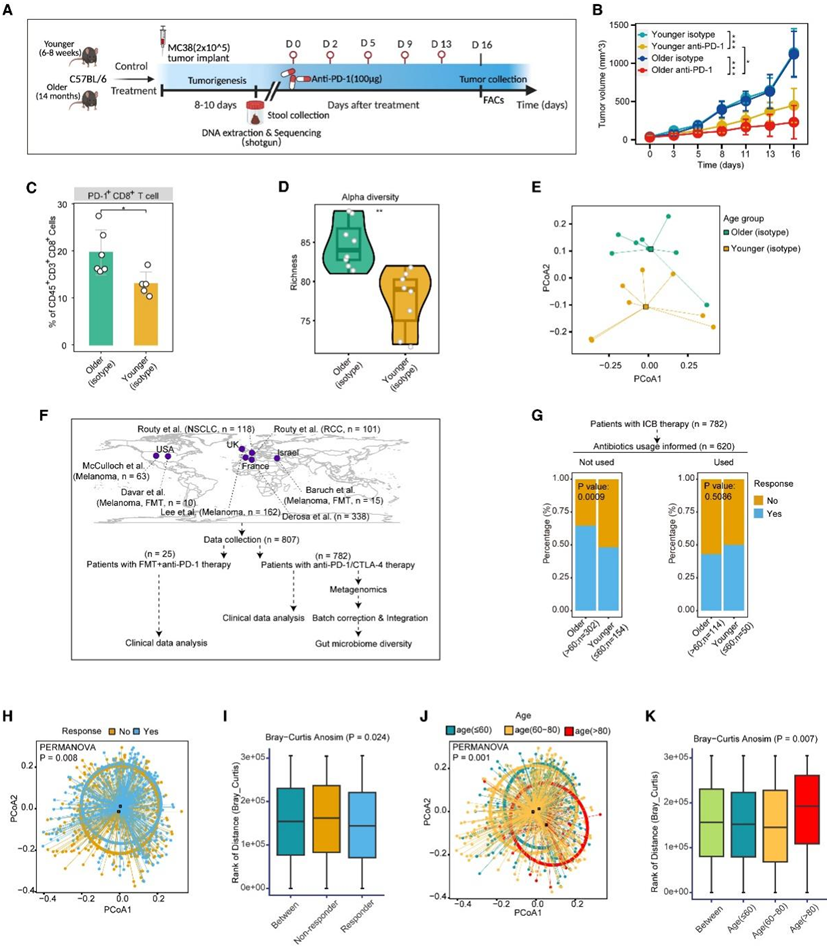
图3. 与衰老相关的 T 细胞改变可能是由肠道微生物介导的。
(A) 小鼠实验的工作流程。(B) 老年和年轻小鼠中 MC38 肿瘤的生长动力学。(C)对照组老年和年轻 MC38 肿瘤之间PD-1 + CD8 + T 细胞的比例比较。(D) 小提琴图,比较老年小鼠和年轻小鼠之间的 α 多样性(丰富度)差异。(E) PCoA 图显示老年小鼠和年轻小鼠之间 β 多样性的差异。(F) 显示样本收集和分析主要步骤的工作流程。(G) 比较老年和年轻患者在抗生素使用方面的反应率的堆积图。(H-J) PCoA 图显示了有无反应组和各年龄组之间 β 多样性的差异。(I-K) Bray-Curtis 距离的箱线图。
04
衰老富集的肠型与对ICB治疗的反应有关
通过对整合的宏基因组数据进行聚类,他们发现了三组样本,即肠型(图4A-C),这些肠型之间的α多样性是独特的(图4D-E)。当比较不同年龄组的肠型分布时,他们发现一种肠型的比例随着年龄的增长而增加,因此将其称为衰老富集肠型(E/AE),而其余两种则是衰老耗竭肠型(E/AD) 1和2(图4C-F)。此外,E/AE患者往往对ICB治疗更有反应(图4G)。与E/AD相比,E/AE主要富集了拟杆菌属 (B. uniformis、 B. dorei/vulgatus、B. fragilis、B. ovatus和 B. thetaiotaomicron)、Alistipes(A. finegoldii和A. putredinis)、瘤胃球菌属 (R. bicirculans和R. bromii)、Parabacteroides (P. merdae和P. distasonis)、Bilophila wadsworthia、Adlercreutzia equolifaciens、Akkermansia muciniphila, Faecalibacterium prausnitzii和Bifidobacterium bifidum(图4H)。这些细菌大多数与增强对ICB治疗的反应有关。相比之下,E/AD中富集了梭状芽孢杆菌、粪杆菌、厚壁菌属和普雷沃氏菌(P. copri和P. lascolaii)(图4G)。
为了探讨 E/AE 肠型中 T 细胞状态如何变化,他们收集了 25 名肺腺癌患者的配对肿瘤组织和粪便样本,分别用于RNA-seq和宏基因组测序(图4I)。他们随后开发了一个中心点分区 (PAM) 分类器,根据宏基因组数据,使用派生的肠型将这些样本分类为不同的肠型。正如预期的那样,预测的 E/AE和 E/AD肠型之间的 α 和 β 多样性均显著不同(图 4 J-K)。E/AE 比 E/AD 具有更高的耗竭和细胞毒性评分(图 4 L-M)。此外,基因集富集分析(GSEA)表明,E/AE显示了参与炎症、干扰素(IFN)-γ反应和核因子κB (NF-κB)介导的肿瘤坏死因子α (TNF-α)信号通路的上调(图4N)。
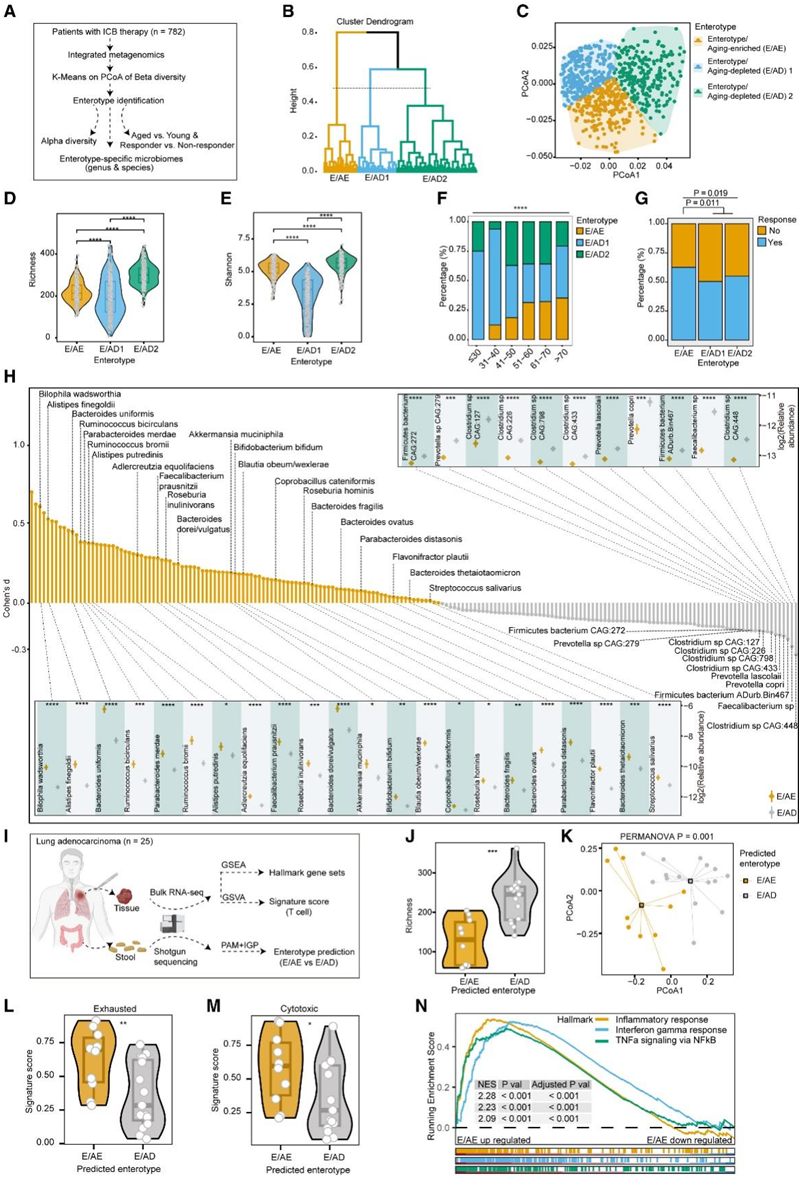
图4. 衰老富集肠型与 ICB 治疗的反应相关。
(A) 识别肠型的工作流程。(B) 聚类树状图,显示基于层次 k 均值聚类的聚类,其中树可以分为三个聚类。(C) 点图描绘了根据距离矩阵执行的前两次主坐标分析 (PCoA) 中每个样本的坐标。(D-E) 根据不同肠型的丰富度和α 多样性指数的小提琴图。(F-G) 堆积条形图,显示不同年龄范围或 ICB 反应的肠型样本频率。(H) 条形图显示两种肠型之间丰富物种的差异。(I) 显示内部肺腺癌队列分析的工作流程。(J) 小提琴图显示预测肠型之间的α多样性(丰富度)。(K) PCoA 图显示预测肠型之间 β 多样性的差异。(L-M)小提琴图比较了预测肠型之间 T 细胞耗竭和细胞毒性的特征分数。(N) GSEA 图显示了预测的 E/AE 中三个上调的标志信号通路。
05
衰老富集肠型的 FMT 增加抗 PD-1 治疗的反应
鉴于在 E/AE 肠型中观察到的 ICB 反应增强,他们试图探究 E/AE 个体的肠道微生物群落是否可能增强 ICB 反应。为了研究这一点,他们开发了一个执行 FMT 实验流程(图 5 A)。他们招募了五个年轻(年龄< 30)和5个年老(年龄> 70)的健康志愿者,并收集他们的粪便进行宏基因组测序,随后应用肠道型PAM分类器。4个和6个供体分别预测为E/AE和E/AD(图5B),这在很大程度上跨越了获得的肠型的多样性。他们选取富度较高的老年组和年轻组预测E/AE和E/AD供体进行FMT实验(图5C)。具体来说,用ATBs处理C57BL/6小鼠,并通过灌胃转移供体来源的粪便物质,小鼠植入MC38细胞并接受抗pd -1治疗(图5D)。无论供体年龄如何,与接受 E/AD 供体 FMT 的小鼠相比,接受 E/AE 供体 FMT 的小鼠肿瘤生长(肿瘤体积和重量)显著减少(图 5E-F)。
之后,他们对 FMT 程序完成后收集的小鼠粪便样本进行了 16S rDNA 测序分析(图 5D)。接受 E/AE 和 E/AD 供体 FMT 的小鼠之间的细菌植入率相当(图 5G)。虽然这两组之间的α多样性没有统计学意义(图5H),但β多样性在种和属水平上均表现出显著差异(图5I-J)。他们还发现在E/AE fmt衍生小鼠中富集了Bilophila wadsworthia、Bacteroides ovatus、Bacaeroides uniformis, Adlercreutzia equolifaciens和 Akkermanisia muciniphila等众多细菌(图5K-O)。这些结果表明,这些细菌可能在增强抗pd -1治疗的反应中起关键作用。
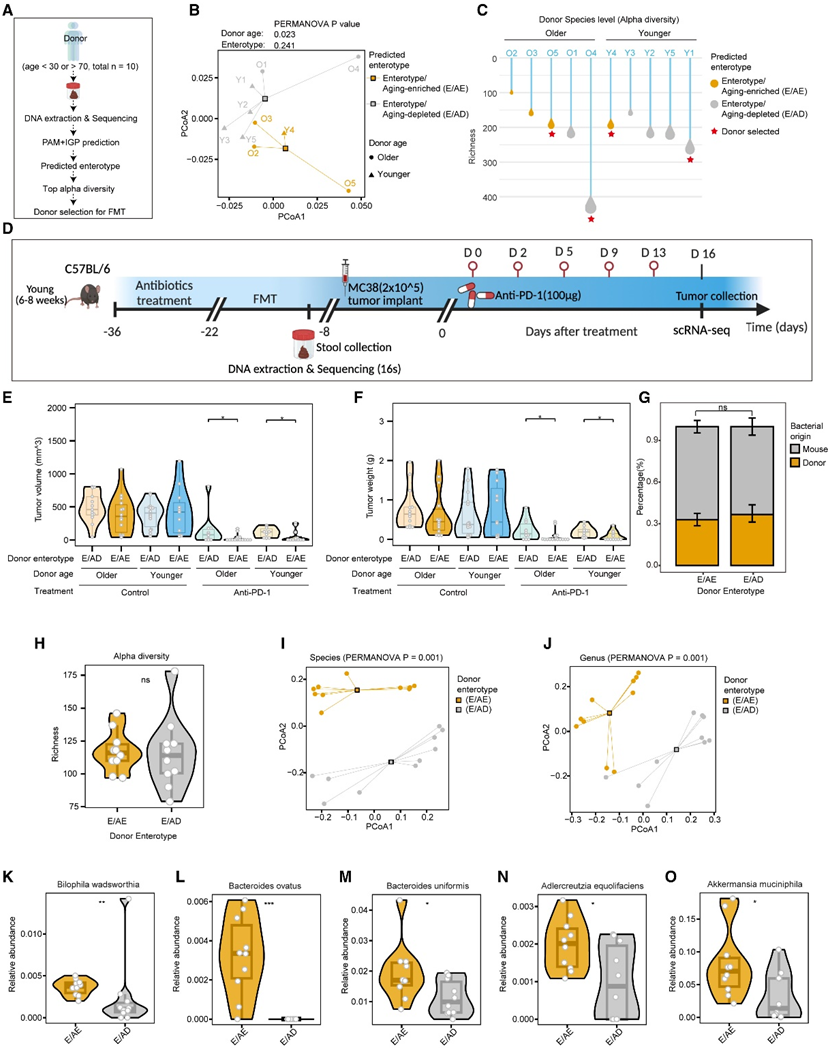
图5. 富含衰老肠型的 FMT 增加抗 PD-1 治疗的反应。
(A) FMT 实验供体选择的工作流程。(B) PCoA 图显示供体预测肠型之间 β 多样性的差异。(C) 雨点图显示每个捐赠者的 α 多样性(丰富度)。(D) 从人类供体到小鼠的 FMT 工作流程。(E-F) 小提琴图,显示标有供体来源(E/AE 与 E/AD)、供体年龄(较老与较年轻)和治疗的各组的 MC38 肿瘤体积和重量。(G) 堆积图显示每种肠型的植入率。(H) 小提琴图显示来自 E/AE 和 E/AD 供体的小鼠之间的 α 多样性。(I-J) PCoA 图显示 E/AE 和 E/AD 供体小鼠之间 β 多样性的差异。(K-O) 小提琴图,比较来自 E/AE 和 E/AD 供体的小鼠之间选定物种的相对丰度差异。
06
衰老富集肠型的 FMT 和抗 PD-1 疗法可增加 T 细胞的细胞毒性和 TCR 克隆
接下来,他们通过针对 CD45 +细胞进行 scRNA-seq 和 T 细胞受体 (TCR) 测序(TCR-seq),描述了来自 E/AE 和 E/AD 供体的 FMT 加上抗 PD-1 治疗后 MC38 肿瘤的免疫变化(图 6 A)。根据典型标记将细胞注释为T细胞、自然杀伤细胞(NK)、髓细胞、肥大细胞和气孔细胞(图6B-C)。他们观察到接受E/ ae来源的FMT和抗pd -1治疗的小鼠中总T细胞的比例增加(图6D)。此外,通过关注T细胞,他们发现这些增加的T细胞主要是CD8 效应T细胞,它们具有T细胞细胞毒性相关的基因标记,包括Gzmk、Prf1和ifn诱导基因Ifit1,它们显示出相对较高的T细胞特征评分(图6E-G)。
值得注意的是,他们还观察到,在E/AE加抗pd -1处理的小鼠中,Foxp3标记的免疫抑制T调节(Treg)细胞比例下降(图6G)。一般来说,E/AE +抗pd -1处理小鼠的T细胞表现出更高的抑制和细胞毒性标志物(图6H)。具体来说,在接受E/AE供体FMT和抗pd -1治疗的小鼠的CD8+ T细胞中,耗竭和细胞毒性的T细胞特征评分最高(图6I-J)。单细胞TCR分析是一种在单细胞水平上检测T细胞受体多样性和特异性的方法。T 细胞受体是适应性免疫系统的重要组成部分,在识别和响应不同抗原(包括病原体和癌细胞)方面发挥着关键作用。最后,在分析 TCR 分析时,观察到 CD8 + T 细胞中的主要克隆扩增(图 6 K),并且来自 E/AE 加抗 PD-1 治疗小鼠的 T 细胞具有更多 TCR 克隆(图 6 L)。总的来说,这些结果表明,FMT 后给予抗 PD-1 有效提高了 CD8+ T 细胞的比例及其相关的细胞毒活性,从而增强了肿瘤杀伤作用(图6M)。
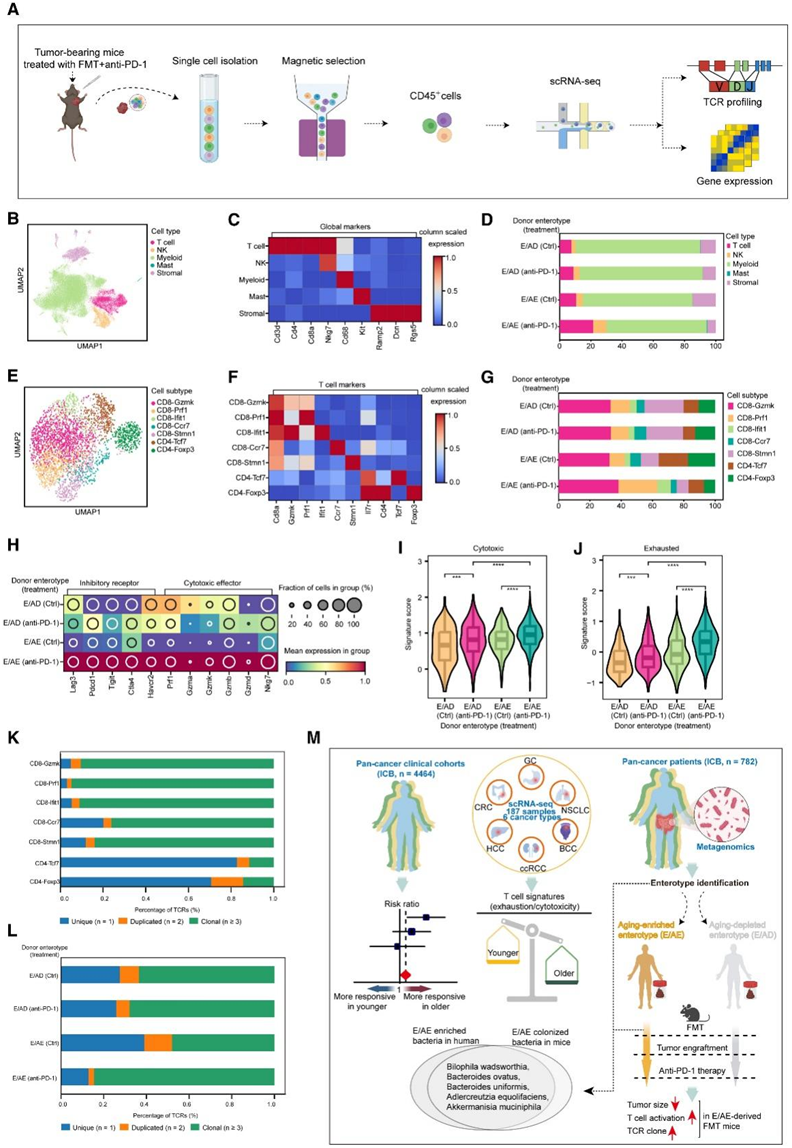
图6. FMT 和抗 PD-1 治疗后的免疫改变。
(A) 小鼠 scRNA-seq 数据分析的工作流程。(B-E) UMAP 图显示所有单细或 T 细胞。(C,F) 热图显示细胞主谱系或 T 细胞亚群的细胞标记物的表达谱。(D,G) 堆积图显示按相应供体肠型和治疗分隔的小鼠组中细胞类型的比例。(H) 热图显示小鼠组中 T 细胞功能标记的表达。(I-J) 小提琴图比较了小鼠组间细胞毒性和耗竭 的 T 细胞特征评分的差异。(K-L) 堆积条形图,显示不同 T 细胞亚型或小鼠组中 T 细胞的 TCR 分布。(M) 本研究主要发现的总结。
+ + + + + + + + + + +
结 论
本项研究通过一项包含 25 项中小型免疫检查点阻断 (ICB) 试验的meta分析,证明老年人对 ICB 疗法表现出更高的反应性,还分析了多项研究的scRNA-seq数据,并揭示了老年患者TME中耗竭和细胞毒性 T 细胞标记物的明显上调。本项研究确定了一种与改善老年患者免疫治疗结果相关的衰老肠道型。小鼠粪便微生物群移植实验证实了富含衰老肠型的治疗潜力,可增强治疗敏感性并重塑 TME。
+ + + + +



 English
English


