文献解读|Nature(64.8):空间组织的细胞群落形成发育中的人类心脏
✦ +
+
论文ID
原名:Spatially organized cellular communities form the developing human heart
译名:空间组织的细胞群落形成发育中的人类心脏
期刊:Nature
影响因子:64.8
发表时间:2024.03.13
DOI号:10.1038/s41586-024-07171-z
背 景
心脏是第一个发育的器官,其功能高度依赖于其形态。然而,不同的心脏细胞类型如何在空间上协调以创建对心脏功能至关重要的复杂形态结构仍不清楚。
实验设计
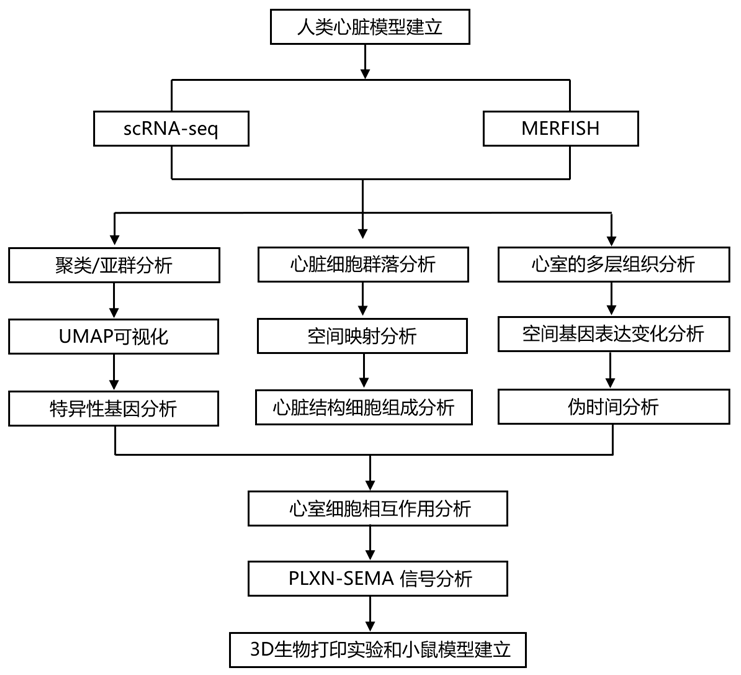
结 果
01
人类心脏发育中的细胞谱系
为了研究不同的心血管细胞类型如何协调形成对调节人类心脏功能至关重要的复杂结构,研究者团队最初研究并确定了构成发育中的人类心脏的特定细胞谱系。为此,在受孕后 9 至 16 周 (pcw:受孕后的周数) 之间对人类心脏进行了单细胞转录组分析(scRNA-seq)(图1a,图S1a)。由于这些发育中的心脏比成人心脏小得多,因此他们将每个收集的心脏都解剖成完整的心室和室间隔 (IVS),以增加通过 scRNA-seq 识别更多细胞类型或状态(包括稀有细胞群)的可能性,尤其是在心房等代表性不足的区域(图S1a)。通过 scRNA-seq 分析了从这些心脏样本中收集的 142946 个单细胞,并在转录上分为以下五个不同的细胞区室:心肌细胞、间质细胞、内皮细胞、血液和神经元细胞(图1a)。基于图形的聚类和基因标记分析确定了细胞区室中的 12 个主要细胞类别(图1a、图S1b-d)。从这些隔室中进一步聚集的细胞确定了39个细胞群,这些细胞群又细分为75个亚种群,并对其准确性进行了评估(图S1a)。
接下来,他们探讨了指导心脏形态发生和重塑的相互作用细胞机制,包括心室壁的发育。他们应用多重抗差错荧光原位杂交 (MERFISH)成像技术来研究在心室壁发生动态重构,特别是心肌壁压实的发育时期,scRNA-seq鉴定的心血管细胞的空间组织。他们对 12-13 pcw 的人类心脏的冠状切片进行了 MERFISH 研究,捕获了主要的心脏结构(图1b-d)。
为了从这些 MERFISH 研究中识别特定的细胞群,他们对 MERFISH 单细胞表达数据应用了半监督、基于图形的聚类方法(图1c)。该聚类的心脏基因标记分析揭示了27个不同的MERFISH细胞群,这些细胞群与scRNA-seq发现的发育类别密切相关,除了血小板-红细胞,这可能是因为MERFISH基因库中排除了它们的标记基因(图1c-d)。scRNA-seq和MERFISH数据集的整合揭示了数据集之间相关细胞的强烈对应性,这有助于对MERFISH检测之外的其他基因进行插补和空间定位(图1e-g)。
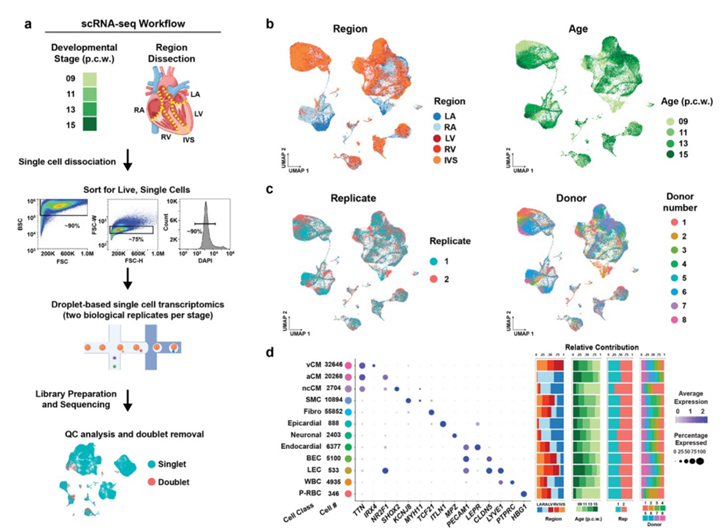
图S1. 开发人类心脏scRNA-seq实验细节。
(a) scRNA-seq工作流程说明了如何根据发育时间和区域收集样本。(b-c)UMAP可视化。(d) 关键标记基因的点图确定了每个细胞类别及其在年龄,区域,复制和供体中的分布。
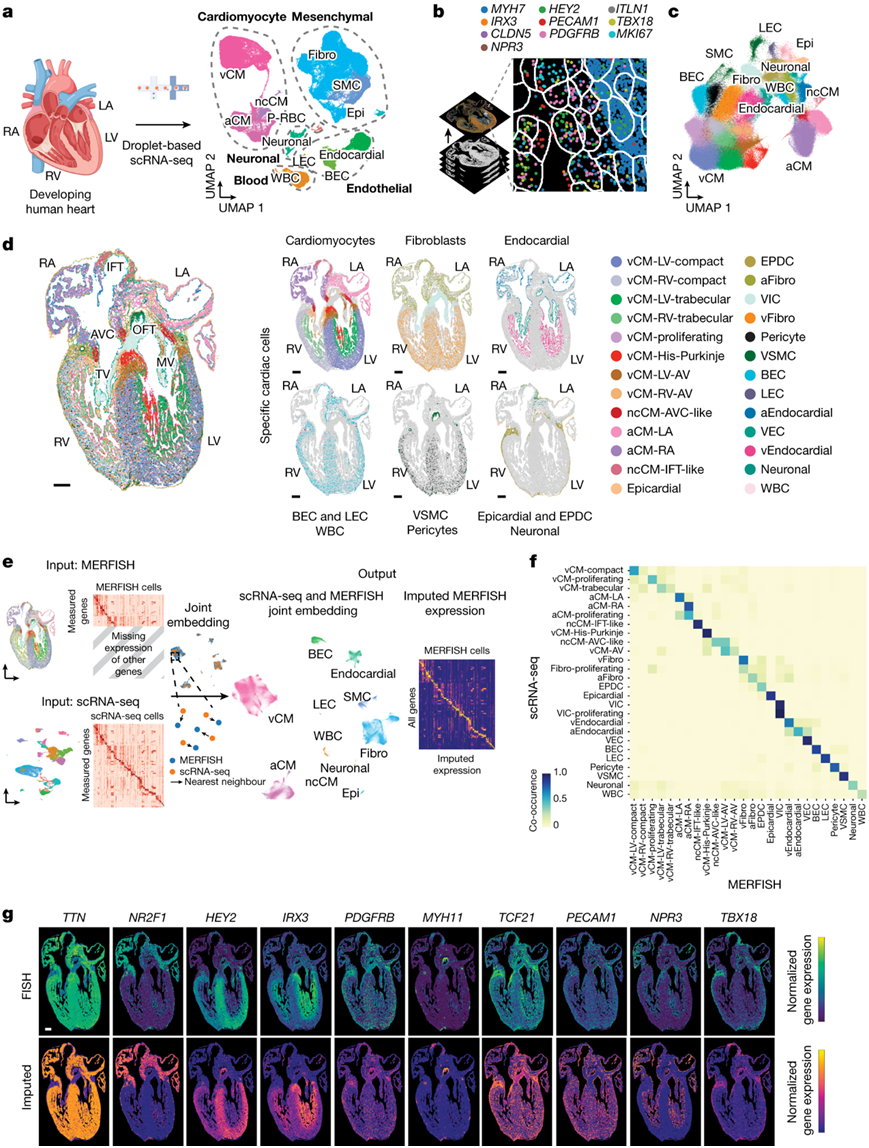
图1. 分子和空间人类心脏细胞图谱揭示了心脏发育过程中的多种细胞群。
(a) 左:实验示意图。右图:scRNA-seq 识别了多种不同的心脏细胞,这些细胞形成了发育中的人类心脏。 (b) 示意图显示了如何使用 MERFISH 在空间上识别 238 个心脏细胞特异性基因。(c) 大约 250000 个 MERFISH 识别的心肌细胞聚集成特定的细胞群。(d) 将识别出的 MERFISH 细胞在 13 pcw心脏的额叶部分进行空间映射(左),并根据主要细胞类别进行显示(右)。(e) MERFISH 和年龄匹配的 scRNA-seq 数据集之间的联合嵌入实现了细胞特征转移和 MERFISH 基因插补。(f) 共现热图显示了MERFISH细胞注释与从13 pcw的 scRNA-seq数据集中转移的细胞注释的对应关系。 (g) 通过比较MERFISH测量的标记基因归一化基因表达谱与相应的输入基因表达谱,在空间上验证基因输入的效果。
02
细胞群落形成心脏结构
接下来,他们试图了解特定的心血管细胞如何组装成细胞邻域,从而形成对心脏功能至关重要的有组织的多细胞谱系结构。为此,他们确定了心脏区域,这些区域在空间上由共分离细胞群[“细胞群落”(CC)]的不同组合组成。心脏每个细胞的细胞邻居定义在150µm的半径内,这代表了单个细胞的细胞外信号分子的典型扩散“区域”(图2a)。他们确定了大约25万个细胞区,并根据这些细胞区的细胞组成分为13个不同的cc(图2b)。这些检测到的CCs映射到发育中的心脏,对应并定义了高单细胞粒度的心脏的特定结构,包括已知的和不太熟悉的心脏结构(图2b-c)。每个CC由不同的组合和特定细胞的数量组成,并显示出广泛的细胞复杂性和纯度。例如,一些cc只包含一个或两个细胞群,而另一些则包含十个以上的细胞群(图2d-f)。与在心室中观察到的比在房室中观察到的更大的细胞复杂性相一致,5个cc位于心室,2个位于心房(图2c)。两个心房cc分别对应左心房和右心房,分别由左心房和右心房的心房心肌细胞(aCM)、心房成纤维细胞(aFibro)、心内膜细胞、心外膜细胞和神经元细胞组成(图2c-d)。相比之下,心室可分为5个与左右心室壁层相关的cc[外、内、房室室传导系统(VCS)](图2c-d),从心室外到管腔的细胞复杂性逐渐降低(图2f)。左室和右室外壁的cc由多种细胞组成,并富含以下细胞类型:左室和右室特异性致密型心室心肌细胞(vCM)、心室成纤维细胞(vFibro)细胞、血管细胞[包括形成冠状血管的血管内皮细胞(BEC)和周细胞]和增殖型vcm,这可能是导致心室外层生长速度增加的原因(图2d)。另一方面,左室和右室内的cc分别由左小梁和右小梁vCM和心内膜细胞组成,但vFibro细胞、增殖的vCM和血管细胞却少得多(图2d)。最后,在左心室比右心室更主要地出现一种VCS CC,这种CC主要由His-Purkinje心肌细胞和较少的心内膜细胞组成(图2c-d)。
除了心脏腔内的7个cc外,他们还发现了心脏的6个非心脏腔cc(图2b-d)。这些细胞群落与心脏的非腔室心脏区域相对应,包括心脏的流入道(IFT)、流出道(OFT)和房室区(图2c-d)。IFT/窦房结(SAN) CC主要由非心腔心肌细胞(nccm)-IFT样细胞和神经元细胞组成,可能与心脏的SAN起搏器相对应(图2c-d),而OFT CC则富含血管平滑肌细胞(VSMC)、血管外膜成纤维细胞(adFibro)和内皮相关细胞,与主动脉的细胞系一致。相反,房室区表现出更高的细胞复杂性,由房室和心室之间的一个小区域内的四个cc组成,其中包括房室和心脏瓣膜(图2c-f)。房室管 (AVC)的外部部分包含心外膜下CC,包括心外膜衍生祖细胞(epdc)、VSMC、淋巴管内皮细胞(lec)、神经元细胞和白细胞(图2c-d)。相比之下,AVC的内部部分,包围心脏瓣膜,由由nccm-AVC样心肌细胞和aFibro细胞组成的AVN/房室(AV)环CC组成,可能代表形成AVN的发育结构(图2c-d)。此外,在心脏瓣膜内发现了两个CC,包括瓣膜CC,它由瓣膜特异性心肌细胞、内皮细胞和间质细胞组成,延伸到房室瓣膜和OFT瓣膜,以及二尖瓣区域内更特异性的肌肉瓣膜小叶CC,它富含vCM-左心室(LV)-AV,可能反映了左心室细胞的早期特化(图2c-d)。
总体而言,这些分析以高细胞分辨率揭示了不同的心肌细胞(包括广泛存在或更专门的心肌细胞)如何组装成形成心脏形态结构的 CC。这些心脏CC不仅显示出不同的细胞组合和细胞复杂性,这可能导致CC和心脏结构之间的功能差异,而且还显示出经常在特定CC中富集的不同心肌细胞。
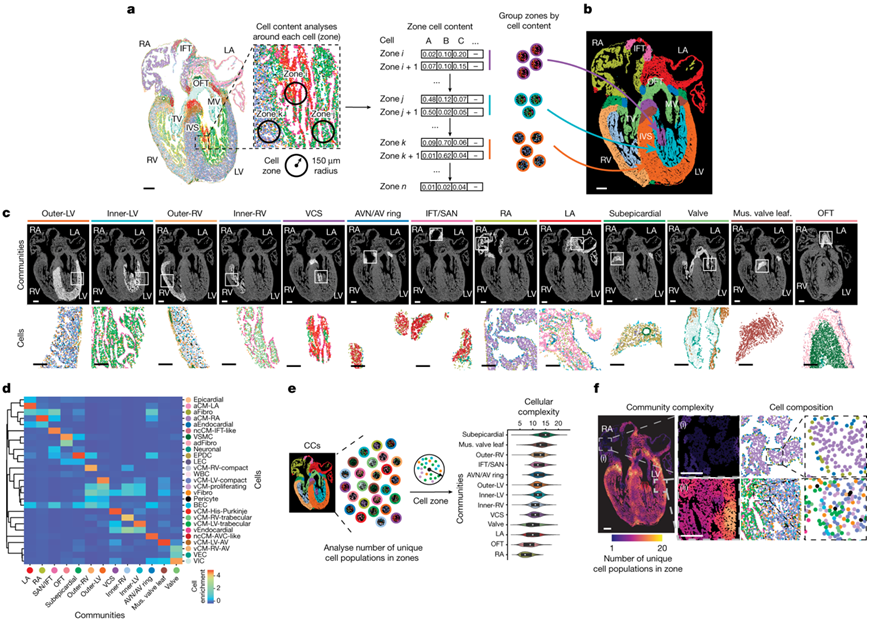
图2. 不同的心脏细胞群在空间上组织成 CC,形成专门的心脏结构。
(a) 分析每个单独细胞周围的细胞内容,识别细胞区域或邻域,形成定义的 CC。(b) CC 在 13 pcw心脏上的空间映射揭示了它们与不同的心脏解剖结构的对应关系。 (c) 显示每个 CC 的空间位置及其细胞组成和分布的示例(插图)。(d) 热图显示了每个定义的 CC 内已识别的 MERFISH 细胞的组成。(e-f) 对每个区域内独特细胞群数量的分析揭示了每个 CC 和心脏区域的细胞复杂性。
03
心室的多层组织
CC分析表明,发育中的心室室表现出高细胞复杂性和低纯度,特别是在心室壁CC的边界区域(图2e-f)。与这些发现一致的是,在心室内外区交界处,心室表现出致密型和小梁型vcm的混合,这表明发育中的心脏区域正在动态重塑,包括心室壁的压实(图2f)。
为了探索脑室细胞和组织的复杂性,仅分离、鉴定了心室内的MERFISH细胞,并将其空间映射到心室(图3a-b)。将基因标记分析和空间信息应用于这些不同的细胞,揭示了心肌细胞和成纤维细胞的额外群体(图3b-c)。特别是,MERFISH最初鉴定的8个vCM细胞群可细分为13个vCM亚群,其中包括11个腔室亚群和2个非腔室亚群(图3b-c)。空间映射显示,许多vcm根据室壁深度呈层流分布,在左心室观察到的vcm和层数多于右心室,这一结果证明了左心室比右心室发育早(图3c-d)。虽然已鉴定的vcm出现在心室壁内的不同层,但心室成纤维细胞可细分为三个亚群。其中包括在整个脑室中观察到的增殖样心室成纤维细胞并表达有丝分裂标记,以及两种成纤维细胞(致密型vFibro和小梁型vFibro),它们更具体地位于脑室的外部和内部区域,其中致密型和小梁型vCM分别富集(图3b-c)。这种增殖样vFibro(增殖型vFibro)表达致密型和小梁型vFibro细胞共有的基因,但表达水平较低,表明这些成纤维细胞可能是能够向脑室各自区域提供分化的致密型和小梁型vFibro细胞的祖细胞。
为了了解左心室壁 vCM 的复杂性和层状组织,左心室壁 vCM 的细胞复杂性高于右心室。他们检测了这些vcm的基因表达谱及其在左心室的空间分布。与左室壁vcm之间基因表达谱的逐渐转变相一致(图3e),分子连通性分析显示,这些vcm表现出高度连接的基因表达网络,其中空间连续的vcm之间存在最强的连接(图3e-f)。沿着心室壁深度观察到vcm的空间基因表达的进行性变化。此外,该结果在空间上与左心室各vcm的层流组织和部分重叠相对应(图3c-g)。特别是,他们确定了在特定vcm中富集的共表达基因组合,并使其在左心室中进行空间跟踪(图3g-i)。这些基因不仅包括已知的致密和心室标记,如HEY2、IRX3和GJA5,还包括新定义的由靠近心外膜的致密vcm(RABGAP1L和PLK2)和靠近管腔的小梁vcm (CXCL12)表达的标记基因(图3g-i)。伪时间分析证实了这些发现,显示vcm的顺序与其沿心室壁的分布相关,并且单个vcm沿伪时间和心室壁深度轴形成连续的聚集体(图3h)。
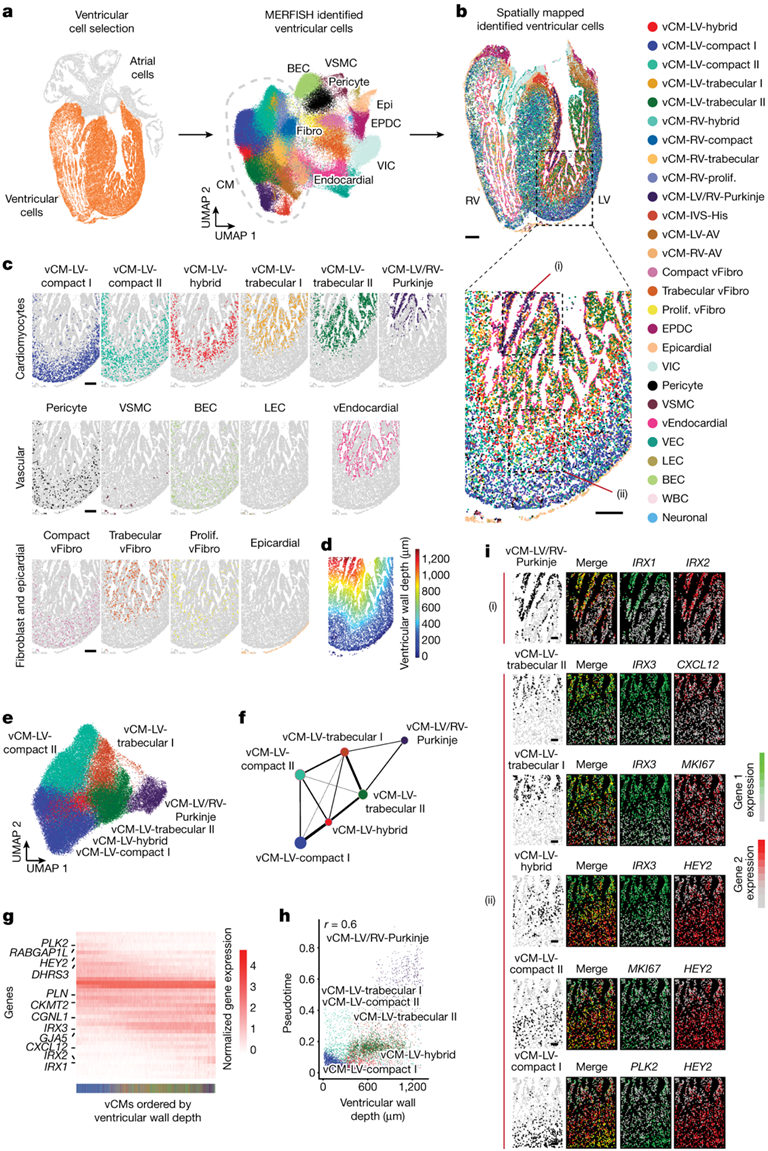
图3. 心室壁包含独特的特殊心肌细胞。
(a) 构成心室的 MERFISH 细胞(左,橙色)通过 UMAP(右)显示成聚类。 (b)对已识别的心室细胞进行空间映射。(c) 显示了(b) 中MERFISH 空间图中概述的区域的左心室壁特定心室细胞的空间分布。 (d) 心室细胞的心室壁深度分布显示为(b)中成像区域距心室心外膜/外表面的测量距离。(e) LV vCM 分为不同的 vCM 亚群。(f) 不同 vCM 的分子关系显示在连接图中,其中节点之间的加权边代表它们基于基因表达相似性的连接。(g) 热图显示了 vCM 差异表达基因的标准化表达。(h) 散点图揭示了左心室中各个 vCM 的心室壁深度和伪时间之间的关系。(i) MERFISH 图像分析。
04
多细胞信号传导形成心室
为了了解人类心室是如何形成和组织心肌层的,心肌层对其发育和功能至关重要,他们重点研究了不同的心肌细胞是如何在12-13 pcw协调指导心室壁形态发生的。在这个时间点上,人的心室通过内小梁层与外致密层的巩固(心肌压实)开始重塑心室壁。根据MERFISH对12-13 pcw的心室分析发现的不同的心室亚群。他们定义了空间邻近心室细胞的心室cc,以识别心室内可能相互作用的细胞(图4a-b)。虽然他们观察到右心室壁包括三个主要的CC(外室、内室和内室),但他们发现左室亚群分为四个主要的CC,不仅包括外室、内室和内室CC,还包括位于外室和内室CC之间的中室CC(图4a-c)。这些心室cc在空间上呈层状分布在心室壁上,类似于vcm的层状组织,但在IVS和LV心室尖和自由壁之间检测到不成比例,其中VCS和内LV cc分别富集(图4a)。与在左室中发现的额外心室心脏亚群一致,LV特异性cc表现出增加的细胞复杂性。当外左心室和内左心室CC相应地由致密和小梁左心室vCM组成时,中间左心室CC包含这些左心室vCM和混合型vCM,并显示出最大的细胞异质性但最低的细胞纯度(图4a-c)。这些结果证明了左室,特别是中间区域,可能表现出复杂的相互作用的多细胞事件,调节其心室壁的动态发育和重塑。
由于vcm在左室壁上的高度分层组织(图3c,图4c),他们检测了vcm的传入信号,以确定控制其空间分布的信号通路(图4d)。广泛的心室心脏细胞向不同的vcm发出信号,成纤维细胞与vcm表现出最强和最多的信号相互作用(图4d)。这些 vCM 接收到的最主要的信号通路是生长和细胞外基质相关通路,这些信号源自整个 LV CC 的成纤维细胞。他们还确定了这些群落中不同 vCM 接收到的细胞-细胞相互作用(CCI)信号存在差异(图4e)。例如,在内左室 CC 中的NRG1+ 心内膜细胞和ERBB2 + ERBB4 +小梁 vCM之间观察到神经调节蛋白-ERBB 信号传导。值得注意的是,他们还发现了几种丛状蛋白-脑信号素(PLXN-SEMA)轴突引导信号通路,特别是在中间LV CC内,它们可能介导PLXNA2+PLXNA4+混合体和小梁vCM与SEMA3C+SEMA3D+紧密型vFibro细胞之间的旁分泌相互作用,以及PLXNA2+PLXNA4+混合体和大梁vCM和SEMA6A+SEMA6B+BEC之间的近端相互作用(图4f)。
鉴于 PLXN-SEMA 信号在调节细胞迁移中的作用,该信号通路可能介导心肌细胞、成纤维细胞和内皮细胞之间复杂的多细胞相互作用,协调心室壁内心肌细胞的组织,它们可能参与调节参与重塑心室壁层(包括心肌致密化)的细胞,这些细胞在整个左心室壁上以互补但重叠的梯度在空间上排列,在那里它们在中间左心室中合并CC进行相互作用(图4g)。特别是,PLXNA2+ PLXNA4+小梁 vCM 和SEMA3C+SEMA3D+致密 vFibro 细胞分别在内左心室 CC 和外左心室 CC 中最高,但沿壁深度沿相反方向逐渐减少,使得这些心室细胞在空间上相交在中间 LV CC 内(图4g-h)。相比之下,SEMA6A+ SEMA6B+ BEC 在整个中左心室和外左心室 CC 中均可见,但在存在小梁的中左心室和内心室 CC 之间的边界处呈锥形(图4g)。此外,PLXNA2+PLXNA4+ vcm主要位于中室室,在中室室外半部分观察到较多,提示这些vcm可能在室壁形态发生过程中在小梁型和致密型vcm之间过渡。最后,他们观察到小梁和vcm比致密型vFibro细胞更接近BEC,这一结果证明了这些相互作用的心室细胞之间存在近分泌和旁分泌PLXN-SEMA信号传导。
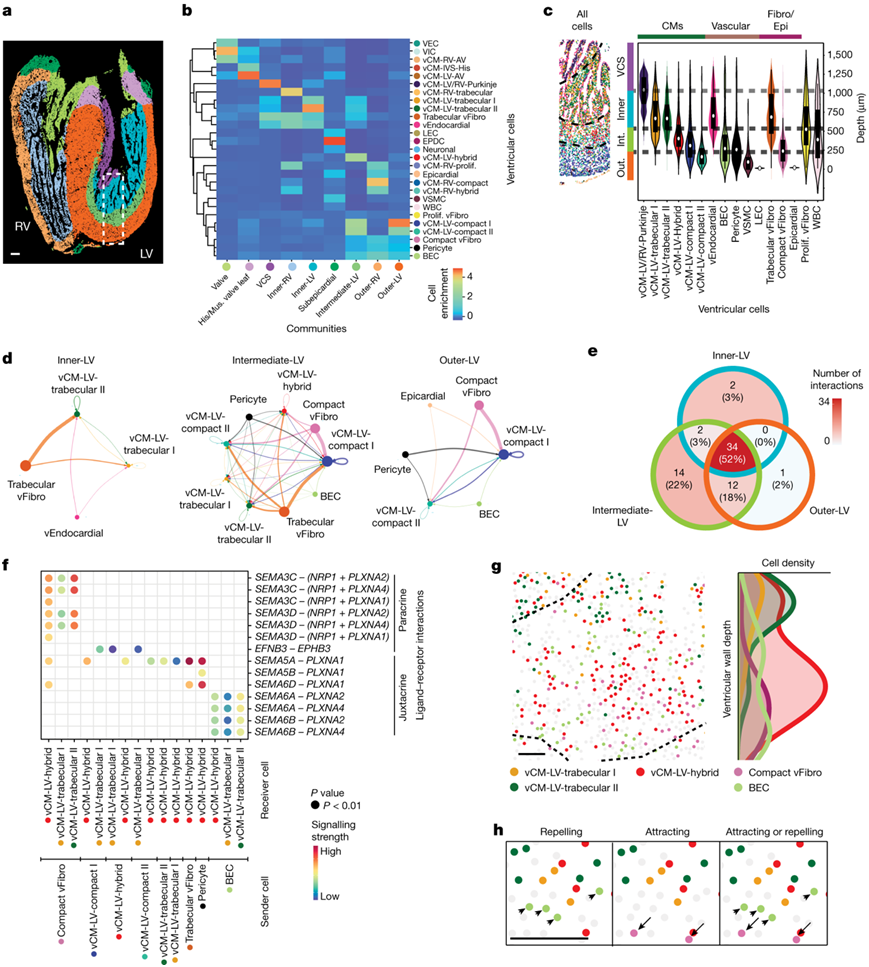
图4. 多细胞相互作用指导心室壁内特定 CC 的组织。
(a) MERFISH 识别的心室细胞在心室内组装成九个更复杂的 CC。(b) 热图显示每个心室 CC 内不同心室细胞的组成。(c) MERFISH 图像显示了 CC 层及其细胞组成。小提琴图显示了这些层内不同心室细胞的心室壁深度分布。(d) 和弦图揭示了内左心室、中间左心室和外心室 CC 中特定 vCM 接收到的细胞间信号相互作用的强度。(e) 维恩图显示了内部 LV、中间 LV 和外部 LV 社区内的 vCM 接收到的特定和共有 CCI 的数量。(f)点图显示中间 LV CC 内不同心室细胞之间的特定信号相互作用。(g) 左图为中左室CC中参与SEMA3C、SEMA3D、SEMA6A或SEMA6B与PLXNA2或PLXN4相互作用的细胞空间图,右图为这些细胞归一化后的室壁深度分布。 (h) 中间-LV CC的高分辨率空间细胞图显示了参与带有PLXNA2或PLXN4信号传导的SEMA3C、SEMA3D、SEMA 6A或SEMA6B相互作用的细胞如何在空间上分布以介导吸引或排斥相互作用。
05
PLXN-SEMA 指导心室组织
为了验证他们 CCI 研究中确定的 PLXN-SEMA 信号通路是否参与心室壁内 vCM 的组织,他们使用快速 3D 生物打印技术创建了体外人多能干细胞 (hPSC) vCM 多层心室壁模型(hPSC- vCM)用于研究源于中间 LV CC 的SEMA3C、SEMA3D、SEMA6A和SEMA6B如何影响PLXNA2+ PLXNA4+小梁 vCM 的空间重新分配。他们的分层生物打印了富集的非小梁样和小梁样 hPSC-vCM,以分别概括人心室的中间 LV CC 和内 LV 小梁 CC 区域(图5a)。利用单层心脏分化系统,他们生成了富集的hPSC心肌细胞,主要是早期发育的IRX4+ vcm,并用于创建生物打印的非小梁样心肌细胞层(图5a-c)。为了制造用于生物打印内lv小梁cc样层的小梁样hPSC-vCM(图5a-c),将hPSC分化为vCM,然后用神经调节蛋白1 (NRG1)处理,NRG1通过NRG1-erbb2 - erbb4信号传导心内膜细胞和vCM之间,促进小梁vCM分化。
为了研究中室cc衍生的SEMA3C、SEMA3D、SEMA6A和SEMA6B如何影响hPSC脑室壁模型中PLXNA2+PLXNA4+小梁样hPSC-vcm的空间分布,他们将这些脑信号蛋白(SEMA)配体添加到含有非小梁样TNNT2: NLS- mkate2 hPSC-vcm的中室cc样层的两个不同层(1层和2层)。然后检测生物打印的PLXNA2+PLXNA4+小梁样(或对照非小梁样)TNNT2:eGFP hpsc - vcm在内lv小梁cc样层中的空间位置(图5b-d)。
当这些SEMA配体存在于整个中lv cc样层时,SEMA3C可以指导PLXNA2+PLXNA4+小梁样TNNT2:eGFP hpsc - vcm从内lv小梁样cc层迁移到中lv cc样层(图5b-d)。
利用可诱导的Tcf21-creERT2小鼠细胞系,他们研究了心脏成纤维细胞中Sema3c (Sema3cfl/fl)的基因缺失是否会影响心室壁的体内发育,并发现tcf21-creert2;Sema3cfl/fl心室在胚胎14.5天(E14.5)开始出现更薄的致密心肌(图5e-f)。
空间和细胞信号传导结果表明,SEMA3C+致密型 vFibro 细胞可能会将PLXNA2+ PLXNA4 +小梁和混合 vCM 吸引到中左心室和外左心室 CC 层,而SEMA6A + SEMA6B+ BEC 可能会通过以下方式阻止这些 vCM 迁移:接触后再排斥它们(图5g)。
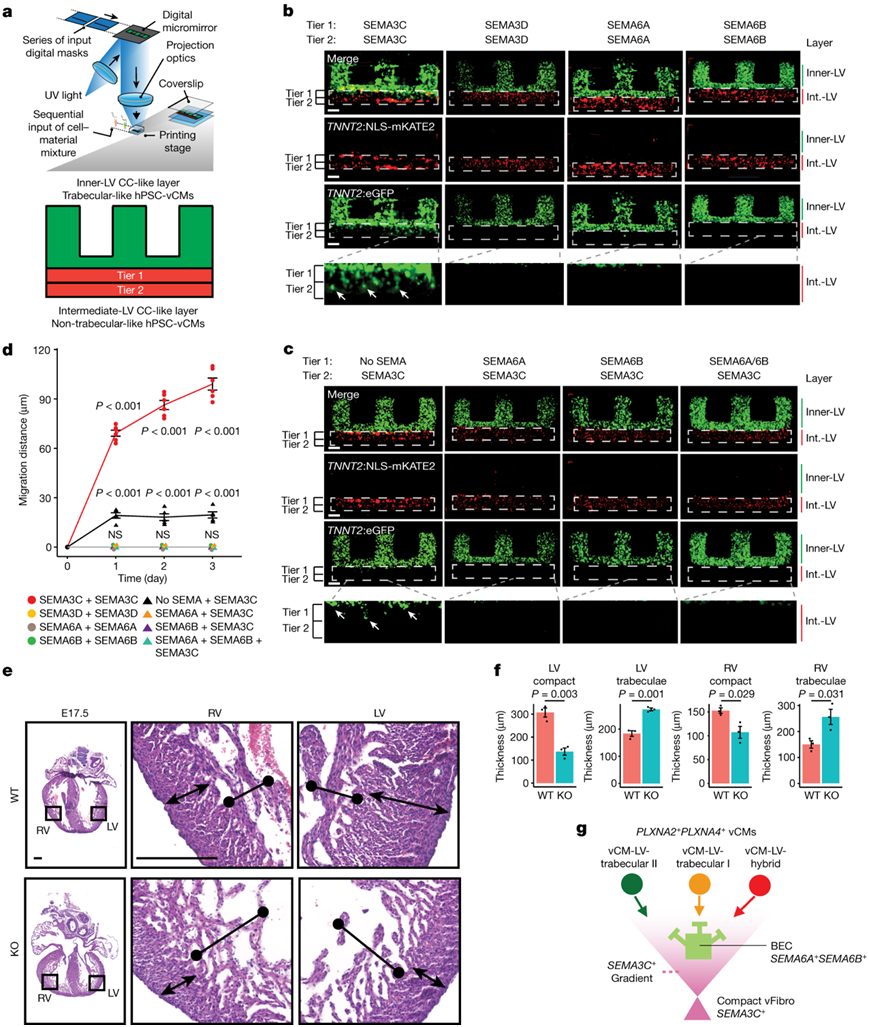
图5. PLXN-SEMA 信号传导介导小梁 vCM 的迁移。
(a) NLS-mKATE2 +非小梁和 GFP +小梁样 hPSC-vCM 通过生物打印成多层结构,模拟心室壁。(b) GFP小梁样hPSC-vCM向中间心室样层(Int.-LV)迁移。(c) SEMA6A或SEMA6B以不同组合混合在中间心室样层中阻止SEMA3C介导的GFP +小梁样hPSC-vCM迁移。(d) 不同中间LV CC样层条件下的GFP+类小梁hPSC-vCM迁移测量。(e)心脏切片。(f) 显示WT和条件缺失Sema3c KO小鼠心脏致密和小梁心肌的厚度。 (g) 模型显示PLXN-SEMA如何在不同的vCM、成纤维细胞和内皮细胞之间相互作用。
+ + + + + + + + + + +
结 论
本项研究发现许多心脏细胞类型进一步指定为特定群落独有的亚群,这支持它们根据细胞生态系统和解剖区域的特化。特别是,心室心肌细胞亚群在心室壁上表现出意想不到的复杂层状组织,并与其他细胞亚群一起形成了几个细胞群落。使用体内条件遗传小鼠模型和体外人类多能干细胞系统来探究这些群落内的细胞-细胞相互作用,揭示了在心室壁形态发生过程中协调心脏细胞亚群空间组织的多细胞信号传导途径。这些关于构建和重塑人类心脏的细胞社会相互作用和心肌细胞类型专业化的详细发现为结构性心脏病和用于人类心脏修复的复杂多细胞组织工程提供了新的见解。
+ + + + +



 English
English


