文献解读|Cell Host Microbe(30.3):肠道微生物胆汁酸轴在阿司匹林介导的损伤后促进肠道稳态
✦ +
+
论文ID
原名:A gut microbiota-bile acid axis promotes intestinal homeostasis upon aspirin-mediated damage
译名:肠道微生物胆汁酸轴在阿司匹林介导的损伤后促进肠道稳态
期刊:Cell Host & Microbe
影响因子:30.3
发表时间:2024.01.11
DOI号:10.1016/j.chom.2023.12.015
背 景
阿司匹林(Aspirin)相关的胃肠道损害日益受到关注。阿司匹林的使用可调节肠道微生物群和相关代谢物,例如胆汁酸(BAs),但这如何影响肠道稳态仍不清楚。
实验设计
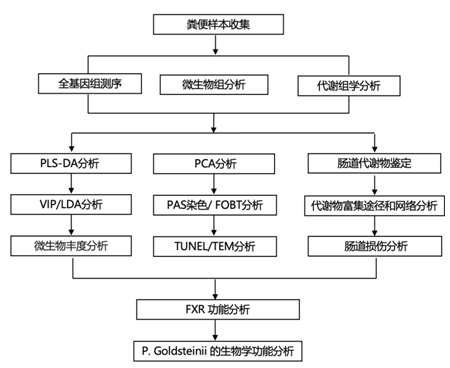
结 果
01
阿司匹林在人类和小鼠中引起肠道失调
为了研究阿司匹林如何影响人类肠道微生物群和代谢物,研究者团队收集了 23 名健康志愿者每天服用 100 毫克阿司匹林治疗 30 天之前 (BA) 和之后 (AA) 的粪便样本(图 1 A)。
阿司匹林治疗后,肠道微生物群组成发生了显著改变(图 1B),肠道微生物群的投影变量重要性 (VIP) 评分和线性判别分析 (LDA) 评分也表明副拟杆菌是导致群体分离的关键肠道微生物群(图 1 C)。随后通过共现网络和比较进行的分析也证实了副杆菌属肠道细菌的耗竭(图1D-F)。他们进一步分析了主要物种的丰度,发现P. goldsteinii、Parabacteroides merdae (P. merdae)和Parabacteroides distasonis (P. distasonis)的丰度均有所下降(图1G)。
他们在动物模型中进一步验证了阿司匹林对肠道微生物群的影响,偏最小二乘判别分析(PLS-DA)数据也显示口服阿司匹林会改变肠道微生物群组成(图1H)。同样,P. goldsteinii的α-多样性(图1I)和丰度也随时间的变化而降低(图1J)。总之,这些数据表明阿司匹林在人类和小鼠中引起肠道生态失调,其特征是P. goldsteinii丰度降低。
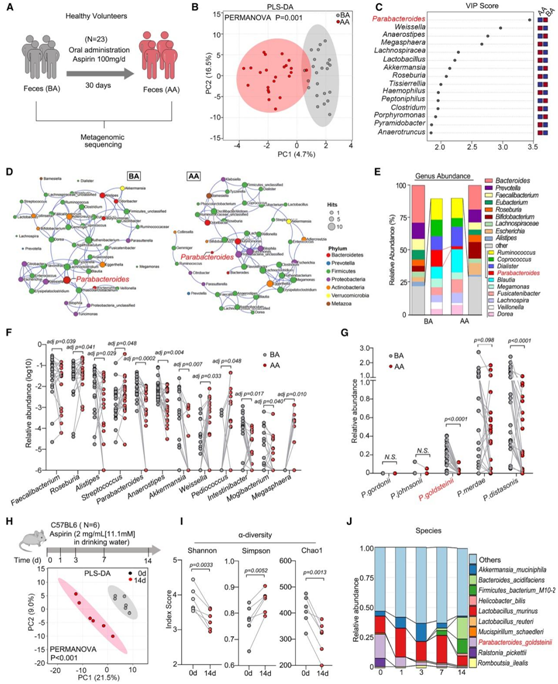
图1. 阿司匹林引起人类和小鼠肠道菌群失调。
(A) 使用阿司匹林治疗的健康志愿者队列(BA-AA 队列)。(B)基于相对属丰度的偏最小二乘判别分析 (PLS-DA)。 (C) PLS-DA 的投影变量重要性 (VIP) 分数显示了不同类群区分群体的能力。 (D) 基于 BA 和 AA 组中核心属(丰度前 50 个属)的肠道微生物共现网络分析。(E) BA 和 AA 组肠道微生物群的相对丰度。(F) BA 组和 AA 组之间差异最显著的前 12 个属的相对丰度比较。(G) 基于宏基因组学结果的副拟杆菌属中不同物种的相对丰度。(H) 主成分分析。(I) 测定小鼠粪便菌群α多样性的3个指标(Asp 0 d vs. Asp 14 d)。 (J) 阿司匹林治疗后不同时间点小鼠肠道菌群丰度前10位。(H-J)
02
阿司匹林会损害肠道屏障功能,导致肠道损伤
为了进一步确定P. goldsteinii在阿司匹林扰乱肠道内稳态中的重要性,他们对阿司匹林处理小鼠的肠道损伤评分进行了评估(图2A)。值得注意的是,肠道内容物微生物群组成的热图和主成分分析(PCA)表明,与生理盐水组相比,阿司匹林和新霉素组小鼠的肠道微生物群有所不同(图2B-C)。阿司匹林和新霉素都降低了肠道微生物群的α-多样性,抑制了特异性无病原体(SPF)小鼠的P. goldsteinii(图2D)。此外,过碘酸-希夫(PAS)染色显示,阿司匹林治疗后的肠黏膜变薄,这与新霉素治疗后的小鼠相似(图2F)。这可能是由于杯状细胞(PAS+细胞)的分化受到抑制,以及隐窝细胞(Ki67+细胞)的增殖减少(图2E)。此外,阿司匹林或新霉素可增加肠道通透性(图2G)。粪便隐血试验(FOBT)结果显示,阿司匹林和新霉素治疗后肠道出血发生率升高(图2H)。TdT介导的dUTP镍端标记(TUNEL)检测也显示阿司匹林和抗生素治疗可驱动细胞凋亡(图2I)。透射电子显微镜(TEM)进一步显示阿司匹林治疗后肠道屏障受损(图2J),紧密连接蛋白ZO-1和cladin -5水平显著降低(图2K)。
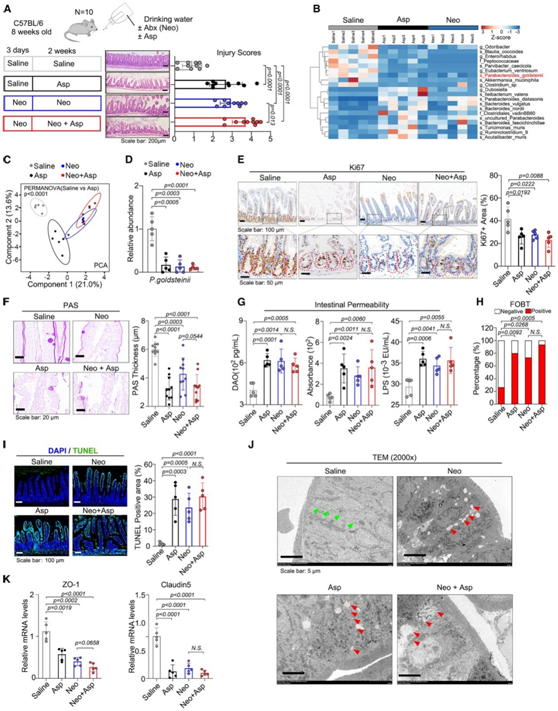
图2. 阿司匹林会损害肠道屏障功能并导致肠道损伤。
(A)实验流程和H&E染色图像。(B) 小鼠肠道内容物中不同物种的热图。(C) 来自所示四组肠道内容的 16S 测序结果的 PCA。 (D) 基于 16S 测序结果的P. goldsteinii相对丰度。(E-F) 小鼠远端空肠的 Ki67 (E) 和高碘酸希夫 (PAS, F) 染色。 (G) 使用二胺氧化酶 (DAO)(左)、异硫氰酸荧光素 (FITC) 标记的葡聚糖(中)和脂多糖 (LPS)(右)进行肠道通透性分析。(H) 使用四组小鼠的粪便样本进行粪便潜血测试 (FOBT)。(I) 肠道 TUNEL 染色的代表性图像。(J) 小鼠肠道组织的透射电子显微镜 (TEM)。(K) 小鼠肠道组织中 ZO-1 和 Claudin5 的 mRNA 水平。
03
阿司匹林使P. goldsteinii耗竭并恢复BA谱
他们采用液相色谱-质谱法(LC-MS)定量测定模型小鼠肠道内阿司匹林浓度,浓度范围为1 ~ 4 mM,他们发现阿司匹林对P. goldsteinii的生长有剂量依赖性抑制(图3A)。非靶向代谢组学分析显示,阿司匹林相关代谢物富含与氨基酸代谢相关的化合物。其中,L-谷氨酰胺、瓜氨酸和L-脯氨酸是相互作用网络的核心组成部分(图3B)。补充L-谷氨酰胺和瓜氨酸恢复了阿司匹林对P. goldsteinii生长的抑制作用(图3C),表明阿司匹林可能通过干扰这两种代谢物的生物合成来影响P. goldsteinii。然后,他们确定了P. goldsteinii对宿主代谢产物的调节作用。非靶向代谢组学检测显示,阿司匹林治疗后肠道BAs含量减少(图3D),这可通过P. goldsteinii移植恢复(图3E)。特别是,阿司匹林显著降低了牛黄-α/β-胆酸(Tα/βMCA)、熊去氧胆酸(UDCA)和7-酮石胆酸(7-keto-LCA)的肠道浓度,而P. goldsteinii移植后则保留了它们(图3F)。此外,P. goldsteinii和BAs的丰度呈正相关(图3G)。此外,BA-AA组的粪便代谢物谱(图1A)也显示出类似的变化和相关性(图3H-I)。
他们对BA-AA队列的宏基因组数据进行了进一步分析。阿司匹林治疗后,hdhA基因(编码7-α-HSDH)拷贝数显著减少(图3J)。由于之前的研究表明,编码7-α-HSDH的hdhA能够在体内和体外将CDCA转化为7-keto-LCA和UDCA,以及在小鼠中将βMCA转化为βMCA,因此他们预测了BAs代谢的合成途径(图3K)。在副拟杆菌中进一步鉴定出与hdhA同源的序列,包括P. goldsteinii、P. merdae和P. distasonis(图3L)。他们还发现P. goldsteinii在体外产生7-keto-LCA,但不产生UDCA(图3M)。
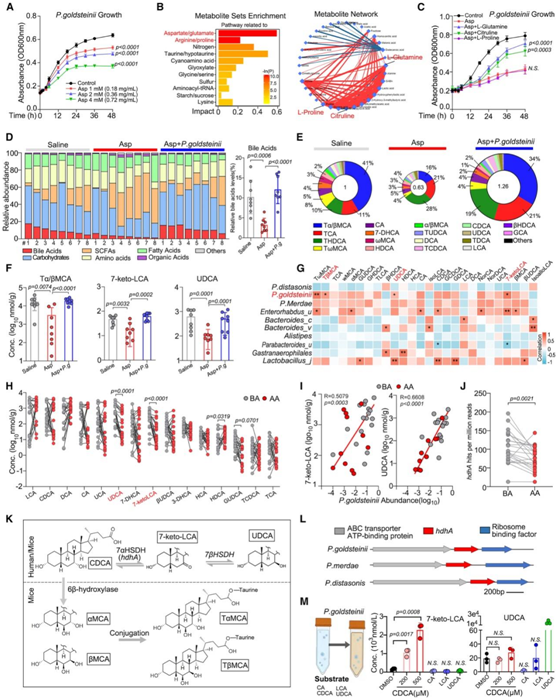
图3. 去除阿司匹林后的P. goldsteinii可恢复肠道微生物群和胆汁酸代谢谱。
(A) P.goldsteinii生长曲线。(B) 基于来自用或不用阿司匹林处理的P. goldsteinii培养基的代谢组学数据的代谢物富集途径和网络。 (C) P. goldsteinii对阿司匹林和补充氨基酸的生长曲线。 (D) 肠内容物进行代谢组学分析。(E) 各组中不同胆汁酸的平均百分比。(F) 不同组小鼠肠道内容物中 Tα/βMCA、7-keto-LCA 和 UDCA 的浓度。(G) 显示 Asp 处理小鼠和对照小鼠肠道微生物群物种丰度与肠道胆汁酸水平之间相关性的热图。(H) BA-AA 队列粪便中不同胆汁酸的浓度。 (I) 7-keto-LCA和 UDCA 浓度与BA-AA 队列粪便样本中P. goldsteinii丰度之间的相关性。(J) BA-AA 队列中个体微生物群7-α-羟基类固醇脱氢酶 (hdhA) 基因的丰度。(K) 人类和小鼠中 BA 的合成途径。(L) 使用 PacBio Sequel 和Illumina MiSeq测序仪确定了副杆菌属中几个物种的基因组序列。(M) P. goldsteinii (OD = 0.1) 的体外培养物补充了 CA、CDCA、LCA 和 UDCA,分析培养基的胆汁酸浓度。
04
P. goldsteinii通过hdhA改善阿司匹林诱导的肠道损伤
接下来他们研究了具有hdhA 的P. goldsteinii是否有助于预防阿司匹林引起的肠道损伤,通过敲除hdhA基因构建了hdhA缺陷型P. goldsteinii突变株(PGΔ hdhA)。LC-MS分析证实突变菌株无法将CDCA转化为7-keto-LCA。
他们用阿司匹林治疗SPF小鼠,同时移植P. goldsteinii。活的P. goldsteinii (LPG) 和野生型 (WT) P. goldsteinii (PG wt)改善了损伤分数(图 4 A)。此外,LPG 和 PG wt代替 HPG 或 PGΔ hdhA恢复了肠道通透性(图 4 B)。PAS染色进一步表明,LPG和PG wt而非HPG或PGΔhdhA逆转了阿司匹林引起的肠粘液屏障损伤(图4C),并且对保存杯状细胞具有积极作用(图4D)。TUNEL 和 FOBT 测定揭示的其他异常表型表明 LPG 和 PG wt保护肠上皮细胞(图 4E-F)。此外,肠道屏障的 TEM 显示 LPG 组中存在牢固的紧密连接。这些紧密连接在 HPG 组中受损,与阿司匹林组类似(图 4 G)。
接下来他们在体内确定 UDCA 和7-keto-LCA 在表型中的作用。UDCA 和 7-keto-LCA 均可防止阿司匹林诱导的肠上皮损伤(图 4 H)。此外,肠道通透性分析显示 UDCA 和 7-keto-LCA 对阿司匹林具有相反的作用(图 4 I)。此外,PAS 染色进一步支持了这些 BA 在维持肠粘液屏障(图 4 J)的积极作用。两种 BAs 均显示出针对阿司匹林引起的损伤(图 4K-L)和隐窝细胞增殖的保护作用。LPG 移植以及 UDCA 和 7-keto-LCA 灌胃提高了紧密连接标记物的 mRNA 水平(图 4 M)。这些数据表明P. goldsteinii及其通过hdhA产生的 BAs可以防止阿司匹林引起的肠道损伤。
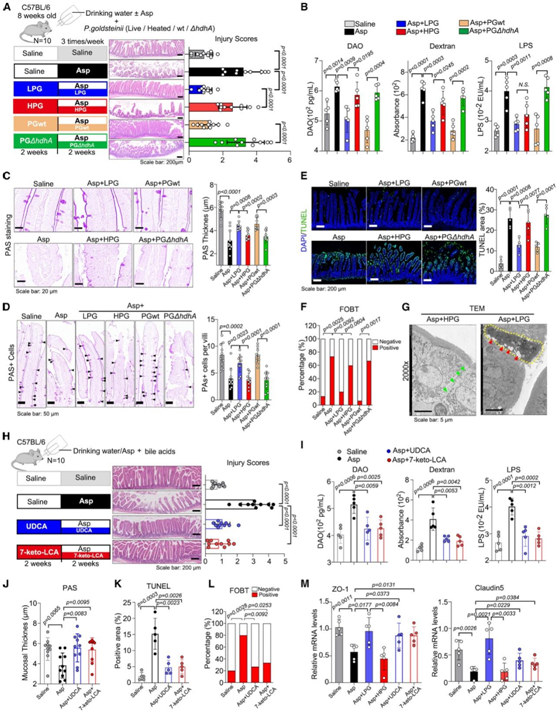
图4. P. goldsteinii通过hdhA改善阿司匹林引起的肠道损伤。
(A) 每组的 H&E 染色肠道和损伤评分的代表性图像。 (B) 使用 DAO(左)、FITC 标记的葡聚糖(中)和 LPS(右)进行肠道通透性分析。(C-D) PAS 染色显示每组的代表性图像(左)以及粘膜厚度和 PAS 阳性杯状细胞的统计分析(右)。(E) 显示肠的TUNEL染色。(F) 使用 (A) 中处理的小鼠粪便样本进行 FOBT。 (G) 用 LPG 或 HPG 处理阿司匹林小鼠肠道屏障结构的代表性图像。(H) 每组的 H&E 染色肠道和损伤评分的代表性图像。(I) 使用 DAO(左)、FITC 标记的葡聚糖(中)和 LPS(右)进行肠道通透性分析。(J-K) (H) 中治疗的小鼠肠道组织的 PAS 染色和 TUNEL+ 区域。(L) 使用 (H) 中处理的小鼠粪便样本进行 FOBT。 (M) 小鼠肠道组织中肠道紧密连接标志物的相对 mRNA 水平。
05
法尼醇 X 受体 (FXR) 介导阿司匹林对肠道的作用
FXR 是一种 BAs 受体,在肠道干细胞扩增和肠道屏障中发挥着关键作用。调节 FXR 活性可促进肠道细胞向肠样表型转分化。因此,他们建立了肠道特异性敲除 FXR 的小鼠模型Fxr -floxed 小鼠 (Fxrfl/fl) 和肠道特异性Fxr-null小鼠 (Fxr ΔIE),并用阿司匹林处理(图5A),它们表现出肠道损伤、肠道屏障破坏、生长抑制、细胞凋亡、粘膜厚度增加(图5A-E)。阿司匹林处理后,具有β-catenin和Olfm4核分布的隐窝细胞数量减少,这是通过敲除肠道FXR而减弱的(图5F)。此外,在阿司匹林作用下,杯状细胞和Paneth细胞数量均增加(图5G)。
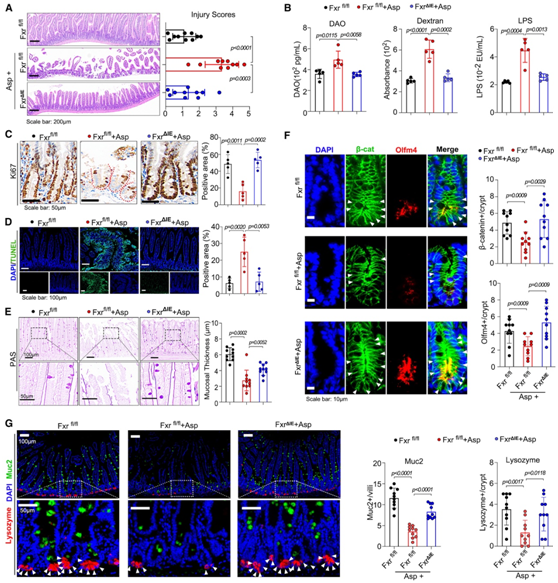
图5. 肠道特异性敲除 FXR 可减轻阿司匹林引起的肠道损伤。
(A)肠道损伤评分。 (B) 肠道渗透性分析。(C-E) 对 (A) 中处理的小鼠肠道进行 Ki67、TUNEL 和 PAS 染色。 (F) (A) 中处理的小鼠肠隐窝中 β-连环蛋白和 Olfm4 的免疫组织化学 (IHC)。(G) 在(A)中处理的小鼠的肠绒毛和隐窝中粘蛋白2和溶菌酶的表达,分别标记杯状细胞和潘氏细胞。
06
P. goldsteinii通过调节BAs代谢促进肠道自我更新
他们发现阿司匹林可抑制肠道生态位细胞增殖,而P.goldsteinii移植可促进细胞增殖(图6A)。此外,从原代离体隐窝培养的肠道类器官在阿司匹林处理的小鼠中也显示出扩张、出芽数量和表面积的减少,但可通过P.goldsteinii 移植恢复(图6B)。为了更密切地观察P.goldsteinii对肠道干细胞的影响,他们研制了一种共培养装置,并测量了氧浓度(图6C)。对P. goldsteinii的生存能力进行了评估,当与类器官共培养时,发现类器官生长增加(图6D)。LPG共培养的类器官增殖能力增强,凋亡百分比降低(图6E)。LPG组的类器官的杯状细胞和Paneth细胞数量也有所增加(图6F)。干细胞标记mRNA,如Lgr5、Olfm4和Ascl2,以及肠道通透性标记mRNA,在与LPG共培养后增加(图6G)。
UDCA和7-keto-LCA都消除了阿司匹林诱导的原代类器官细胞增殖的抑制作用(图6H)。此外,它还显示了BAs处理小鼠类器官的恢复生长和干细胞扩增(图6I)。体内UDCA和7-keto-LCA的补充均增加了杯状细胞和Paneth细胞的数量(图6J)。这些数据表明,P. goldsteinii及其BAs代谢物有助于维持肠道自我修复过程中肠道干细胞的功能。
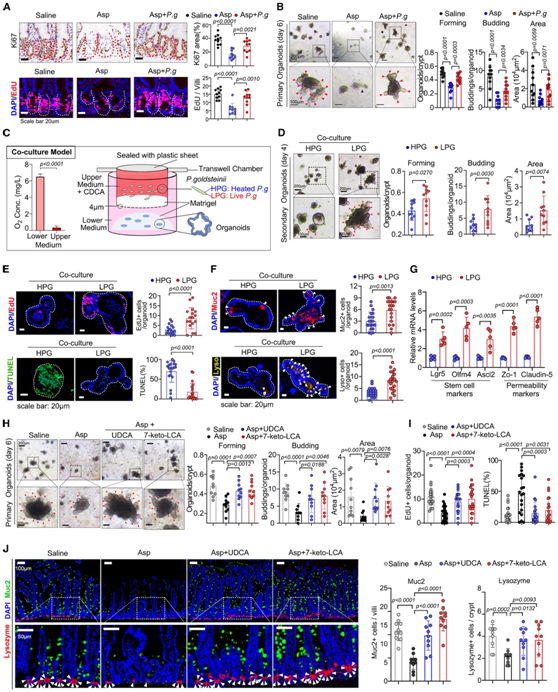
图6. P. goldsteinii通过调节胆汁酸代谢促进肠道自我更新。
(A) 小鼠远端空肠的Ki67和5-乙炔基-20-脱氧尿苷(EdU)染色。 (B) 使用按照 (A) 处理的小鼠的隐窝培养肠类器官。通过类器官/隐窝比率计算形成率。(C) 共培养系统的描述,使肠道类器官和厌氧细菌之间能够相互作用。(D) 将活的P. goldsteinii (LPG) 或热灭活的P. goldsteinii (HPG) 与来自 C57BL/6J 小鼠的次级肠道类器官共培养 4 天。(E) 与 HPG 或 LPG 共培养后类器官的 EdU(上)和 TUNEL(下)染色。(F) Mucin2 和溶菌酶的免疫荧光。(G) 共培养后,通过 RT-qPCR 测量编码干细胞标记和通透性标记的 mRNA 的类器官水平。(H) 类器官的代表性图像(左)。分析了类器官的形成率、出芽数量和面积(右)。(I)对经 (H) 处理的小鼠产生的类器官的 EdU(左)和 TUNEL(右)染色进行统计分析。(J) 经 (H) 处理的小鼠肠绒毛和隐窝中粘蛋白 2(绿色)和溶菌酶(红色)的染色。
07
P. goldsteinii- 7-keto-LCA是一种FXR拮抗剂,促进Wnt信号传导
考虑到微生物UDCA和TβMCA都是已证实的肠道FXR拮抗剂,他们分析了7-keto-LCA对FXR的功能。将7-keto-LCA与人FXR配体结合域(PDB: 3DCT, R4)对接,与周围残基结合(图7A)。他们发现7-keto-LCA (IC50 = 32.8 μΜ)和UDCA (IC50 = 59.7 μΜ)都是FXR拮抗剂(图7B)。两种FXR下游标志物成纤维细胞生长因子19 (FGF19)和小异源二聚体伴侣(SHP)的表达增加。但在两种肠细胞系中,TβMCA、UDCA和7-keto-LCA均能消除这一作用(图7C)。荧光素酶报告基因实验进一步显示,UDCA和7-keto-LCA均能显著抑制FXR的转激活活性(图7D)。
为了评估UDCA和7-keto-LCA是否调节肠道干性,他们对经BAs处理的肠道类器官进行了RNA测序。有趣的是,UDCA和7-keto-LCA都促进了干细胞特征(Lgr5-Ascl2)的表达(图7E)。相应的PCA显示对照组和CDCA组之间存在分离的聚类(图7F)。此外,7-keto-LCA处理抵消了众多的基因抑制,最明显的是那些参与Wnt信号传导和增殖相关途径,但不参与凋亡途径的基因(图7G)。这一结果与类器官中FXR靶基因mRNA表达降低和干细胞标志物mRNA表达增加的结果一致(图7H)。体内实验结果也显示,7-keto-LCA和P. goldsteinii移植均能消除阿司匹林对肠隐窝β-catenin活性的抑制作用(图7I)。
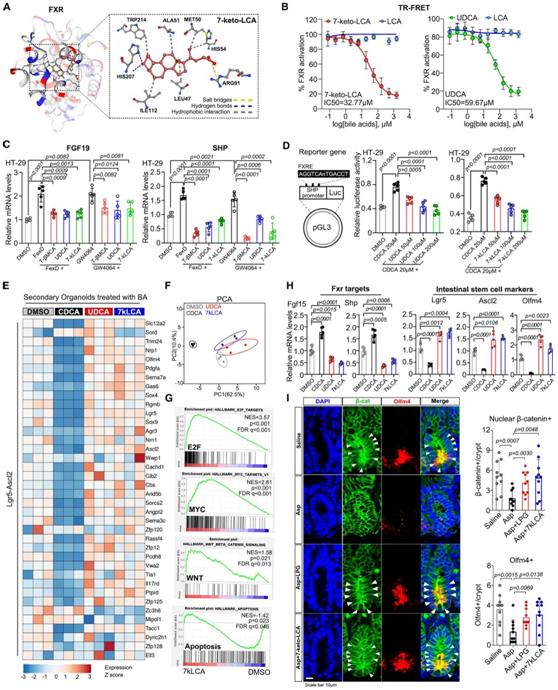
图7. 7-Keto-LCA 是一种 FXR 拮抗剂,可促进 Wnt 信号传导。
(A)分子对接实验。(B) TR-FRET FXR 共激活剂的测定分析。(C) 用不同胆汁酸和合成 FXR 激动剂 fexaramine D (FexD) 和 GW4064 处理 HT-29 细胞。通过 RT-qPCR 定量 FXR 靶基因的 mRNA 水平。(D) 生成含有 FXR 结合序列的pGL3 荧光素酶报告基因载体(左)。在对照 (DMSO)、CDCA、7-keto-LCA和 UDCA 处理后检测荧光素酶活性。(E) 用 CDCA (20 μM)、7-keto-LCA (20 μM) 或 UDCA (20 μM) 处理次级类器官 5 天,并进行下一代测序。显示了干细胞基因特征 (Lgr5-Ascl2) 变化的热图。(F) (E) 中所示基因特征的 PCA。(G) 7-keto-LCA组和DMSO组测序结果的基因集富集分析(GSEA),针对增殖和凋亡途径。(H) 在按 (E) 所示处理的类器官中,FXR 靶标Fgf15和Shp (左)编码的 mRNA 以及包括Lgr5、Ascl2和Olfm4 (右)在内的肠干细胞标记物编码的 mRNA 的 RT- qPCR 结果。(I) 小鼠肠隐窝中Catb和Olfm4 mRNA的表达。
+ + + + + + + + + + +
结 论
本项研究通过临床队列和阿司匹林治疗的小鼠,他们鉴定了一种肠道微生物Parabacteroides goldsteinii,其生长受到阿司匹林抑制。补充Parabacteroides goldsteinii或其 BAs 代谢物7-keto-LCA的小鼠表现出阿司匹林介导的肠道生态位和肠道屏障损伤减少,而Parabacteroides goldsteinii hdhA 突变体则失去了这种作用,无法生成 7-keto-LCA。具体来说,7-keto-LCA 通过抑制肠道 BAs 受体、FXR的信号传导来促进肠上皮的修复。7-Keto-LCA是一种 FXR 拮抗剂,可促进Wnt 信号传导,从而促进肠道干细胞的自我更新。这些结果揭示了口服阿司匹林对肠道微生物群和肠道BAs 代谢的影响,进而调节胃肠道稳态。
+ + + + +



 English
English


