文献解读|Cancer Discov(29.7):追踪从原发性 ccRCC 到转移性 ccRCC 的非遗传进化:TRACERx 肾
✦ +
+
论文ID
原名:Tracking Nongenetic Evolution from Primary to Metastatic ccRCC: TRACERx Renal
译名:追踪从原发性 ccRCC 到转移性 ccRCC 的非遗传进化:TRACERx 肾
期刊:Cancer Discovery
影响因子:29.7
发表时间:2025.01.08
DOI号:10.1158/2159-8290.CD-24-0499
背 景
虽然在肾透明细胞癌(ccRCC)中遗传进化的关键方面及其临床意义已得到充分证实,但遗传特征如何与表型和肿瘤微环境(TME)共同进化仍不清楚。
实验设计
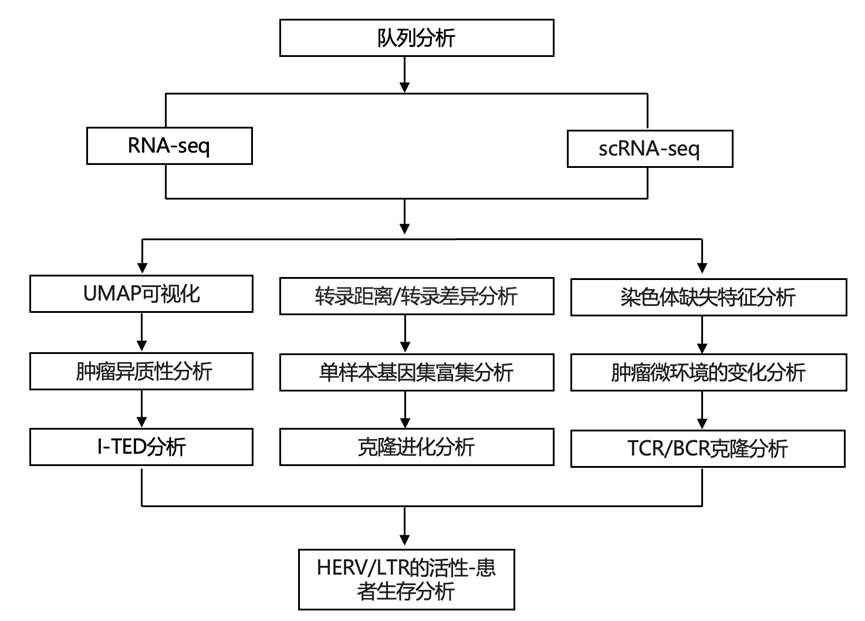
结 果
01
肾透明细胞癌中普遍存在的肿瘤间和肿瘤内转录异质性
TRACERx队列为评估克隆解析肿瘤的转录模式并将其与临床结局联系起来提供了独特的机会。研究团队对TRACERx研究(NCT03226886)纳入的79例患者的243个样本进行了转录组分析(RNA-seq)。本研究的队列包括191个原发肿瘤区域,22个匹配的转移区域,18个匹配的癌栓区域,以及12个癌旁正常样本。该队列反映了整个疾病谱,包括18例I期、4例II期、25例III期和27例IV期肿瘤。研究中的所有样本之前都进行了遗传改变的检测,包括驱动基因的体细胞突变和驱动体细胞拷贝数改变(SCNA)。纳入该队列的肿瘤有不同程度的遗传肿瘤内异质性(ITH)和非整倍体[加权基因组不稳定指数(wGII)(范围:0.01-0.93)],都是克隆进化的重要特征。典型ccRCC驱动基因在本组患者中多为亚克隆性,包括PBRM1(6/79例,7.6%)、SETD2(9/79例,11.4%)、9p缺失(25/79例,31.6%)和14q缺失(29/79例,36.7%),这提供了一个独特的机会,可以在患者体内比较有或无特定体细胞畸变的肿瘤区域,从而控制患者特异性因素对转录变化的影响。
为了可视化TRACERx队列中的转录变异,他们应用统一流形近似和投影(UMAP)降维法对231个肿瘤样本的标准化基因表达计数进行了处理(图1A)。正如预期的那样,可以观察到来自同一患者的样本倾向于在UMAP空间聚集,突出显示患者K243和K390(图1A),观察到患者间转录异质性比转录性ITH高2.9倍。然而,在来自同一患者的不同样本中观察到显著的转录差异。例如,在患者K153中,可以观察到两个不同的聚类,这与它们分别与BAP1和PBRM1突变相关的独立系统发育分支一致(图1A),这强调了ccRCC中存在大量的转录ITH。为了量化转录ITH,他们采用了之前发表的方法,将来自同一患者的肿瘤样本之间的转录差异压缩为一个单一指标:肿瘤内表达距离(I-TED),该指标是使用TRACERx队列中表达差异最大的前500例患者定义。TRACERx队列的I-TED评分差异超过10倍(图1C),反映了ccRCC中广泛的转录异质性,从基本均匀的肿瘤到高度异质性的肿瘤。与遗传性ITH不同,较高的转录性ITH并不与较差的预后相关。
接下来,他们通过包括9个临床和基因特征的多变量分析来研究与I-TED评分方差相关的因素。每个病例检测出的肿瘤区域总数和肿瘤纯度的变异均未对I-TED评分产生混杂影响(图1D)。相反,他们观察到高I-TED值与遗传ITH和受亚克隆拷贝数改变(即拷贝数异质性)影响的基因组比例显著相关,这两项共同解释了I-TED评分19%的变异(图1D)。在单个亚克隆拷贝数驱动因子中,亚克隆9p缺失导致了10.7%的I-TED变异(图1D),比任何其他拷贝数驱动因子改变都多。此外,染色质修饰基因KDM5C、ARID1A、SETD2、PBRM1和BAP1的亚克隆突变可以解释6%的变异,这些基因可能通过下游的表观遗传重塑诱导显著的转录变化。
为了了解影响I-TED的因素如何与个体基因表达的变化相关,他们应用了一个基因水平的线性回归框架。共同分析了肿瘤纯度的变化,并探索与I-TED方差相关的因素的顺式和/或反式效应(图1E)。基因剂量的显著变化解释了4791个(34.2%)基因的表达(图1F),正如预期的那样,基因剂量与基因表达呈强正相关。与I-TED方差分析一致,亚克隆9p缺失和染色质修饰基因的突变分别与3210(22.7%)和2033(14.4%)基因的显著下调和3059(21.7%)和2197(15.6%)基因的显著上调相关(图1F)。在9p缺失后表达发生显著变化的6269个基因中,约5924个位于其他染色体上,这提示9p缺失与全基因组表达变化相关。总体而言,这些因素解释了基因水平49.9%的转录变异,与I-TED评分的多变量回归中解释的43.8%的方差一致(图1D)。综上所述,这表明ccRCC的转录多样化是广泛的,但非唯一的,由遗传变异驱动。
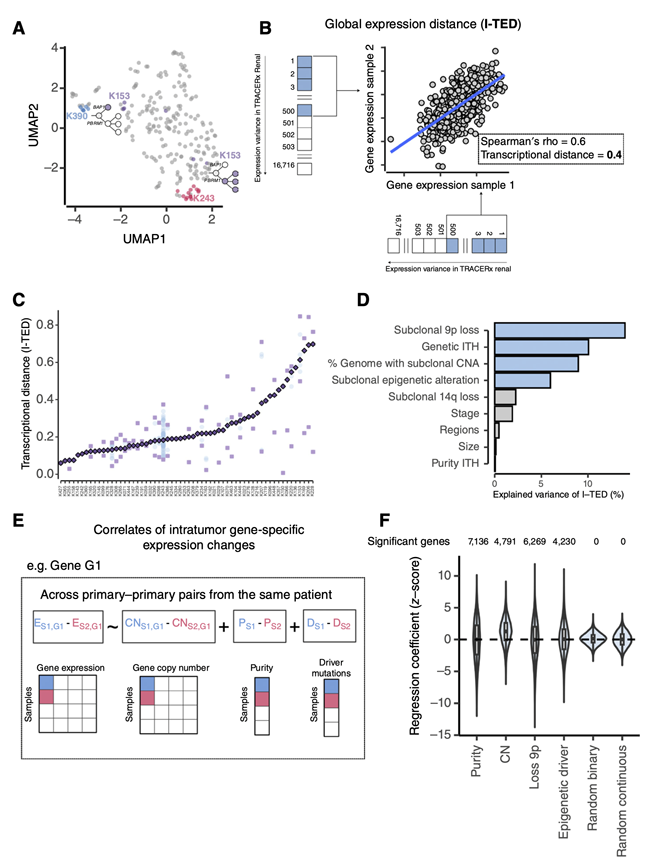
图1. 肿瘤间和肿瘤内的转录异质性在TRACERx队列中普遍存在。
(A)UMAP可视化。(B) 计算来自同一患者的两个样本之间转录距离的示意图。(C) 60例TRACERx患者的原发肿瘤I-TED值。(D) 在包含至少2个样本原发肿瘤区域的60个肿瘤的I-TED值的多元线性模型上,通过9个选择的基因组和临床特征解释TRACERx队列中原发肿瘤I-TED评分的变异比例。(E) 线性回归框架的示意图,用于确定14120个基因中每个基因的患者内表达变化的相关性,包括基因剂量增加/减少和纯度变化的顺式效应。(F) 线性混合效应模型的回归系数分布适用于14120个基因中的每一个和模型中包括的每一个变量,基因总数与顶部突出显示的一个变量显著相关(FDR < 0.05)。
02
ccRCC转录进化反映克隆进化
本研究的目的是在控制患者特异性影响的同时,追踪整个肿瘤发展过程中的转录变化。首先,他们研究了肿瘤演变的两个关键阶段:恶性转化和转移进展的整体转录变化,分析了从多个肿瘤位置(包括肿瘤邻近正常组织和原发肿瘤和相关转移灶的空间分离区域)获取的成对样本之间的转录距离。与来自同一患者的原发-原发肿瘤对相比,原发-正常和原发-转移对之间的转录距离显著较高,从正常组织到原发样本,以及从原发样本到转移样本,8122个基因(3753个下调,4369个上调)和4886个基因(2489个下调,2397个上调)的表达显著改变,这证明了在恶性转化和转移进展过程中发生显著的转录差异(图2A-D)。特别是,从邻近正常肾脏到原发肿瘤,他们观察到参与增殖、糖酵解、氧化磷酸化和对活性氧的反应的基因表达显著增加,而参与有丝分裂纺锤体组装和细胞间连接的基因表达显著降低。这些变化的幅度与到最近共同祖先的距离(MRCA)无关,这可能提示恶性转化时的快速转录变化。同时,从原发肿瘤到转移,他们发现增殖和代谢通路的表达增加,包括MYC或E2F靶点的过表达和氧化磷酸化。
接下来,他们探索了转录多样化是否与本研究队列中肿瘤的克隆结构一致。为了检验这一点,对于每个原发肿瘤,他们分析了不同样本之间的成对转录和克隆距离,其中克隆距离定义为跨越两个不同样本中确定的肿瘤克隆的分歧处的(亚)克隆扩增的总数。他们观察到,转录距离随着克隆距离的增加而增加(图2E),表明尽管有转录可塑性,克隆进化导致基因表达的进行性和稳定的变化。
鉴于在转移灶中观察到显著的转录变化(图2C-D),他们接下来的目的是确定在原发肿瘤克隆进化过程中获得的转录变化是否至少有一部分在已建立的转移灶中维持。首先观察到,在考虑原发灶-转移灶对时,克隆和转录距离之间的关系保持不变。此外,对于TRACERx队列,可以将转移的克隆起源分配到特定的原发肿瘤区域。在匹配的原发肿瘤中,转移本身的表达模式比非转移区域更接近转移种植区域(图2F)。这可能意味着,在已确诊的转移瘤中观察到的很大一部分转录变化是通过原发肿瘤进化过程中积累的可遗传变化逐步获得的。因此,与转移灶的克隆距离最小的原始样本可能最能反映转移灶样本的肿瘤特异性转录特征,但不一定能反映与TME相关的转录特征。
利用每个克隆的基因表达谱,他们对50个标志特征进行了单样本基因集富集分析(ssGSEA),并将其分解为7个功能群(信号、增殖、通路、代谢、DNA损伤、发育、细胞成分),与之前的研究结果相似,后期出现的克隆具有增殖潜能增加,激活FAS-磷酸戊糖和omega-氧化代谢途径和未折叠蛋白反应,以及降低DNA损伤修复能力和激活PI3K/AKT/mTOR等信号通路的特征(图2G)。
ccRCC中较晚出现的克隆比较早出现的克隆表现出更强的增殖能力。这可能意味着,至少有一部分正向选择是由肿瘤增殖潜能增加驱动的,这将促进克隆扩增。这一趋势在患者K243中得到了体现,在患者中,较晚出现的克隆的增殖连续增加(图2H),并且平行扩增和维持的克隆的增殖潜力相当。
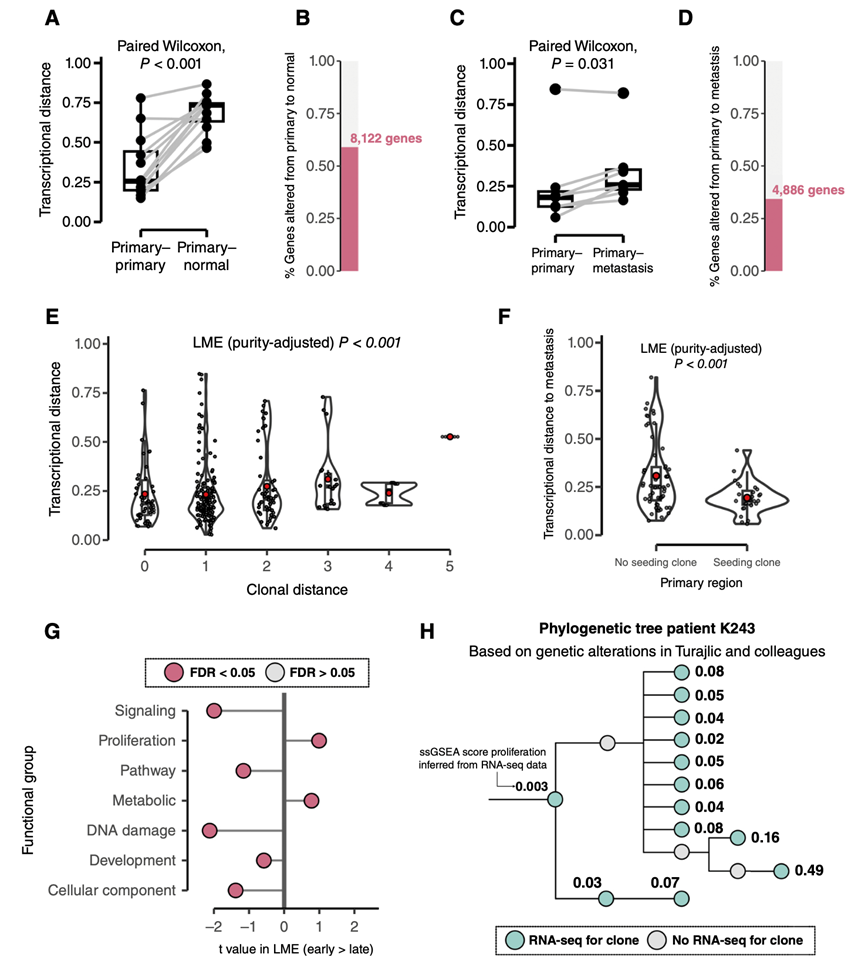
图2. 转录进化反映克隆结构并遵循循环趋势。
(A) 原发肿瘤样本与其他原发肿瘤样本或邻近正常肾样本之间的转录距离。(B) 使用基因特异性线性回归框架,正常原发性对中与表达变化显著相关的基因比例。(C) 原发肿瘤样本与其他原发肿瘤样本或匹配转移瘤之间的转录距离。(D) 使用基因特异性线性回归框架,与原发转移对中表达变化显著相关的基因比例。(E) 285对原发肿瘤样本之间的转录距离随着克隆距离的增加而增加,定义为位于两个不同单克隆区域的克隆之间的距离。(F) 转移样本和配对原发样本之间的转录距离取决于原发区域是否包含种子克隆。(G) 克隆基因表达的关联。(H) 患者k243的系统发育树。
03
肾透明细胞癌转移进展的体细胞拷贝数驱动因素可诱导反复的转录变化
染色体9p和14q的缺失已确定为ccRCC转移的标志性基因组驱动因素,9p21和14q31位点的基因破坏介导了它们的表型影响和选择性优势。然而,它们带来转移能力的机制尚不清楚。之前试图了解其转录影响的尝试比较了不同患者的肿瘤,从而引入了潜在的患者特异性混杂因素。为了解决这一缺点,他们比较了有或无9p缺失和/或14q缺失的同一原发肿瘤样本(图3A)。9p和14q缺失均与几个转录程序的变化相关(图3B),并且9p缺失与更严重的转录失调相关。特别是,9p杂合性缺失或9p21纯合缺失的样本显示干扰素α和干扰素γ反应基因的表达显著降低(图3 b)。拷贝数缺失后9p21 IFNⅰ基因聚类的顺式下调可能部分支持这一关联。此外,9p缺失与增殖能力增加密切相关(图3B)。由于在本研究的队列中,9p和14q缺失可能同时发生,因此他们利用来自8项之前发表的研究的954,023个细胞的单细胞转录组分析(scRNA-seq)数据进一步研究了这一关联的特异性。利用InferCNV技术,他们分析了9p和/或14q缺失的单个细胞,包括5个亚克隆9p缺失而无14q缺失的样本和13个亚克隆14q缺失而无9p缺失的样本。差异表达分析表明,仅9p缺失而不是14q缺失与增殖增加相关(图S14A-F)。细胞增殖的增加可能是由观察到的CDKN2B的顺式下调驱动的(图3C)。综上所述,这可能提示9p缺失对增殖潜能获得和免疫逃避的深刻影响,这可能解释其与转移能力的强关联。
他们比较了所有增殖水平较高和较低的9p缺失肿瘤,观察到具有较高增殖能力的肿瘤有较差的结局,而增殖指数较低的患者尽管有9p缺失,但结局较好。89%(16 / 18)的高增殖病例具有杂合性缺失(15/16)或纯合性缺失(1/16)9p。这提示,为了获得转移能力,9p缺失的亚克隆可能需要诱导特定的表型变化,例如细胞增殖增加,而这并不是由9p的第二个局灶性缺失所驱动。这一观察结果提示将9p缺失作为风险分层的生物标志物,提示将其与表型指标结合可能提高其效用。
虽然9p和14q缺失是与ccRCC转移相关的最强的单个SCNA,但与那些没有转移能力的SCNA相比,转移亚克隆通常有更高的非整倍体负荷,反映了潜在的染色体不稳定性(CIN),升高的CIN可以通过cGAMP激活cGAS-STING通路,从而触发抗肿瘤免疫反应。他们评估了与cGAS-STING反应相关的基因的表达如何随着非整倍体的增加而变化。通过比较同一肿瘤内具有高非整倍体和低非整倍体(通过加权基因组不稳定指数:wGII)的区域来控制患者特异性因素。
出乎意料的是,他们注意到,与非整倍体较低的肿瘤区域相比,在高非整倍体的健康细胞中(图3D),通常由cGAS-STING激活触发的CXCL11、CXCL10和cxcl9趋化因子表达降低,这提示经典cGAS-STING激活以某种方式绕过。在相同的差异表达分析中,他们观察到SLC19A1和ENPP1在高非整倍体区域的过表达(图3D),并通过多重免疫荧光(MIF)证实ENPP1的表达是肿瘤细胞特异性的(表达PAX8)(图3E-F)。ENPP1是一种外核苷酸酶,可降解cGAMP,cGAMP是一种有效的免疫刺激因子,在cGAS检测到胞质DNA后释放。cGAMP降解为免疫抑制因子腺苷。SLC19A1是cGAMP的一个导入子,其在ccRCC细胞中的过表达可能导致肿瘤细胞对cGAMP的重吸收增加,减少细胞外cGAMP及其因免疫细胞内化,从而限制有效的抗肿瘤反应。此外,他们观察到过表达SLC19A1和/或ENPP1的高度非整倍体肿瘤区域具有免疫抑制性TME的特征,其特征是T效应细胞功能降低和髓系炎症增加。
他们确定了另一种在肿瘤进展过程中选择的重要表型,并推断在高度非整倍体ccRCC中激活cGAS-STING抑制因子将影响临床结局。在TRACERx和TCGA-kidney肾透明细胞癌(KIRC)队列中,wGII高且SLC19A1和ENPP1表达升高的肿瘤均显示了最短的进展时间(图3G)。值得注意的是,在TRACERx 队列研究中,wGII高而SLC19A1和ENPP1低表达的患者预后最好,这提示在不有效抑制CIN触发的免疫激活的情况下,CIN的增加可能并不能使ccRCC进展获益。SLC19A1高表达也与各种肿瘤类型的较差预后相关,验证了先前报道的ENPP1表达与泛癌症预后相关。
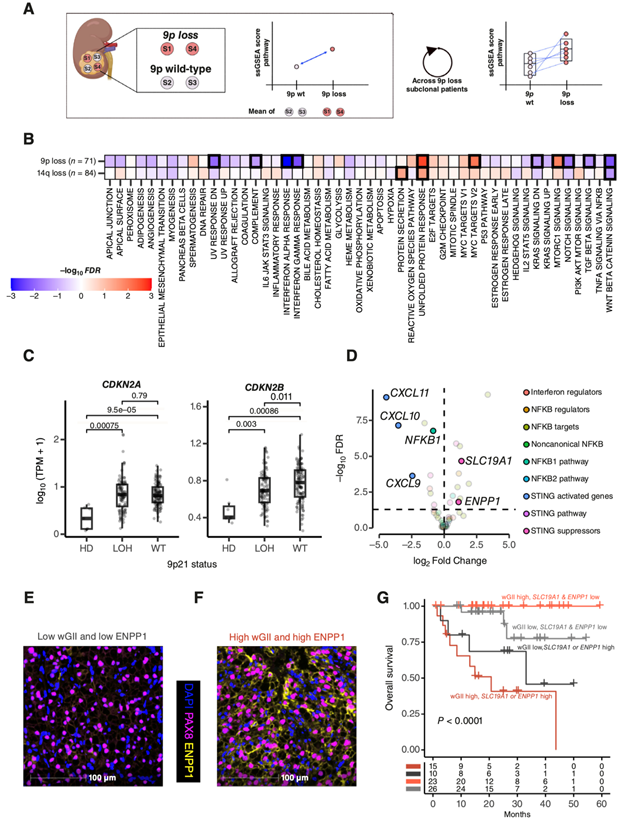
图3. 典型的ccRCC亚克隆驱动因子和非整倍体负荷驱动肿瘤转录组的特异性变化。
(A) 在没有患者特异性因素混杂效应的情况下分析亚克隆拷贝数改变的转录关联的程序说明。(B) 50个不同标志特征的转录变化与ccRCC亚克隆9p和14q缺失的关联。(C) CDKN2A 和CDKN2B 的表达。(D) cGAS-STING通路上下游基因的差异表达分析。(E-F) 具有代表性的TRACERx肾肿瘤样本MIF图像。(G) 生存分析。
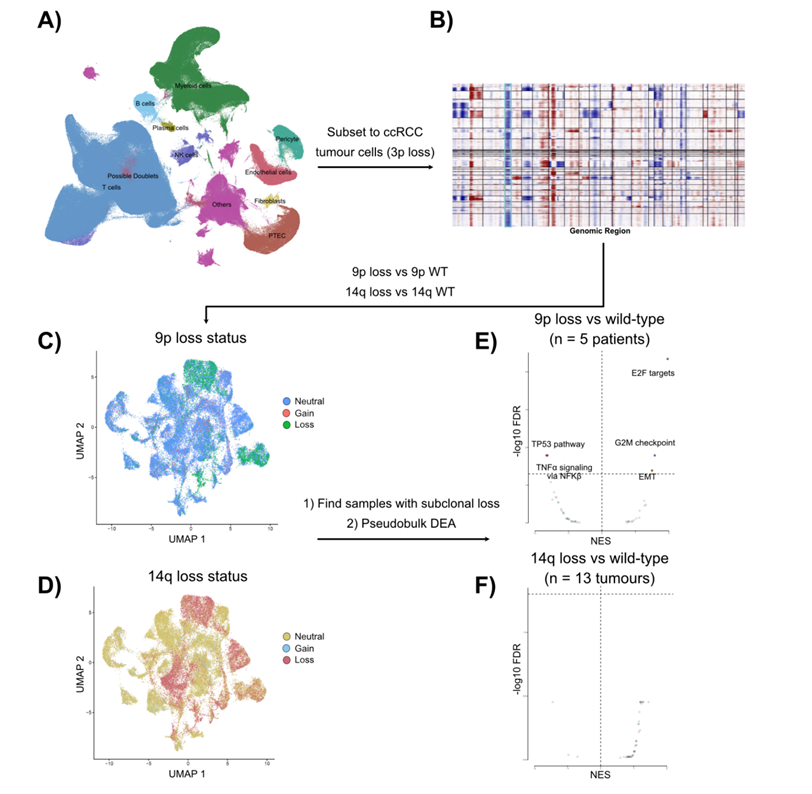
图S14. 在单细胞分辨率下,9p缺失的获取与细胞增殖途径的诱导相关。
(A)UMAP可视化。(B) InferCNV确定了一群基于3p缺失的病理鉴定的ccRCC肿瘤细胞。(C-D)UMAP可视化。(E-F) 对野生型细胞的9p缺失或野生型细胞的14q缺失进行假体差异表达分析,在50个MSigDB标志特征上进行的基因集富集分析(GSEA)的火山图结果。
04
TME的演变
他们试图探究TME组成与不同进化轨迹之间的关系。在TRACERx 队列研究的背景下,公开数据描述了7种进化亚型——BAP1驱动、PBRM1-SETD2、PBRM1-SCNA、PBRM1-mTOR、VHL野生型(WT)、多干驱动和非驱动亚型,这些亚型的特征是驱动事件排序、共发生和相互排异在克隆水平的不同模式。比较每个进化亚群样本中不同免疫细胞亚群与所有其他亚群的丰度,他们可以观察到不同的进化轨迹以不同的免疫TME图谱为特征(图4A)。VHL WT轨迹上的肿瘤表现出内皮细胞和所有免疫细胞的显著耗竭,尤其是细胞毒性细胞(如NK细胞和CD8+ T细胞)。相反,BAP1驱动的肿瘤表现出较高水平的免疫浸润,尤其是髓系细胞,内皮细胞水平较低。具有分支进化模式(包括PBRM1-mTOR、PBRM1-SETD2和PBRM1-SCNA轨迹)的肿瘤也显示出免疫浸润的总体增加。然而,浸润模式不同:PBRM1-SCNA肿瘤的髓系细胞相对丰度较高,而PBRM1-mTOR,尤其是PBRM1-SETD2肿瘤的细胞毒性细胞(包括CD8+ T细胞)相对丰度较高。综上所述,这可能表明,TME至少部分地塑造了进化轨迹,或者跨越了某个轨迹,其体细胞改变最终重塑了TME。
接下来,他们研究了TRACERx队列中瘤患者的肿瘤内TME异质性。RNA-seq反卷积的层次聚类确定了代表总体免疫浸润高、中和低水平的三个样本聚类(图4B)。对于32例(50%)患者,他们观察到不同原发肿瘤区域的免疫浸润模式不同(图4B)。在整个TRACERx队列中,TME ITH范围差异很大,TME ITH较高的患者有不显著的结局较差趋势,这表明TME ITH在ccRCC中普遍存在。
为了更好地理解这种TME ITH的性质,他们将单个原发肿瘤样本的TME分为抗肿瘤或免疫抑制。在TRACERx队列中来自同一患者的全部229对样本中,他们检测到71对具有抗肿瘤↔免疫抑制开关,54对具有保守的抗肿瘤TME,104对具有保守的免疫抑制TME(图4C)。为了确定在肿瘤进化过程中,TME中的这些开关是否在特定方向发生,他们在51对样本中测试了它们的富集,其中一个样本含有末端克隆(代表采样时肿瘤进化的终末阶段),另一个样本含有非末端克隆。该分析揭示了12种抗肿瘤→免疫抑制的转变(图4D),以及伴随的细胞毒性浸润减少,支持在单个ccrcc的整个进化过程中发生的进行性免疫功能障碍。
与在9p缺失的肿瘤区域观察到的IFN下调模式一致,他们在40对样本之间确定了24个抗肿瘤→免疫抑制的转换,其中一个样本的9p染色体臂完整,另一个样本的9p缺失(图4E)。最后,由于观察到SETD2突变的广泛平行进化,以及这种进化是由特定生态位驱动的可能性,他们在47对样本(其中一个样本为SETD2 WT,另一个样本为SETD2突变)中评估了与SETD2突变同时发生的TME转变,观察到15个从WT到突变型SETD2区域的抗肿瘤→免疫抑制的转变(图4F)。这表明,SETD2突变克隆沿PBRM1-SETD2轨迹位于总体高细胞毒性肿瘤的特异性免疫抑制口袋中(图4A)。与9p缺失和SETD2改变同时发生的抗肿瘤→免疫抑制转变的富集得到了较低的细胞毒性T细胞浸润的证实,而在其他反复出现的亚克隆驱动因素中未发现这种情况。
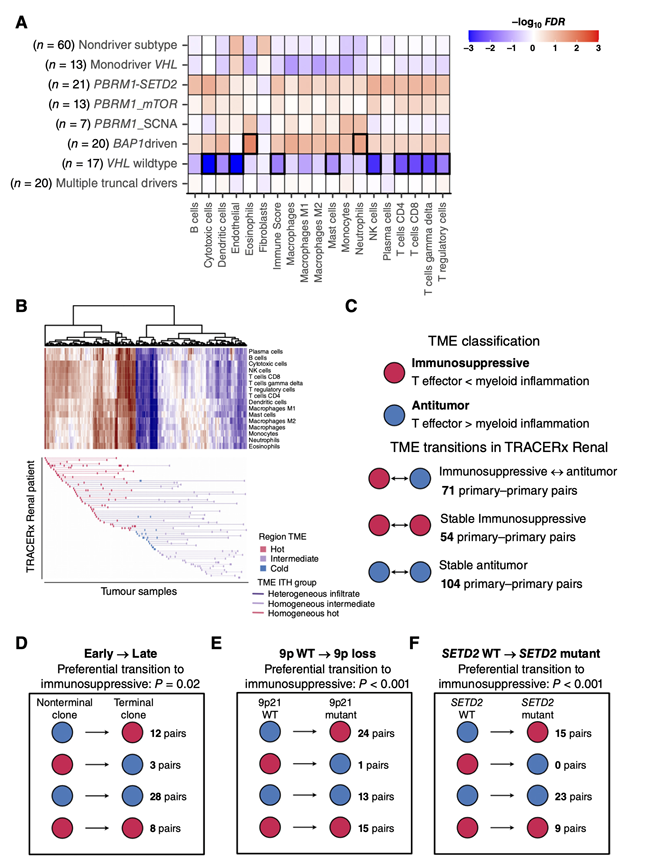
图4. ccRCC患者TME的异质性。
(A) TME细胞丰度与肿瘤进化轨迹的关系。(B) 213个TRACERx肾肿瘤样本的免疫浸润模式聚类。(C) 使用T效应因子和髓系炎症z评分之间的相对差异对TME进行二分类。(D-F) 早期→晚期原发-原发对(早期由含有非末端克隆的样本代表,晚期由含有末端克隆的样本代表),SETD2 WT→SETD2-突变原发-原发对,9p WT→9p缺失原发-原发对,向免疫抑制性TME的方向富集。
05
免疫适应性反应的进化
最近的研究强调了ccRCC患者的适应性免疫应答,尤其是T细胞应答的效用,以识别那些可能对ICB有良好应答的患者。为了更深入地了解未经治疗的ccRCC肿瘤中T细胞和B细胞应答的演变,他们使用MiXCR从TRACERx队列的RNA-seq数据中提取T细胞和B细胞受体(分别为TCR和BCR)库。在TRACERx队列中,MiXCR共识别出16582种独特的TCR克隆型和159801种独特的BCR克隆型,包括来自79例患者的243份ccRCC和肾旁正常样本。他们首先分析了来自同一患者的不同肿瘤样本的T和B细胞库的相似性。TCR和BCR库在不同的肿瘤区域有显著差异,BCR和TCR库的最大中位相似度分别为60%和61%(图5A)。TCR和BCR谱的相似性与患者预后均不相关,两者联合也不相关(图5B)。
虽然在T和B细胞区室中观察到肿瘤内克隆多样性,但研究结果表明,存在于正常和转移样本中的一部分T和B细胞克隆与其相应的原发肿瘤相同。具体而言,68%和83%的转移灶至少含有原发肿瘤中也发现的TCR和BCR克隆。在邻近正常肾组织中,原发肿瘤TCR克隆的上述百分比为42%,原发肿瘤BCR克隆的上述百分比为87%(图5C)。结果提示,相同的旁观者T和B细胞克隆存在于远处部位,以及肿瘤特异性T和B细胞从原发肿瘤或循环系统迁移至转移部位。在原发肿瘤样本和匹配的转移性或正常样本中发现的T细胞克隆在原发肿瘤内表现出较高的克隆性,这与它们在适应性抗肿瘤免疫应答期间的扩增一致。
接下来,他们试图整合肿瘤系统发育结构,以更深入地了解T和b细胞应答的驱动因素。他们提出假设:如果适应性免疫应答靶向可遗传(新)抗原,将观察到随着肿瘤进化过程中新抗原库的变化,TCR或BCR库的逐渐多样化。为了研究这一假设,他们将成对肿瘤区域之间的克隆距离与其TCR或BCR库的相似性联系起来。他们未检测到克隆距离和BCR相似性之间的任何关联,但确实发现TCR相似性和克隆距离之间的强关联(图5D),通过瘤内遗传异质性或体细胞改变负担的替代指标未能完全协调,这表明在ccRCC进化过程中,由遗传或表观遗传累积的可遗传变化推动的动态T细胞反应。值得注意的是,他们观察到,在原发肿瘤中,转移瘤与其克隆祖先之间的TCR相似性高于更远的克隆(图5E),这表明靶向原发肿瘤进化过程中获得的抗原的TCR克隆也浸润转移瘤。
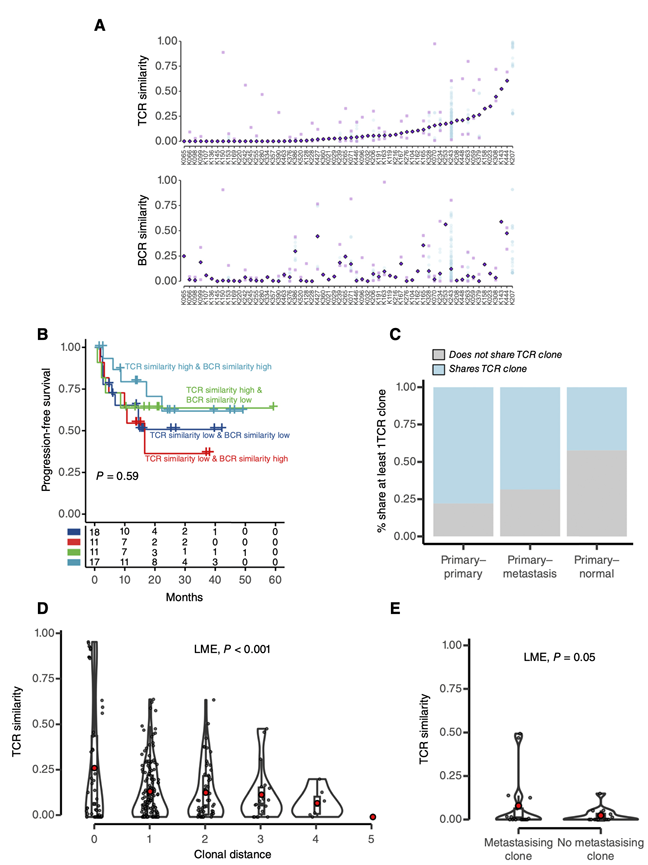
图5. TCR库的空间多样性提示ccRCC的抗原来源具有可遗传性。
(A) TCR和BCR的相似性对60例TRACERx队列患者至少两个区域的采样。(B)生存分析。(C)TCR克隆分析。(D) 285对原发肿瘤样本的TCR相似性随着克隆距离的增加而增加,定义为两样本中各克隆之间的距离。(E) 转移样本和配对原发样本之间的TCR相似性取决于原发区域是否包含转移克隆。
06
HERV在ccRCC进化中的转录活性
内源性逆转录因子表达的去抑制仍然是ccRCC免疫原性的一个潜在但尚未解决的来源,此外还可以通过不同的方式促进肿瘤的发生,包括促进肿瘤的人类内源性逆转录病毒蛋白,诱导宿主细胞基因表达的变化,以及促进插入突变和/或染色体重排。人内源性逆转录病毒(HERV)的表达与肾透明细胞癌的免疫治疗反应相关。HERV-E抗原尤其值得关注,靶向这些成分的嵌合抗原受体(CAR) T细胞过继转移的临床试验正在ccRCC患者中进行。
为了研究克隆进化背景下HERV的转录去抑制,他们使用先前描述的新组装的癌症转录组对TRACERx队列中的HERV表达进行了定量分析。该方法考虑了转录本重叠重复元素的结构,可以更准确地量化。特别地,他们确定了615个重叠注释的HERV和其他长末端重复(LTR)元件的转录本。对这组转录本进行UMAP可视化后,他们发现了与整个肿瘤转录组中观察到的相似的肿瘤内和肿瘤间异质性模式。HERV/LTR的表达或外显子化是由与癌症进展相关的表观遗传变化驱动,并且一些HERV通过VHL缺失而上调。鉴于多个ccRCC驱动基因(VHL, PBRM1, SETD2, BAP1)对HERV/LTR表达的潜在影响,他们检测了这些元件的整体表达与上述基因突变状态的关联。VHL突变或甲基化与中位HERV/LTR表达密切相关,而ccRCC进化过程中随后发生突变的基因与中位HERV/LTR表达无关(图6A),这表明HERV/LTR表达的诱导是ccRCC进化的早期事件。随后,HERV/LTR表达也可通过其遗传位点的拷贝数改变来调节,6.1%显示出与拷贝数增加显著相关。他们进一步比较了HERV/LTR在VHL改变与VHL野生型肿瘤和邻近正常组织中的表达。与野生型VHL和正常样本相比,在VHL突变或甲基化的肿瘤样本中,只有5个与ERV1和ERVL LTR元件重叠的转录本显著上调(图6B),提示对HERV/LTR元件进行了全面去抑制,而不是对VHL缺失后的一部分逆转录元件进行去抑制。
为了研究HERV的表达是否与TME的改变相关,他们检测了不同细胞群的丰度之间的相关性,以及HERV/LTR重叠转录本的总体中位表达和两个特异的HERV-E成员(Chr6q15和Chr19q12)的表达与ccRCC的抗肿瘤T细胞反应相关。HERV/LTR的总体表达与肿瘤纯度的增加呈正相关,证实了相当大比例的HERV/LTR转录本在肿瘤细胞中表达。HERV/LTR的总体表达与任何免疫细胞亚型没有正相关,甚至与不同的髓系细胞亚群(嗜酸性粒细胞和中性粒细胞T细胞和NK细胞)。同样,已知在ccRCC中上调的两个推定的免疫原性HERV-E成员的表达与TME中的任何特定细胞群均无正相关,而HERV-E Chr6q15(也称为ERVE-4)的表达与细胞毒性NK细胞呈负相关。此外,总体HERV/LTR表达与TCR或BCR多样性不相关,仅与干扰素(IFN)特征弱相关(图6C),这表明通过联合定量所有ccRCC特异性HERV的中位表达量,不能轻易推断HERV/LTR表达对肿瘤固有和适应性免疫原性的潜在贡献。
最后,他们探讨了HERV/LTR转录本的表达水平与临床结局的相关性。有趣的是,尽管HERV/LTR转录本的总体表达水平与免疫指标无关,但无论癌症分期如何,HERV/LTR转录本的总体表达水平均与生存改善相关(图6D)。在个体HERV/LTR转录本水平,他们未观察到任何与生存期显著相关,只有59个和13个分别与结局改善呈正相关和负相关。对于前5个单独的HERV/LTR元件,他们观察到它们嵌入在蛋白编码和非编码基因内或附近,而不是独立转录的、可能具有免疫原性的HERV。免疫原性herv HERV-E Chr6q15和HERV-E Chr19q12的表达与生存期无显著相关。综上所述,这提示较高的中位HERV/LTR表达和生存率之间的关联不是由任何单独的HERV/LTR元件驱动,也不是由与这些元件的整体去抑制同时发生的可检测到的更主动的免疫反应驱动。相反,只有特定的HERV亚群可能触发免疫应答,整体HERV/LTR表达和生存率之间的关联可能归因于失调的HERV/LTR对肿瘤的内在影响。
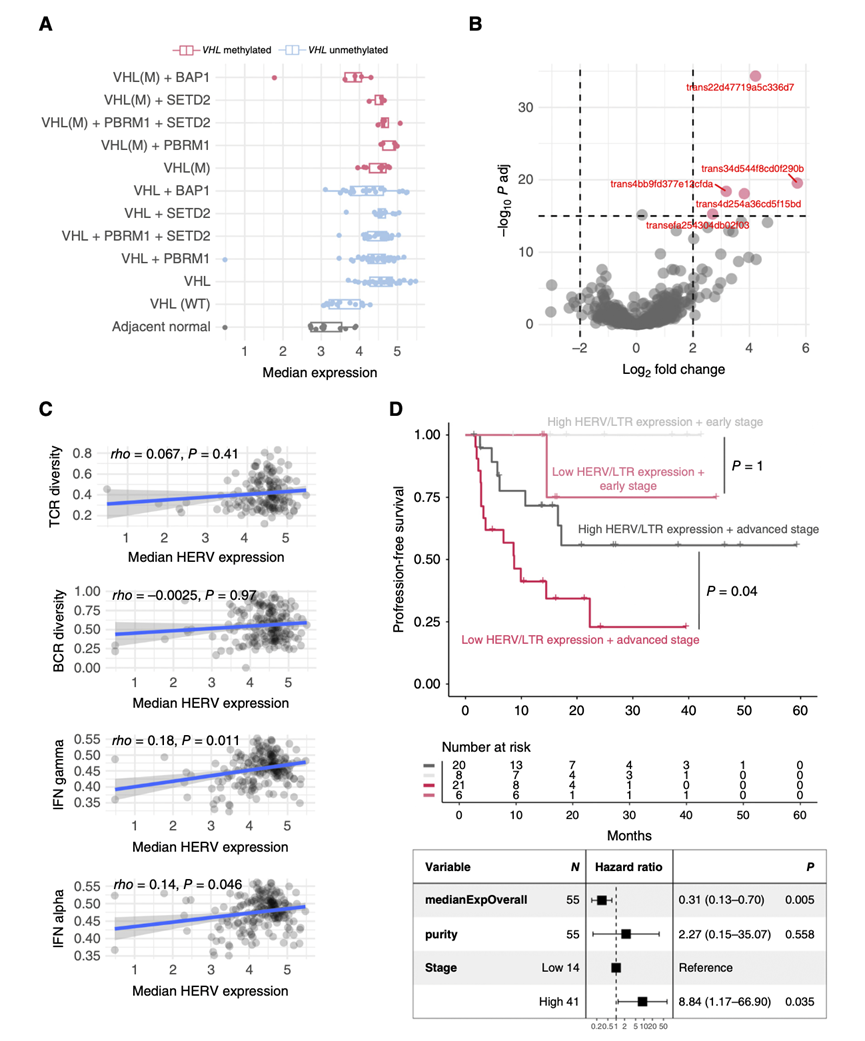
图6. 在ccRCC中,较高的HERV总体表达(与VHL功能丧失密切相关)与较长的无进展生存期相关。
(A) 在TRACERx肾(n = 243个样本)中615个转录本重叠注释逆转录元件的中位表达分布。(B) VHL功能缺失(甲基化或突变)的肿瘤样本与VHL野生型肿瘤样本或邻近正常组织的差异表达分析。(C) TCR多样性、BCR多样性、IFN α和gamma ssGSEA评分(每个患者的中位数)与中位HERV表达的相关性(从上到下)。(D)生存分析。
+ + + + + + + + + + +
结 论
本研究通过对 TRACERx 队列研究招募的 79 名患者的 243 个样本进行基因组-转录组联合分析,发现了普遍存在的非遗传性肿瘤内异质性,其中超过 40% 不能归因于遗传改变。通过整合肿瘤转录组和系统发育结构,观察到在高度非整倍性的情况下向特定表型特征的趋同进化,包括细胞增殖、代谢重编程和假定的 cGAS-STING 抑制剂的过度表达。本研究还发现了肿瘤和 T 细胞库之间的共同进化,以及 TME 从抗肿瘤状态到免疫抑制状态的纵向转变,这与反复获得晚期 ccRCC 驱动因素 9p 缺失和SETD2突变有关。本研究揭示了 ccRCC 中与临床相关的、迄今为止未曾重视的非遗传进化模式。
+ + + + +



 English
English


