文献解读|Cell Host Microbe(20.6):多组学特征揭示正常和患病皮肤中痤疮杆菌的基因组和功能异质性
✦ +
+
论文ID
原名:Multi-omics signatures reveal genomic and functional heterogeneity of Cutibacterium acnes in normal and diseased skin
译名:多组学特征揭示正常和患病皮肤中痤疮杆菌的基因组和功能异质性
期刊:Cell Host & Microbe
影响因子:20.6
发表时间:2024.06.26
DOI号:10.1016/j.chom.2024.06.002
背 景
皮肤微生物群是一个复杂的生态系统,由皮肤表面和毛囊皮脂腺内的微生物组成,它们参与维持皮肤稳态,也与许多皮肤疾病有关。痤疮杆菌(C. acnes) 是自青春期以来健康皮肤上分布最广泛的共生细菌。C. acnes通过增强皮肤屏障功能、调节皮肤 pH 值、抵抗金黄色葡萄球菌 (S. aureus) 定植、和调节先天性和适应性免疫,在皮肤稳态中发挥关键作用。其中,C. acnes最为人所知的是它在寻常痤疮(简称“痤疮”)中的致病作用。宏基因组研究表明,C. acnes的种系型多样性而非相对丰度在痤疮病变中降低,并且痤疮相关种系型的特征是毒力因子 (VF) 表达增加,从而加剧炎症。然而,C. acnes在介导皮肤生理和病理过程中的确切作用仍有待阐明。
实验设计
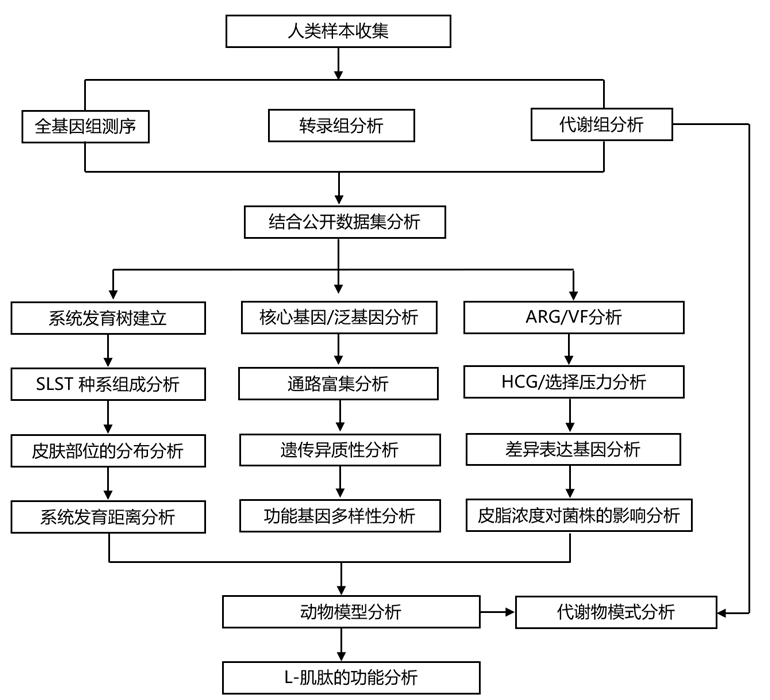
结 果
01
C. acnes的遗传异质性受正常和患病皮肤中的个体和皮肤部位的影响
研究团队从健康个体、特应性皮炎 (AD)患者和痤疮患者的不同皮肤部位组织样本,比较了三组内和三组之间的C. acnes的遗传异质性,三组包括 11 名健康对照者 (HC)、10 名中度至重度 AD 患者和 11 名中度痤疮患者。根据形态,每个皮肤部位随机选择并纯化约 10-20 个C. acnes菌落(图 1 A)。他们为健康个体指定了四个代表性采样部位:油性皮肤(面部)、干燥皮肤(前臂)、湿润皮肤[肘前窝 (AF)]和特殊皮肤(足底)。从 AD 组采集面部、前臂和 AF 病变周围的非病变区域。从痤疮组采集面部病变周围区域和前臂和 AF 的两个非病变部位。纯化总基因组 DNA 并进行全基因组测序 (WGS)。共分离出 1370 个C. acnes克隆,获得 1234 个高质量痤疮梭菌基因组数据。从每个个体和皮肤部位随机选择一株C. acnes菌株进行转录组测序,并对培养上清液进行代谢组分析(图 1 A)。
基于1234株C. acnes核心基因组单核苷酸多态性(SNP)构建的分子系统发育树显示,单位点序列分型 (SLST) 和多位点序列分型 (MLST) 在同一个体内共存,不同个体间存在差异(图 1B-C)。SLST 成功鉴定出比 MLST 更多的菌株亚组,且亚组分辨率相似。由于 SLST 也适用于不依赖培养的研究,因此他们在后续分析中主要使用 SLST 系统发育型,注意到一些 SLST 系统发育型聚集在特定的个体或疾病组中(图 1D)。在 HC 中,与 AF 和前臂相比,面部富含 A5 型,而 H4 型相对减少;然而,作为一个更加孤立的部位,足底相对缺乏在其他身体部位广泛存在的 A2 (图 S1 A)。H1、H15 和 C6 类型仅在 AD 中发现,而 H4 类型在 HC 中相对富集。痤疮中C. acnes的种系型多样性降低,以 SLST F4 为优势种(图 S1 A)。WGS 数据显示了不同个体和皮肤部位中C. acnes种系型分布复杂多样,尤其是在 HC 和 AD 中。然后,他们为每个个体的每个部位随机选择最多 3 个代表菌株并重建系统发育树。个体内不同皮肤部位的C. acnes菌株具有不同的最近共同祖先,这表明多个祖先导致了C. acnes个体内种系多样性(图S1B-D)。
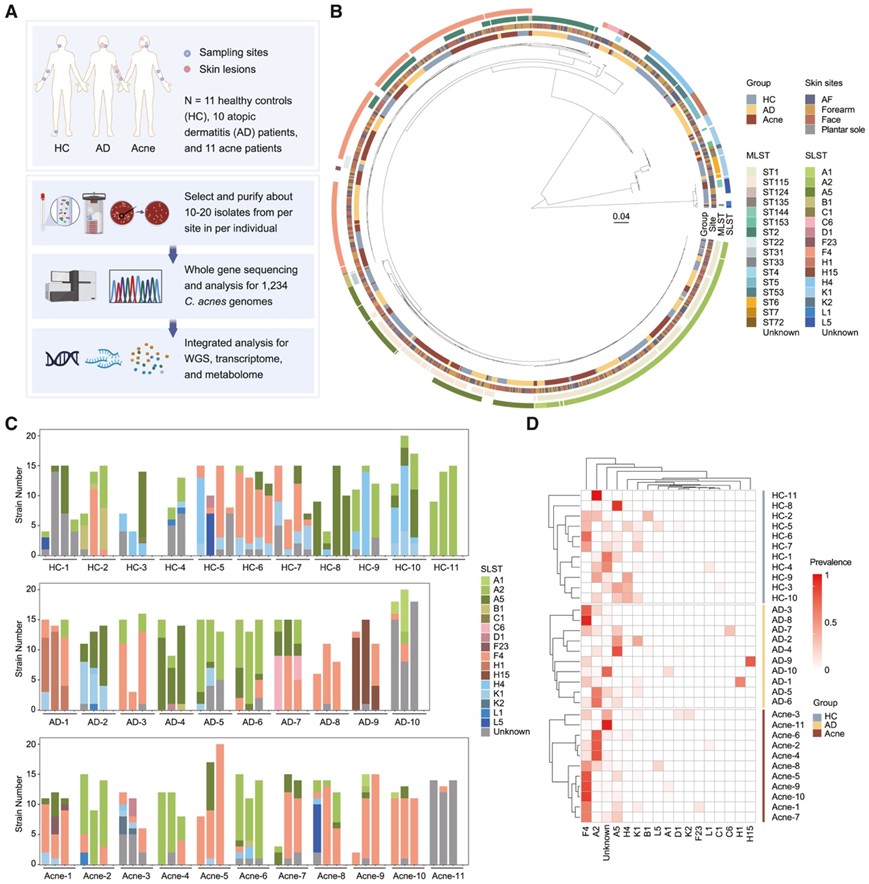
图1. 正常和患病皮肤中痤疮痤疮的多位点,高分辨率全基因组景观。
(A) 研究设计示意图。 (B) 所有分离株基于核心基因 SNP 的近似最大似然系统发育树。(C) 每个人皮肤部位C. acnes菌株的 SLST 种系组成。(D) 不同个体的 SLST 种系型的患病率聚类热图。
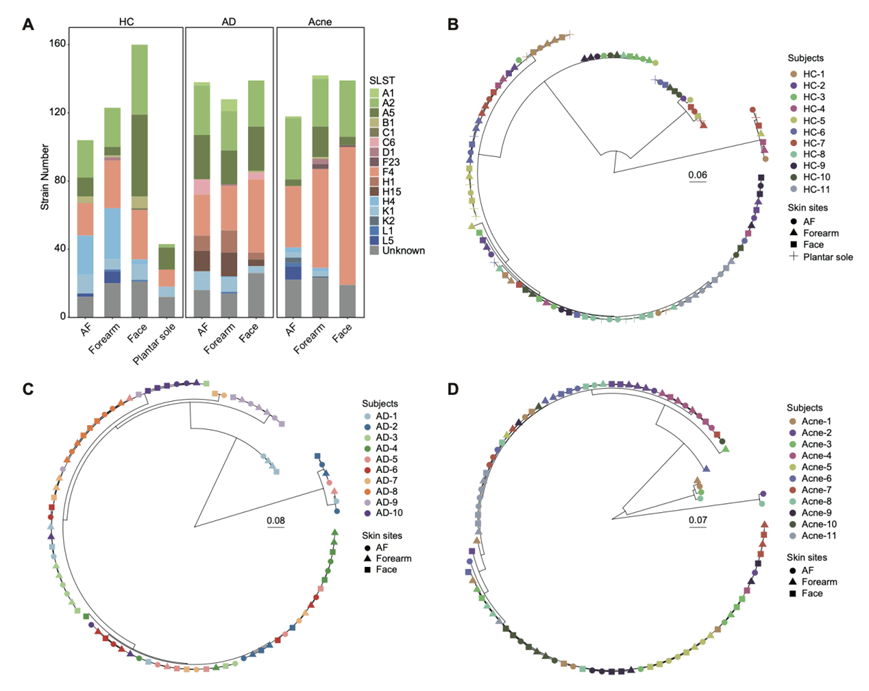
图S1. 痤疮的遗传异质性受健康和患病皮肤的个体和皮肤部位的影响。
(A) 在HC、AD和痤疮组中SLST在不同皮肤部位的分布。(B-D) 代表性C. acnes在个体内的进化示意图。
02
C. acnes的基因组分析
根据系统发育距离,HC中菌株的遗传异质性显著高于AD和痤疮组,痤疮组菌株的遗传异质性最低(图2 A)。个体间和部位间遗传异质性显著高于同一个体内部或同一皮肤部位内的遗传异质性(图2 B-C)。这些模式在包含来自23名受试者(5名健康对照组,6名AD患者和12名痤疮患者)的211株毒株的独立验证数据集中也很明显,在一个个体的相同皮肤部位去除核心基因组核苷酸差异为0的131株毒株后也很明显(图S3A-F)。此外,公开报道的HC来源和皮肤拭子采样的C. acnes的独立数据集中也观察到了个体和皮肤部位对基因组异质性的影响(图S3G-H)。他们还注意到 HC 显示出相对更高水平的皮肤部位特异性系统发育结构(图 2 D)。总的来说,C. acnes的多尺度遗传多样性表明,在个体层面上存在独特的基因分布模式,受疾病和皮肤部位形成的皮肤微环境的影响。
为了比较C. acnes基因组在群体内的保守性,他们使用 Roary 从总编码序列中确定泛基因组。C. acnes泛基因组呈现出开放基因组模式,痤疮具有最大的附属基因组大小(图 2 E)。与个体特定核心基因组共享的基因内容相比,与C. acnes个体特定泛基因组共有的基因内容表现出更大的个体特异性(图2F-G)。每个个体都有独特的C. acnes附属基因(图 S4 A),并且C. acnes附属基因的流行率在不同的皮肤部位不同,表明个体间和皮肤部位间异质性(图 S4 B)。他们还发现个体特异性基因在群体内表现出聚集趋势(图 S4 C)。脂肪酸降解在 HC组中富集,甘油脂代谢在痤疮组中富集,表明个体特异性基因表现出疾病特异性功能富集(图 S4 C)。
KEGG通路分析显示,不同环境中的微生物代谢、糖脂代谢和氨基酸代谢在痤疮组中富集,而聚糖降解代谢通路在 AD 组中富集,这表明痤疮衍生菌株具有更活跃的糖脂和氨基酸相关的能量代谢通路(图2H-J)。群体感应 (QS) 相关基因在痤疮和 HC 中富集(图2 H-J),包括LuxS基因,这是一种广泛存在于细菌细胞外的 QS 信号,用于细胞间通讯。这些结果强调疾病、个体和皮肤部位参与了功能基因差异的形成,主要包括C. acnes泛基因组中不同的能量利用模式。
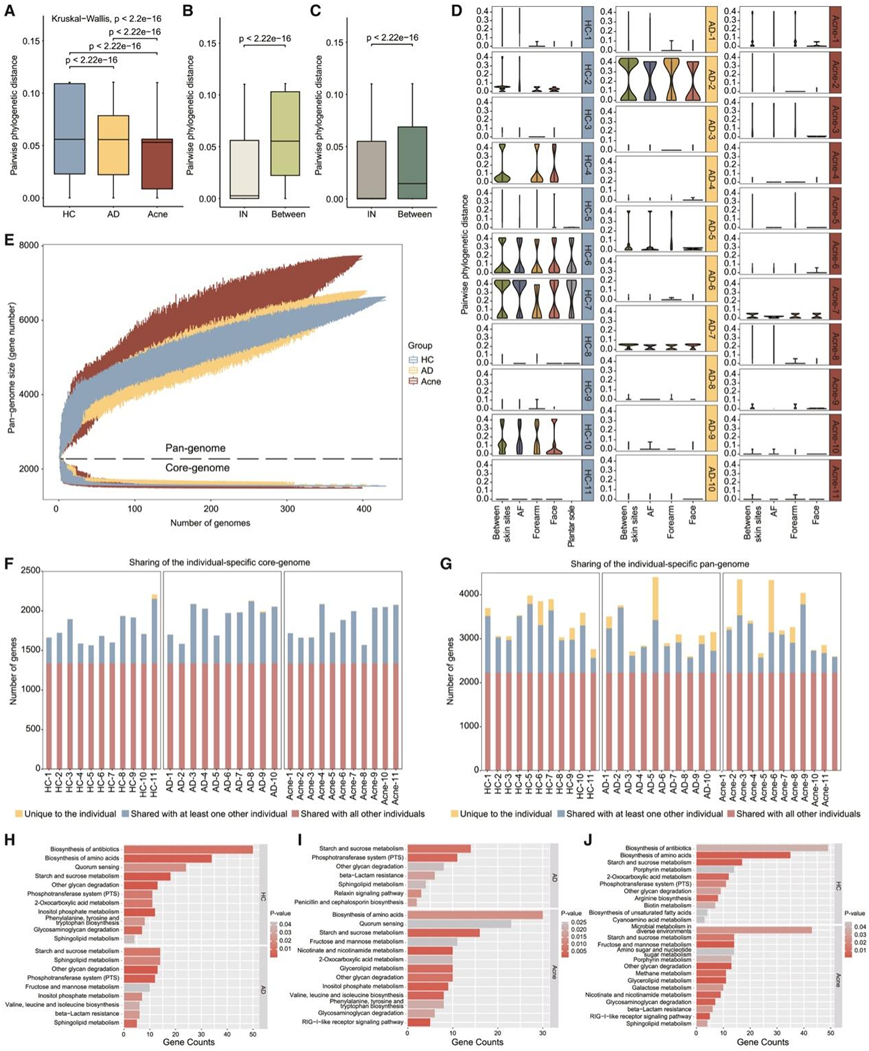
图2. C. acnes基因组表现出群体间、个体间和位点间的遗传异质性和功能基因多样性。
(A-C) 比较 HC、AD 和痤疮组、来自相同或不同个体以及来自同一个体相同或不同皮肤部位的分离株的成对系统发育距离。 (D) HC、AD 和痤疮组中同一个体相同或不同皮肤部位分离株的成对系统发育距离。(E) 所有分离株的全基因组和核心基因组的基因积累曲线与各组菌株数量的函数关系。(F-G) 单个分离株中共享与独特的个体特定核心基因和泛基因。 (H-J) KEGG 通路富集分析。
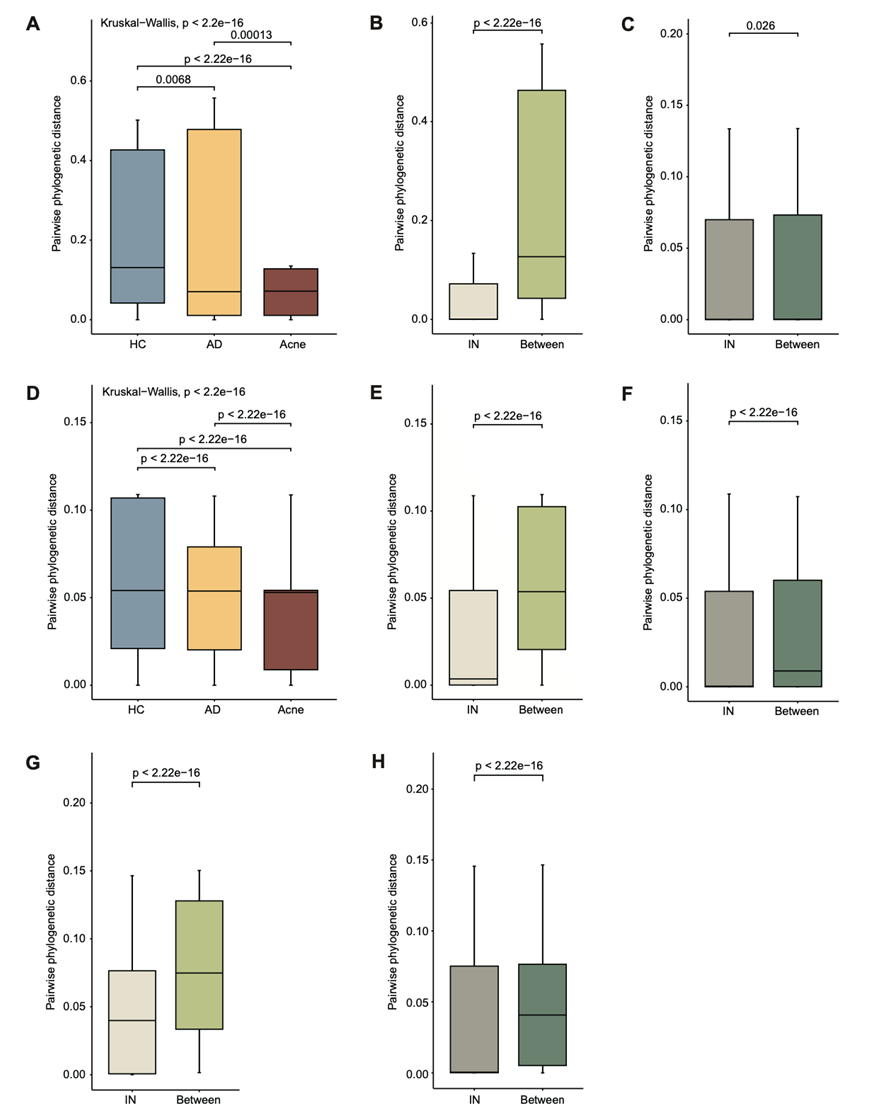
图S3. C. acnes的遗传异质性存在于独立的验证数据集、非姐妹分离株和公共数据集中。
(A-C) 分离株的配对系统发育距离比较。(D-F) 比较HC、AD和痤疮组之间,来自相同或不同个体,以及来自同一个体相同或不同皮肤部位的分离株的系统发育距离。(G-H) 来自同一或不同个体的分离株和来自同一或不同皮肤部位的分离株的配对系统发育距离比较。
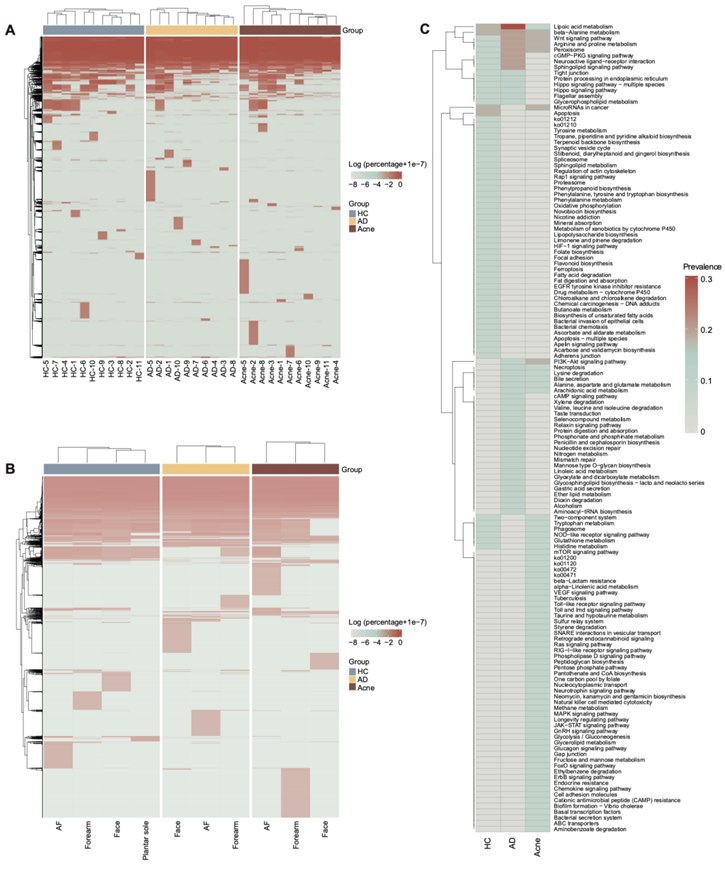
图S4. 痤疮全基因组表现出多尺度遗传异质性和个体特异性功能基因多样性。
(A-B) HC、AD和痤疮组中不同个体和不同皮肤部位的C. acnes基因流行的聚类热图。(C) 在HC、AD和痤疮组中个体特异性基因功能的分布。
03
C. acnes具有特征性的代谢功能、更少的 ARG 和 VF,以及更稳定的基因组
为了探索皮肤表面两种主要共生菌C. acnes和S. epidermidis之间的遗传差异,他们接下来通过补充已发表的 WGS 数据中的菌株来比较它们的功能基因,扩展到 1655 种C. acnes菌株和1974 种S. epidermidis菌株。他们发现不同组C. acnes具有相似的核心代谢功能,而C. acnes和S. epidermidis在多个代谢相关模块存在明显差异,包括氨基酸、碳水化合物、脂质和能量代谢(图 3 A)。C. acnes具有脯氨酸生物合成和降解相关基因,表明需要脯氨酸代谢。S. epidermidis含有参与生物膜形成的蛋氨酸生物合成相关基因,它也具有戊糖磷酸通路相关基因,这些基因可能介导毒力,同时,它具有脂肪酸生物合成、起始和延长通路的基因,而C. acnes具有β-氧化通路的基因,这表明两个物种在脂肪酸合成和利用方面存在差异。
来自健康个体的S. epidermidis分离株是抗生素耐药基因(ARG) 和 VF 的储存库,可以通过移动遗传元件 (MGE) 传递给金黄色葡萄球菌。在S. epidermidis中存在的大多数 ARG 和 VF并未在C. acnes基因组中鉴定出来(图 3B-C)。Erm (X)是C. acnes基因组中最普遍的 ARG,主要存在于 AD 组中,其介导对林可霉素和大环内酯类抗生素的交叉耐药性(图 3B),这表明 AD 衍生的菌株具有相对更高的耐药潜力。除了存在于所有C. acnes菌株中的tufA、mprA和ugd之外,sodA、sigH和narH也是C. acnes基因组中普遍存在的 VF (图 3C)。这些VF主要参与细菌的能量代谢、无氧状态的维持、生物膜的形成、和环境应激反应,维持C. acnes的基本功能。
MGE 是 ARG和 VF传播的主要驱动因素。与S. epidermidis相比,C. acnes基因组中含有的噬菌体和质粒更少(图 S5 A-B)。C. acnes具有的大多数噬菌体属于尾病毒纲,该纲广泛存在于肠道共生菌中,并且几乎在所有S. epidermidis基因组中均有检测到(图 S5 A)。与S. epidermidis相比,C. acnes基因组中预测的质粒序列具有更少的重复元件(图 S5 B)。
他们还发现生物合成基因聚类(BGC),包括RiPP 样、NRPS 和 NRPS 样基因,广泛存在于C. acnes基因组中(图 S5 C),表明其具有合成生物调节活性次生代谢产物的能力。S. epidermidis具有与葡萄球菌 A 生物合成相关的基因(图 3 A)和与 BGC 的铁载体相关的基因(图S5 C),表明其具有潜在的毒力。总的来说,这些基因差异表明C. acnes与S. epidermidis相比具有不同的代谢功能、ARG 和 VF 数量更少、基因组更稳定。
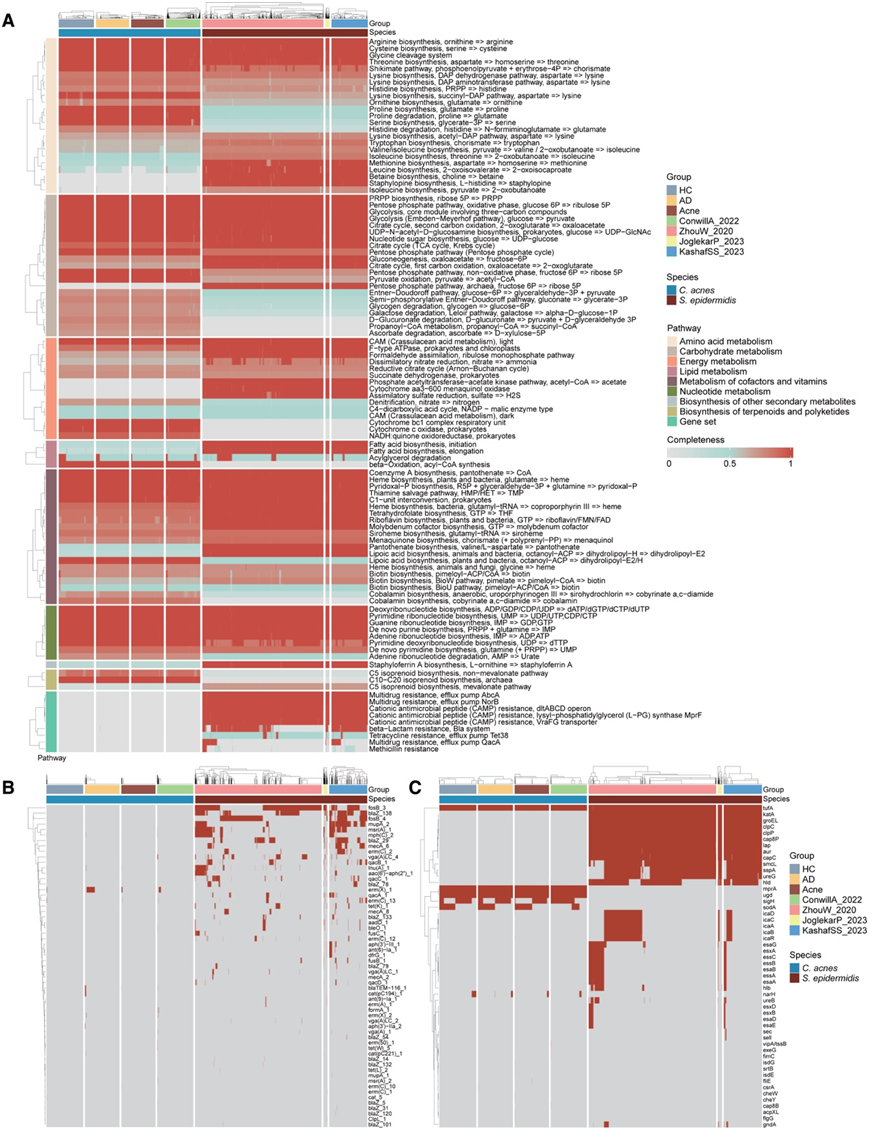
图3. 与S. epidermidis相比,C. acnes具有独特的代谢功能,较少的抗生素抗性基因和较少的毒力因子。
(A) 使用 KEGG 模块分析比较C. acnes和S. epidermidis基因组中呈现的代谢通路。(B-C) C. acnes基因组中抗生素抗性基因 (ARG)和毒力因子 (VF)的分布与S. epidermidis的分布相比。
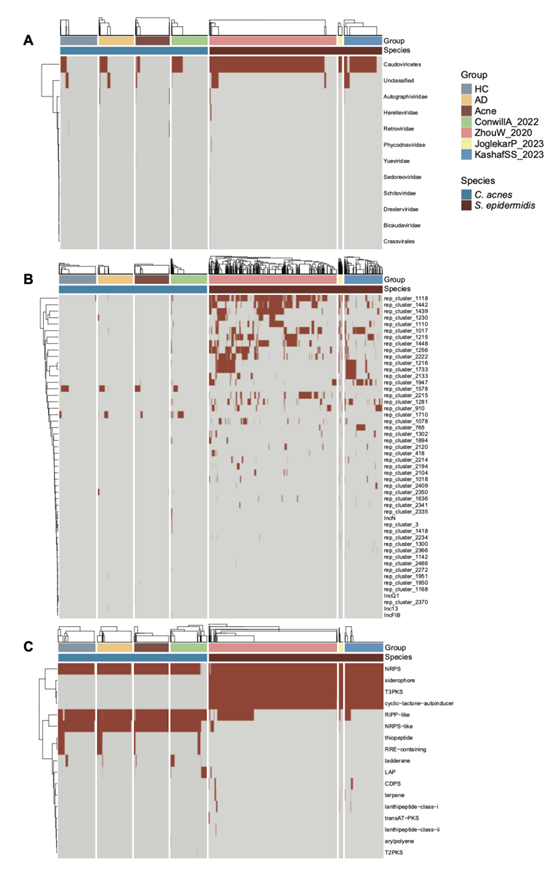
图S5. 与S. epidermidis比较,C. acnes基因组中可移动遗传元件和生物合成基因聚类的分布。
(A-B) 与S. epidermidis比较,C. acnes基因组中噬菌体和质粒的分布。 (C) C. acnes基因组中生物合成基因聚类的分布。
04
HGT 和选择压力导致疾病和皮肤位点特异性的C. acnes基因组模式
除了多个祖先菌株起源和群落波动事件外,水平基因转移(HGT)也影响个体皮肤细菌的种内多样性。因此,他们试图进一步剖析C. acnes基因组的疾病间和位点间变异。HC的前臂和AF中的水平基因数量明显低于AD和痤疮,而在面部,AD的水平基因数量明显高于HC和痤疮(图4A)。然后他们比较了个体特异性基因中水平基因的数量和功能。直系同源蛋白聚类 (COG) 类别注释分析表明,HGT事件普遍存在于个体特异性基因的多种功能中,并受疾病组的影响。例如,痤疮中与能量产生和转化、氨基酸转运和代谢、翻译、核糖体结构和生物合成以及无机离子转运和代谢有关的水平基因更多(图4B)。
基于 HGT 的遗传转化事件导致物种内亚群遗传同质化,他们假设较高的 HGT 事件可能与个体内较低的遗传多样性有关。遗传多样性低的个体(根据平均 SNP 距离)在附属基因中经历了明显更多的 HGT 事件(图 4 C)。附属基因组中更广泛的 HGT 可能有助于C. acnes适应协调特定选择压力的疾病生态位。
HGT可能有助于定植后的基因交换和多样化,而选择压力可能在定植早期阶段塑造基因组模式。核心基因组的大多数基因中存在选择事件(图S7 A),而大多数正向选择事件发生在附属基因组中(图S7 B)。三组之间受选择压力的附属基因数量没有显著差异(图S7 C)。KEGG通路富集分析表明,在痤疮组的附属基因组中,糖脂代谢和果糖和甘露糖代谢通路受到更高的正向选择压力(图4 D)。在三组共有的附属基因中,中位omega值在AD组AF(图S7D)和痤疮组面部(图S7E)中显著升高,甚至改变了omega值的范围分布(图4 E-F),显示在AD和痤疮位点具有更强的正向选择。
有趣的是,他们发现只有少数具有特定功能的基因在这些皮肤部位富集,例如AD组AF中的氨基酸代谢相关通路,和痤疮组面部中的甘油脂代谢通路(图 S7 F-G),这表明与特定代谢功能相关的基因在生态位中受到了特定的选择。这些结果证明C. acnes的附属基因组具有位点和疾病特异性的正选择压力。HC的足底(图 S7 H)、AD的面部和AF(图 S7 I)以及痤疮的面部(图 S7 J)中的附属基因表现出相对较强的正选择压力。
总的来说,C. acnes附属基因组中的 HGT 事件和正向选择受到皮肤部位和疾病的影响,这表明生态位特异性塑造了C. acnes在个体内和不同皮肤病中的基因组模式和适应性。
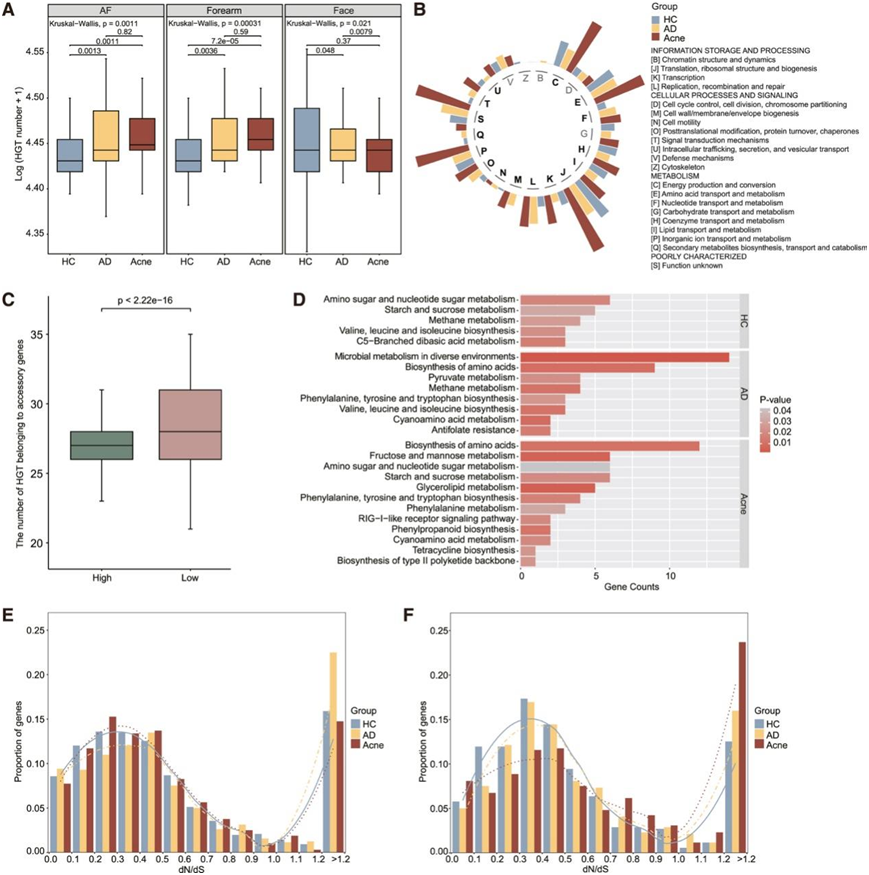
图4. HGT 和选择压力导致疾病和皮肤部位特异性的C. acnes基因组模式。
(A) 不同皮肤部位HC、AD、痤疮组的HGT基因数量比较。(B) HC、AD 和痤疮组中个体特异性基因中具有 HGT 的基因数按 COG 功能类别聚类。(C) 按照平均 SNP 距离对高、低遗传多样性组间附属基因中 HGT 基因数量进行比较。(D) HC、AD 和痤疮组中附属基因组中正向选择压力 (dN/dS > 1.2) 下基因的 KEGG 通路富集情况。(E-F) 三组共有的附属基因的分布。
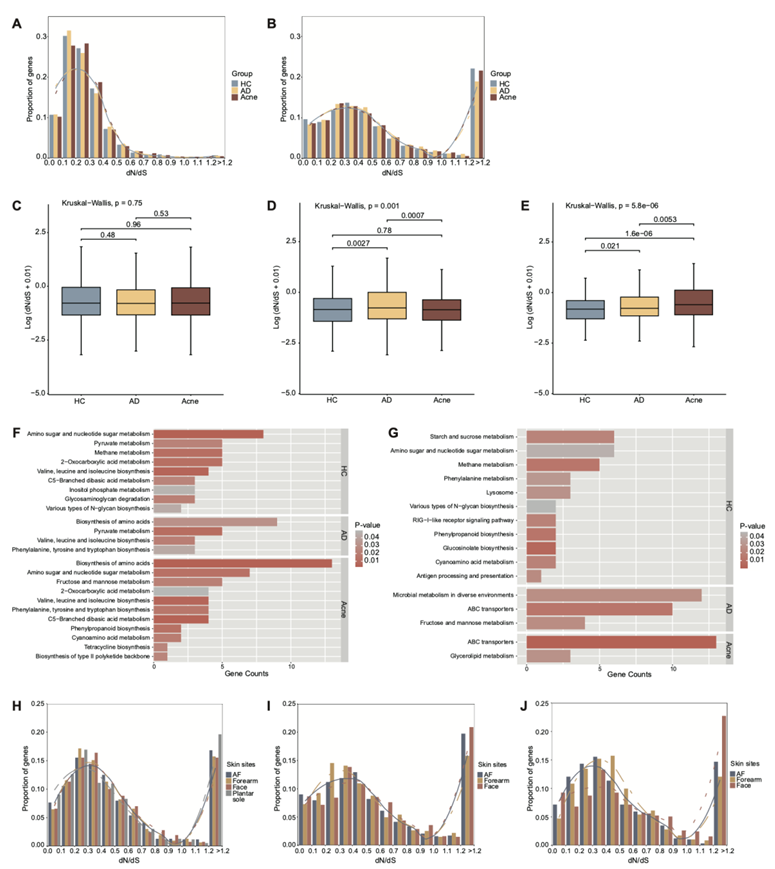
图S7. 与选择压力相关的C. acnes附属基因功能特征。
(A-B) 核心基因和辅助基因在HC组、AD组和痤疮组omega值(dN/dS)的分形范围内的分布。(C) HC、AD和痤疮组中辅助基因的omega值比较。(D-E) HC组、AD组和痤疮组共有的辅助基因omega值比较。(F-G) 附属基因组中正选择压力下基因KEGG通路富集(dN/dS > 1.2)。(H) 四个皮肤位点共有的附属基因在HC的omega值(dN/dS)的分形范围内的分布。 (I-J) 三个皮肤部位共有附属基因在omega值(dN/dS)分组范围内的分布。
05
单菌株转录组揭示C. acnes在不同疾病中的功能特征
然后,他们分析了单菌株水平的C. acnes的转录组特征。基于转录组丰度的主坐标分析 (PCoA) 图显示三组中转录组分布明显不同(图 S10 A)。能量产生和转化、碳水化合物运输和代谢以及氨基酸运输和代谢 COG 类别中的转录本在三组中表现出相对较高的表达丰度,表明能量代谢是共同表达的基因功能模块(图 5 A)。无机离子运输和代谢转录本聚集显示 AD 中的表达丰度明显较高(图 5 A)。他们共获得了 AD 和 HC 组之间的 72 个差异表达基因,包括 14 个上调基因和 58 个下调基因(图 S10 B)。脂质转运和代谢、无机离子转运和代谢、能量产生和转化以及碳水化合物转运和代谢是主要不同的 COG 功能类别(图 S10 C)。油酸水合酶、三酰甘油脂肪酶、酰基载体蛋白和磷酸转移酶系统 (PTS) 糖转运蛋白亚基 IIB 在 AD 组中下调(图 S10 B)。据报道,这些基因在脂肪酸合成、甘油三酯水解和脂肪酸 β-氧化中发挥作用,这表明 AD 组衍生菌株利用脂质进行能量代谢和脂肪酸合成的能力较低。与痤疮组相比,在 AD 组中共鉴定出 84 个差异表达基因,包括 13 个上调基因和 71 个下调基因(图 S10 D)。脂质运输和代谢、无机离子运输和代谢、能量产生和转化、碳水化合物运输和代谢是主要的不同 COG 功能类别(图 S10 E)。酰基载体蛋白、酰基辅酶 A (CoA) 脱水酶活化酶相关蛋白、甲基丙二酰辅酶 A 变位酶、丙酮酸:铁氧还蛋白氧化还原酶和电子转移黄素蛋白亚基 β/FixA 家族蛋白在痤疮组中上调,而抗氧化应激相关基因如黄素腺嘌呤二核苷酸 (FAD) 依赖性氧化还原酶、短链脱氢酶/还原酶 (SDR) 家族氧化还原酶和烷基氢过氧化物还原酶在痤疮组中下调(图 S10 D)。这些数据表明痤疮衍生的菌株具有与脂肪酸氧化相关的活跃能量代谢通路,并且缺乏对宿主皮肤氧化应激环境的抵抗力。
接下来,他们比较了不同皮肤部位的基因表达水平。与前臂相比,面部和 AF 在 AD vs. HC 和 AD vs. 痤疮组的比较中具有相对一致的基因表达变化(图 5B,图S10F)。与 HC 相比,能量代谢和碳固定的通路在 AD 中的面部和 AF 中持续下调(图 5B)。总的来说,C. acnes在正常和患病皮肤中表达的常见基因主要参与维持基本代谢活动,患病皮肤来源的转录组以适应特定的生态位为特征。
基于转录组数据与AD /痤疮皮肤皮脂缺乏/丰富环境临床特征的一致性,他们假设皮脂含量是影响C. acnes基因表达和生物学功能差异的重要因素,于是,他们用人工皮脂在浓度梯度中培养五种C. acnes菌株,然后分析转录组特征。C. acnes转录组的样本间距离显示出在低(0.01%)和中/高(0.05%/0.25%)皮脂浓度下培养的样品的明显聚类(图5C)。PCoA图显示不同皮脂浓度的聚类没有显著差异,而在成对检验中,0.01%和0.25%皮脂浓度组之间存在显著差异(图S10G)。原核生物的ABC转运体、氮代谢、碳固定通路等是高皮脂组的KEGG通路富集点(图5D),而低皮脂组甘油脂代谢富集点(图5D),说明低皮脂浓度下甘油脂代谢存在补偿性变化,提示皮脂浓度对C. acnes能量代谢模式具有重要的调控作用。
他们检测了不同皮脂浓度下的C. acnes培养上清对角质形成细胞的毒性和炎症因子表达的影响。将C. acnes培养上清加入角质形成细胞培养4小时后,中、高皮脂浓度组细胞活力显著降低(图5E),用高皮脂浓度痤疮组的C. acnes培养上清培养后,角质形成细胞产生IL-1β、IL-6、IL-8和肿瘤坏死因子-α增加(图5F)。因此,皮脂含量是影响C. acnes基因表达模式和生物学功能的关键因素,高皮脂环境中的C. acnes具有独特的基因表达谱和对宿主角质形成细胞的更高毒性。
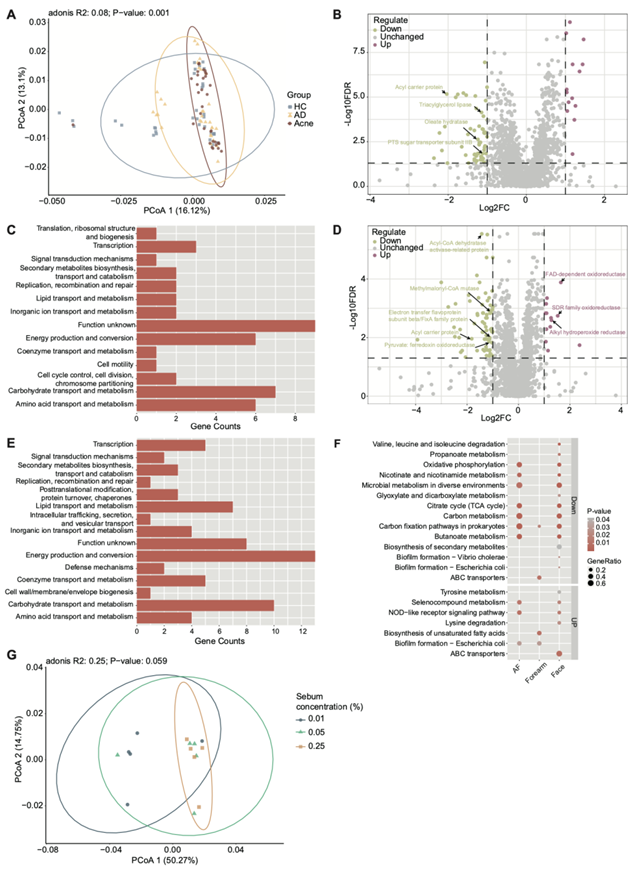
图S10. C. acnes单株转录组在疾病组、皮肤部位和皮脂浓度之间的比较。
(A) HC、AD和痤疮组痤疮C. acnes分离株的PCoA图。(B) AD组与HC组基因差异表达的火山图。 (C) AD组与HC组差异表达基因的COG功能分类。(D) AD组与痤疮组基因差异表达的火山图。 (E) AD与痤疮组之间COG功能差异表达基因的分类。(F) KEGG通路分析。(G) 根据皮脂浓度绘制C. acnes转录组的PCoA图。
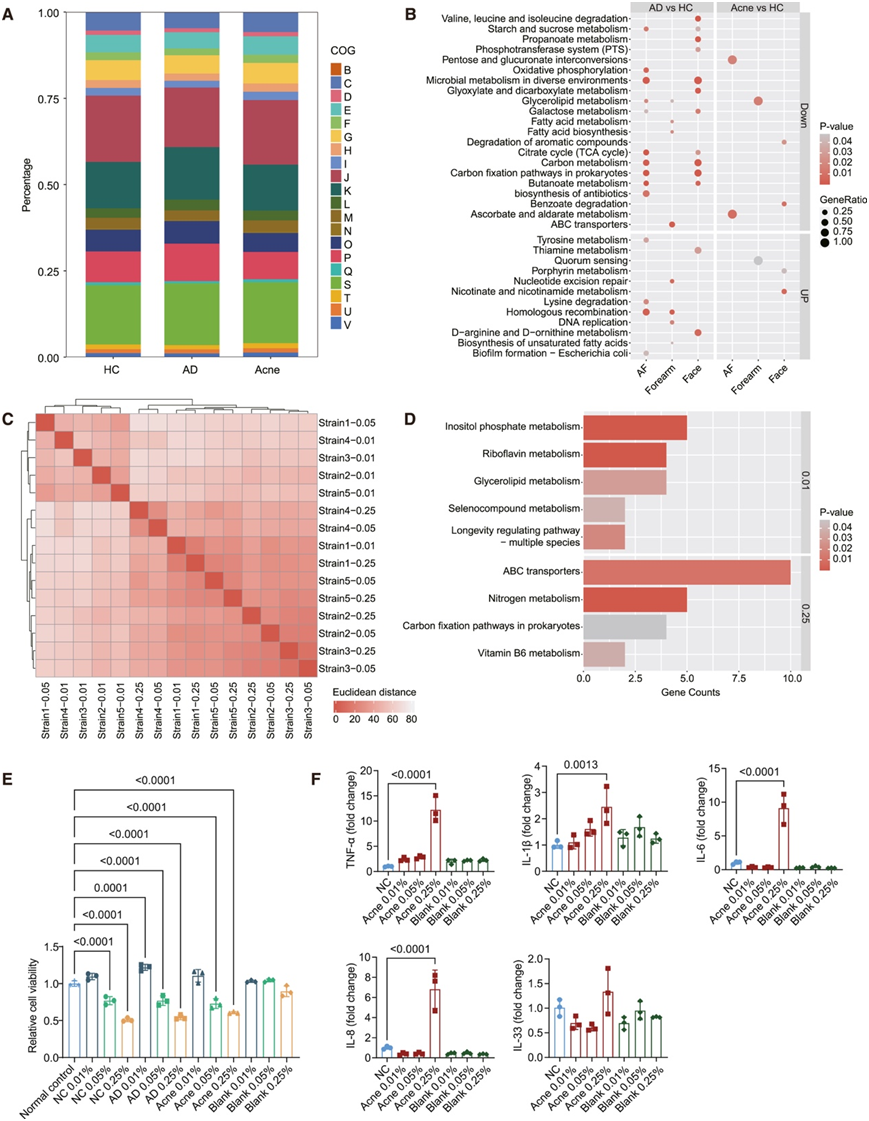
图5. 单菌株转录组揭示不同疾病组和不同皮脂浓度的C. acnes的功能特征。
(A) HC、AD 和痤疮组中 COG 功能类别的相对表达丰度。(B) 各皮肤部位 AD 与 HC 或痤疮与 HC 之间差异表达基因的富集 KEGG 通路。(C) 在不同皮脂浓度下培养的C. acnes转录组的样本间距离。(D) 0.01% 和 0.25% 皮脂浓度之间差异表达基因的富集 KEGG 通路。(E) 角质形成细胞与C. acnes培养上清液和不同皮脂浓度孵育 4 小时后的细胞相对活力。(F) 定量实时 PCR (RT-qPCR) 显示角质形成细胞中炎症细胞因子的 mRNA 表达水平。
06
AD和痤疮组衍生菌株表现出不同的代谢组学景观
为了详细研究C. acnes的代谢组,他们对处于对数生长期的C. acnes菌株的培养上清液进行了非靶向代谢组和靶向短链脂肪酸 (SCFA) 代谢组研究。与 HC 和 AD 组相比,痤疮组的聚类趋势明显不同(图 S12 A)。HC 组的 SCFA 含量最高,而痤疮组的 SCFA 含量最低(图 S12 B)。三组之间丙酸组含量没有显著差异(图 S12 C),而痤疮组中丁酸的含量明显低于 HC(图 S12 D)。
潜在结构判别分析的投影表明,非靶向代谢物模式在不同疾病组之间存在差异(图 S12 E)。与痤疮组相比,AD 组衍生的C. acnes菌株的特点是甘油三酯代谢物、棕榈酸、油酸、硬脂酸和棕榈油酸显著增加(图 6 A)。与痤疮组相比,AD 组中的多种氨基酸代谢相关通路,包括 β-丙氨酸代谢、精氨酸和脯氨酸代谢以及精氨酸生物合成有显著不同(图 S12 F)。与 HC组相比,AD 组中的油酸含量显著增加,痤疮组中的硬脂酸含量显著降低,而棕榈酰-l-肉碱含量显著增加(图 S12 G-H),表明痤疮组衍生的菌株具有很高的利用饱和脂肪酸的能力。长链脂肪酸 (LCFA) 可以直接进行脂肪酸 β-氧化来提供能量,这表明与痤疮组相比,AD组衍生菌株利用 LCFA 的能力下降。这些结果表明,与不同皮肤状况相关的 AD 和痤疮组衍生菌株的脂质利用模式不同。
L-肌肽(β-丙氨酸- l -组氨酸)是一种在原核生物和真核生物中普遍存在的二肽,具有多种有益的生理作用,包括 pH 缓冲、金属离子螯合和抗氧化能力。非靶向代谢组数据显示,L-肌肽在 AD 中显著富集,在痤疮组中减少(图 6B),这表明源自C. acnes的L-肌肽可能具有抗氧化应激和抗炎作用。
与对照组相比,在模型诱导 30 分钟后用 L-肌肽 (10 mmol/L) 对 MC903 诱发的 AD 样小鼠模型进行局部治疗可显著减轻皮肤炎症症状,表现为可见鳞片减少、发红减少和耳朵厚度减少(图 6C-D)。第 9 天对耳切片进行苏木精和伊红 (H&E) 染色显示,L-肌肽治疗组耳朵的表皮厚度减少,炎症细胞浸润减少(图 6C-E)。用 L-肌肽治疗的小鼠的总血清免疫球蛋白 E (IgE) 水平显著低于 AD 模型对照组(图 6F)。与对照组相比,L-肌肽治疗组总血清中炎症细胞因子的浓度显著降低,包括IL-4、IL-6、IL-13和IL-33(图6G)。与对照组相比,L-肌肽治疗组的IL-4的mRNA表达水平显著降低,而L-肌肽治疗组的IL-6、IL-13和IL-33的表达水平降低(图6H)。L-肌肽治疗组的血红素加氧酶1(HO-1)的表达显著上调(图6H)。因此,L-肌肽可能通过上调HO-1的表达和减少皮肤中炎症细胞的浸润来减轻AD炎症。
此外,他们观察到局部使用 L-肌肽 (10 mmol/L) 治疗 5 天可减轻小鼠因同时使用合成皮脂和皮内注射活C. acnes菌株引起的痤疮样皮炎,注射部位周围发红和耳朵厚度减少即为明证(图 S12 I)。第 5 天对耳部切片进行 H&E 染色显示,L-肌肽治疗小鼠注射部位周围炎症细胞浸润减少(图 S12 I)。与对照组相比,L-肌肽治疗组 IL-6 mRNA 表达水平显著降低,IL-1β、CXC 基序趋化因子配体 1 (CXCL1) 和 CXCL2 的表达水平也降低(图 S12 J)。因此,L-肌肽可能具有广泛的抗皮肤炎症作用。
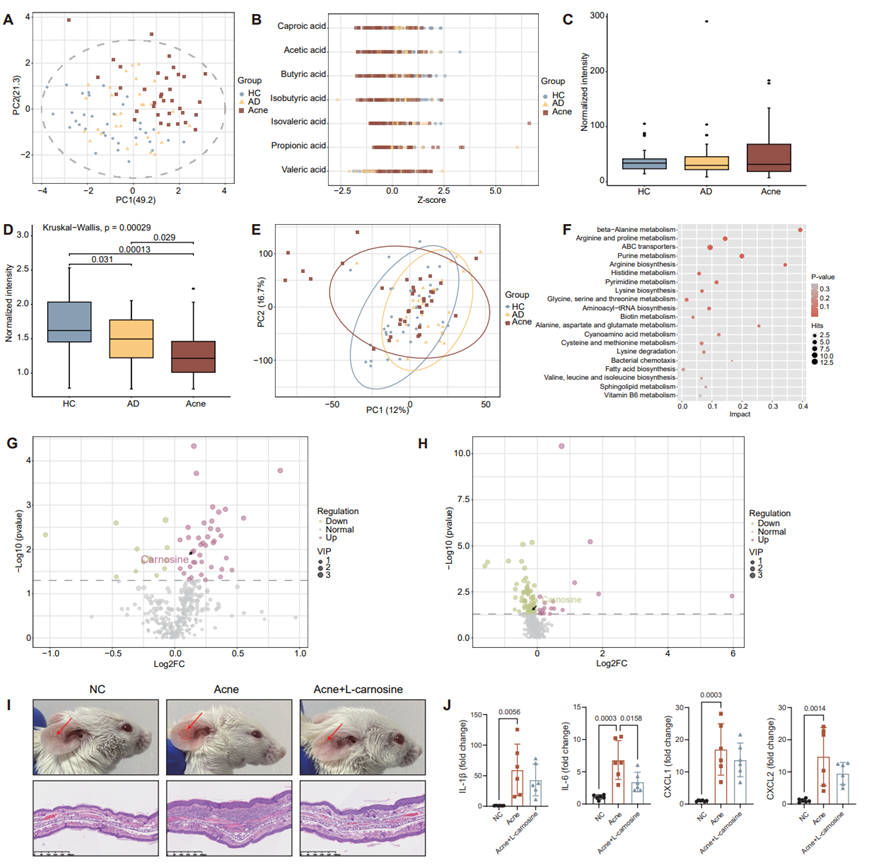
图S12. C. acnes非靶向和scfa靶向代谢组模式和功能分析。
(A) HC组、AD组和痤疮组中C. acnes靶向SCFA代谢组的PLS-DA。(B) HC、AD和痤疮组中C. acnes靶向SCFA代谢组的Z-score。(C-D) scfa靶向代谢组HC组、AD组和痤疮组丙酸和丁酸的平均含量。(E) HC、AD和痤疮组中C. acnes非靶向代谢组的PLS-DA。 (F) AD和痤疮组之间非靶向代谢组差异代谢物的富集KEGG通路。(G) AD和HC之间非靶向代谢组差异代谢物火山图。(H) 痤疮组和HC组之间非靶向代谢组差异代谢物的火山图。(I) 耳部切片具有代表性的大体外观和H&E染色。(J) 实时荧光定量PCR (RT-qPCR)显示各组耳细胞因子mRNA表达情况。
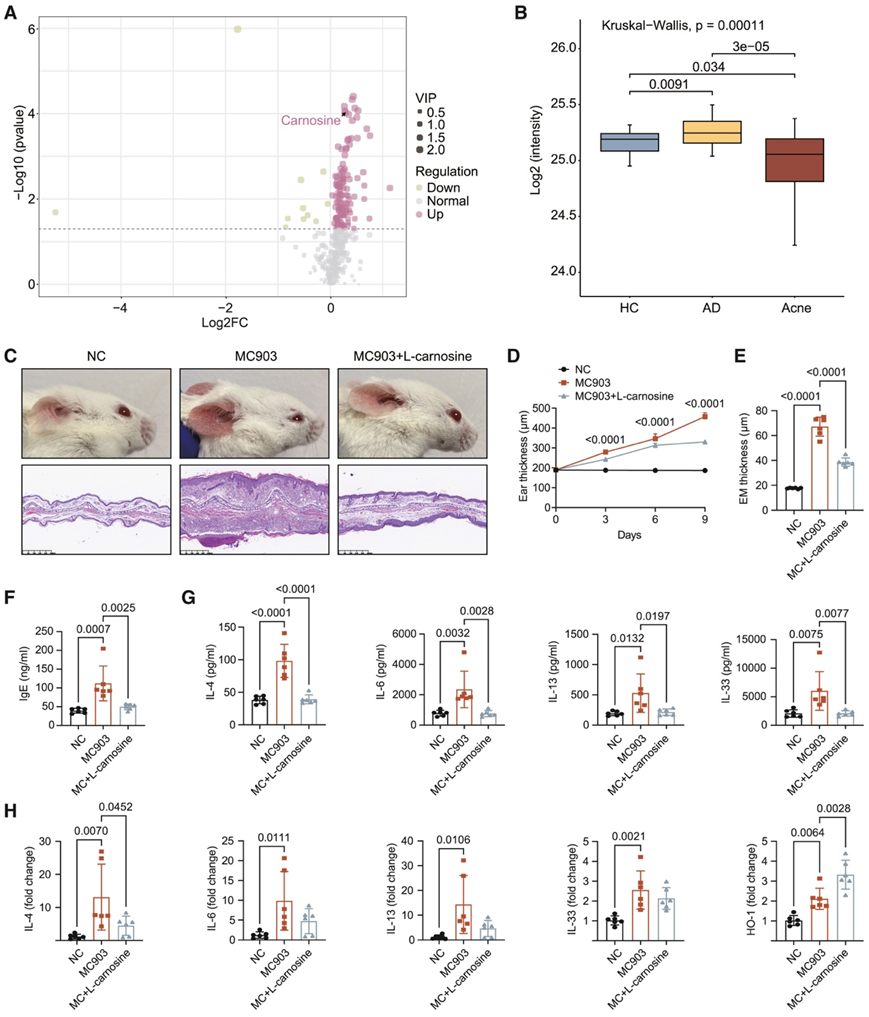
图6. 抗氧化应激代谢物 L-肌肽在AD 的C. acnes代谢组中富集,并减轻皮肤炎症。
(A) AD 和痤疮组之间差异代谢物的火山图。(B) 三组间 L-肌肽的平均含量。(C) 耳切片的代表性大体外观和 H&E 染色。(D) 第 0、3、6 和 9 天耳朵厚度的变化。(E) 高倍放大下耳切片的表皮(EM)厚度。(F) 血清总 IgE 浓度。(G) 血清总炎症细胞因子浓度。(H) RT-qPCR 显示各组耳朵中炎症细胞因子和 HO-1 的 mRNA 表达。
+ + + + + + + + + + +
结 论
本项研究展示了来自 1234 个分离基因组的C. acnes的个体和生态位异质性。C. acnes引发的皮肤病(特应性皮炎和痤疮)和身体部位形状基因组存在差异,源于水平基因转移和选择压力。与S. aureus相比,C. acnes具有特征性的代谢功能、更少的抗生素耐药基因和毒力因子以及更稳定的基因组。菌株水平的整合基因组、转录组和代谢组分析揭示了C. acnes的功能特征。与转录组特征一致,富含皮脂的环境中C. acnes会对角质形成细胞产生毒性和促炎作用。 L-肌肽是一种抗氧化应激代谢物,在特应性皮炎的C. acnes代谢组中上调,并减轻皮肤炎症。总之,这项研究揭示了基因和微环境对C. acnes功能的共同影响。
+ + + + +



 English
English


