文献解读|Protein Cell(21.1):通过单细胞核转录组分析鉴定 FOXO1 作为人类滑膜中的抗衰老保护因子
✦ +
+
论文ID
原名:Identification of FOXO1 as a geroprotector in human synovium through single-nucleus transcriptomic profiling
译名:通过单细胞核转录组分析鉴定 FOXO1 作为人类滑膜中的抗衰老保护因子
期刊:Protein & Cell
影响因子:21.1
发表时间:2023.12.13
DOI号:10.1093/procel/pwad060
背 景
滑膜是一层薄薄的组织,紧邻关节并分泌滑液,随着年龄增长,滑膜会发生变化,导致剧烈的肩痛和其他关节疾病。然而,人类滑膜老化的机制仍未得到充分了解。
实验设计
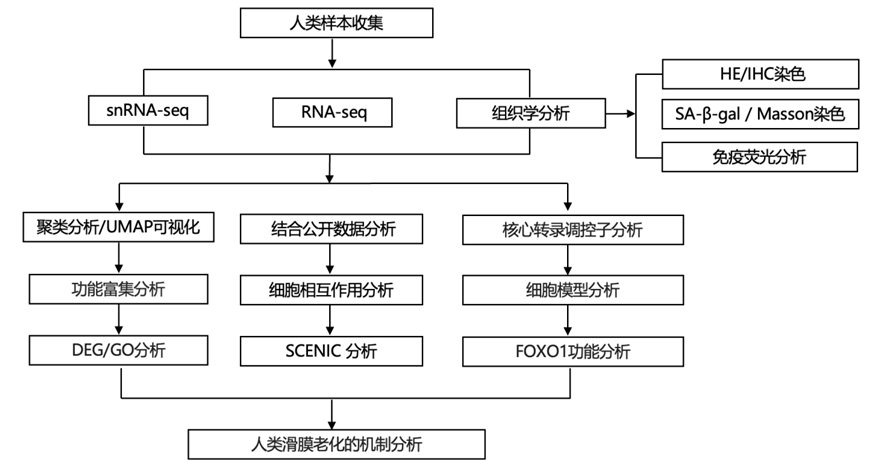
结 果
01
人类肩峰下滑膜的年龄相关表现
为了通过组织学分析研究肩峰下滑膜与年龄相关的生理变化,研究者团队从靠近冈上肌腱的肩峰下滑囊“底部”收集了年轻和老年人的滑膜组织(图 1A)。当对肩峰下滑膜的不同解剖区域(包括内层和下层)进行比较时,发现老化滑膜存在明显的改变。在结构层面,滑膜下层血管形成随年龄增长而增多,而内膜增生则特别在内层增多(图 1B-C)。当检测年轻和老年滑膜中细胞衰老的指标时,发现老化滑膜的内层和内层都有较高百分比的衰老相关 β 半乳糖苷酶 (SA-β-gal) 阳性区域(图 1D)。同样,细胞衰老标志物 p21 Cip1和人类内源性逆转录病毒-K (HERV-K) 阳性细胞在老化滑膜中增加(图 1E-F),表明衰老细胞在老化过程中在肩峰下滑膜中积聚。异染色质的丢失和异染色质相关蛋白 HP1γ 的减少与细胞衰老和与年龄相关的疾病的发生有关。根据这些观察结果,发现异染色质标志物 H3K9me3 和异染色质相关蛋白 HP1γ 在老化滑膜细胞中下调(图 1G)。已知衰老细胞的积累与各种器官中的促炎过程有关。他们进一步研究了老年滑膜中的炎症,观察到老年滑膜组织中浸润的免疫细胞数量增加,这表现为 CD45 阳性免疫细胞比例增加。S100A8 和 S100A9 的表达在老化的滑膜中持续增加(图 1H- I),而这两种蛋白通常在激活的中性粒细胞或巨噬细胞中表达,以响应炎症刺激。总之,组织学分析揭示了老年人肩峰下滑膜中多方面的与衰老相关的变化。
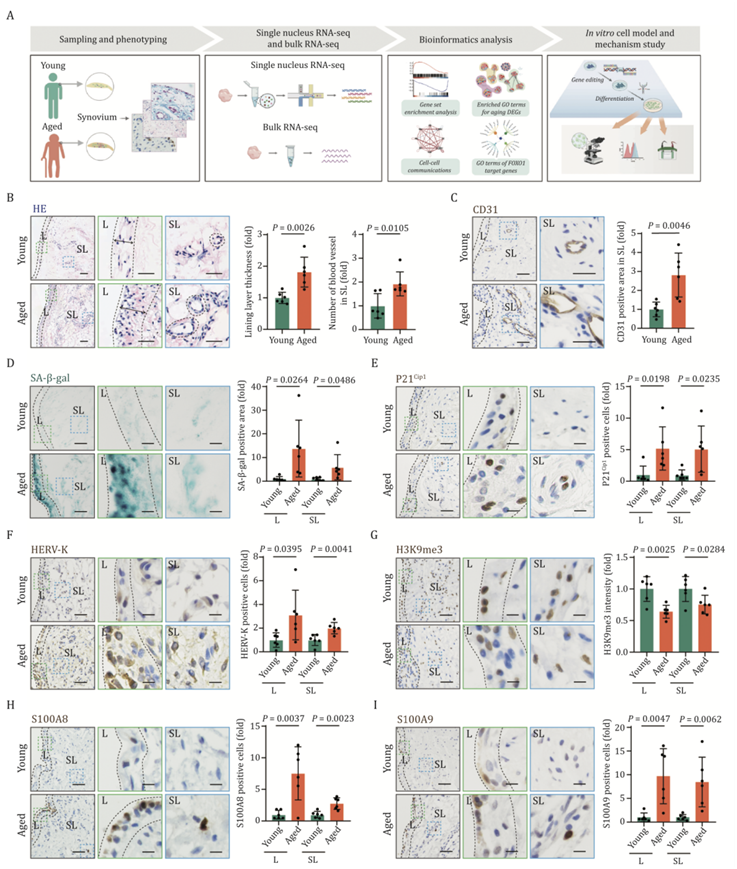
图1. 表征人类肩峰下滑膜的衰老相关变化。
(A)与人类滑膜衰老有关的细胞和分子调控网络的实验设计示意图。(B)年轻和老年人类滑膜组织的 HE 染色。(C) 年轻和老年人类滑膜组织中 CD31 的免疫组织化学 (IHC) 染色。 (D) 年轻和老年人类滑膜组织的 SA-β-gal 染色。(E) 年轻和老年人类滑膜组织中细胞衰老相关标志物 P21 Cip1的 IHC 染色。 (F) 年轻和老年人类滑膜组织中 HERV-K 的 IHC 染色。(G) 年轻和老年人滑膜组织中 H3K9me3 的 IHC 染色。(H) 年轻和老年人滑膜组织中 S100A8 的 IHC 染色。(I) 年轻和年老人类滑膜组织中 S100A9 的 IHC 染色。
02
人类肩峰下滑膜的转录组分析
许多研究报告称滑膜中存在不同的细胞群,包括滑膜细胞、血管细胞和免疫细胞。他们对来自年轻人和老年人的人类肩峰下滑膜样本进行了单细胞核转录组分析 (snRNA-seq)和转录组(bulk RNA-seq)分析(图 2A,图S2A-B)。使用无监督聚类和均匀流形近似和投影 (UMAP) 分析,根据经典细胞类型特异性标记基因的表达注释和表征了八种细胞类型(图 2A-B)。在每个年龄组中都鉴定了所有主要的滑膜细胞类型,包括内层间充质基质细胞(L-MSC)(PRG4 +、 CRTAC1 +和FN1 +)、下层间充质基质细胞(SL-MSC)(GSN +、VCAN + 和FBLN1 +)、周细胞(Per)(RGS5 +和TRPC6 +)、平滑肌细胞(SMC)(MYH11 +和ACTA2 +)、内皮细胞(EC)(FLT1 +和VWF +)、脂肪细胞(Adi)(ADIPOQ +和KLB +)、巨噬细胞(Mac)(MSR1 +、 CD163 +和CD86 +)和 T 细胞(TC)(PTPRC +、 CD69 +和 CD247 +)(图2B,图S2C)。对每个聚类的前50个细胞类型特异性标记基因进行功能富集分析,可以深入了解它们独特的生理功能(图2C)。具体而言,L-MSC 和 SL-MSC 代表功能不同的间充质基质细胞类型。L-MSC 表达与 NABA 核心基质体和 O-连接糖基化相关的基因,包括 PRG4 的特异性表达,PRG4 是一种高度糖基化的蛋白质,可作为滑液中的润滑剂。相反,SL-MSC 表达的基因与粘着斑和细胞外基质组织有关,例如 VCAN,它是细胞外基质的关键成分,参与细胞附着、生长和迁移。总体而言,上述对年轻和老年滑膜细胞的分析提供了详细的细胞景观,强调了滑膜稳态下不同间充质基质细胞的异质性和功能多样性。
接下来,他们分析了人类肩峰下滑膜不同细胞类型中与衰老相关的差异表达基因(DEG)。在这些细胞类型中,SL-MSC 和 Mac 具有最多的衰老反应性 DEG(上调的 DEG 数量分别为 293、278,下调的 DEG 数量分别为 204、167)(图 2D)。这些老化 DEG 的基因本体论 (GO) 和功能富集分析表明,与年轻细胞相比,在老化滑膜中大多数已鉴定细胞类型中,与血管生成、对 TGF-β 的反应、淋巴细胞活化和胶原纤维组织相关的基因普遍上调(图 2E)。为了进一步评估老化滑膜中的纤维化状态,他们对纤维化相关基因进行了基因集评分分析,并观察到大多数已鉴定细胞类型中基因表达水平升高,尤其是在 SL-MSC 中(图 2F,图S2D)。此外,在八种已鉴定的细胞类型中,有六种细胞的纤维化标志物(例如COL1A2)的表达增强(图 2G)。COL1A2 的免疫组织化学染色和 Masson 三色染色进一步证实了老化滑膜内层和内层下层的纤维化增强,纤维化变化在内层下层尤为明显(图 2H-I)。具体而言,在 Mac 中,富集 FCERI 信号、TNF-α 信号和脂质储存调节的基因上调(图 2E)。与基因表达变化一致,观察到脂肪浸润是与滑膜老化相关的组织学变化(图 2J)。此外,与 Wnt 信号通路相关的基因表达在老化 EC 中特别上调,这与在老化滑膜中观察到的血管形成一致(图 2E)。此外,与老化滑膜中积累的衰老细胞的组织学发现一致(图 1D-E),基因集评分分析表明,衰老相关分泌表型相关基因的表达在各种细胞类型中普遍增加,尤其是在 L-MSC 和 Mac 中(图S2E-F)。滑膜样本的bulk RNA-seq 数据进一步证实了 FCERI 介导的 NF-κB 激活和免疫反应的激活(图S2G)。
相反,不同滑膜细胞类型之间共有的下调基因主要参与细胞连接组织、细胞化学稳态和软骨发育(图 2E)。值得注意的是,RPL31是一种编码核糖体蛋白的基因,在八种已鉴定的细胞类型中的六种中鉴定为高频下调的 DEG(图 2G)。

图2. 年轻和老年人类滑膜的单细胞核转录组分析。
(A) 均匀流形近似和投影 (UMAP) 图显示年轻和老年人类滑膜组织中不同细胞类型的分布。(B) 点图显示滑膜中每种细胞类型的代表性标记基因的表达。(C) 热图显示年轻和老年人类滑膜组织中不同细胞类型的前 50 种标记基因的表达谱,右侧为其富集的功能注释。(D) 热图和条形图显示衰老相关 DEG。(E)GO分析。(F) 小提琴图显示年轻和老年人类滑膜组织不同细胞类型中纤维化相关基因的基因集得分。(G) 圆形图显示至少四种或三种细胞类型共有的上调(左)和下调(右)的 DEG。(H) 年轻和老年人类滑膜组织中 COL1A2 的 IHC 染色。(I)年轻和老年人类滑膜组织的 Masson 染色。(J) 年轻和老年人类滑膜组织的油红 O 染色。
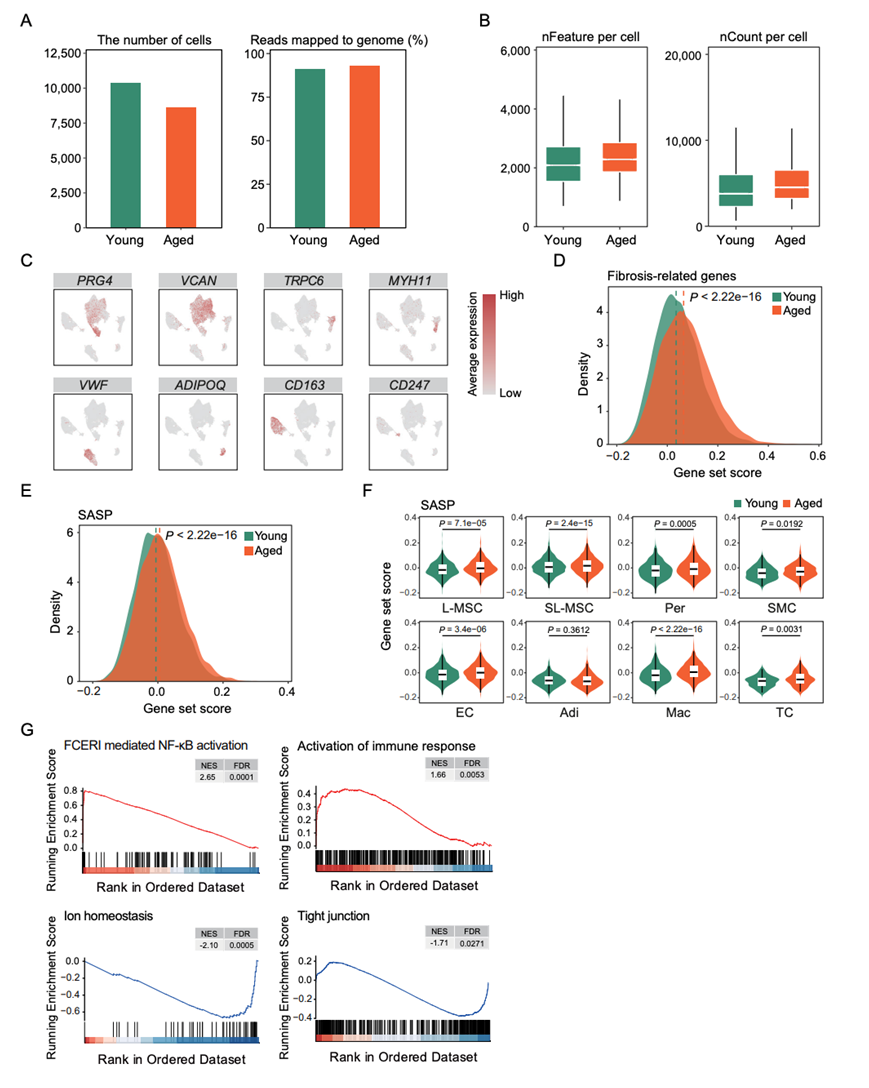
图S2. 人类滑膜衰老相关的转录变化。
(A) 条形图显示每组的细胞数量和映射到基因组的读数百分比。(B) 箱线图显示了不同组中每个细胞中检测到的基因数量和唯一分子标识符的数量。(C)UMAP可视化。(D) 显示年轻和老年人类滑膜组织纤维化相关基因集评分的全球分布密度的Ridge图。(E) 显示年轻人和老年人滑膜组织SASP基因集评分的全局分布密度的脊图。(F) 小提琴图显示SASP在不同细胞类型的年轻和老年人类滑膜组织中的基因集评分。(G) GSEA富集曲线显示了bulk RNA-seq检测的衰老相关通路的变化。
03
滑膜老化过程中细胞类型特异性转录变化
据报道,RPL31 在调节成骨分化方面很重要,并且是鉴定为类风湿关节炎 (RA) 患者滑膜中最主要的失调基因之一。通过对滑膜老化 DEG 和 Aging Atlas 数据库中的基因进行联合分析,发现老化滑膜的基因表达特征与炎症和骨关节炎 (OA) 发病机制有关(图 3A)。例如,OA 风险因子EGR1在大多数老年样本的滑膜细胞中高表达,而昼夜节律主基因ARNTL在两种 MSC 细胞类型中均下调。此外,VEGFC是 OA 中发炎滑膜的潜在药物靶点,在 L-MSC 中特别下调(图 3A)。通过进一步评估与 OA 遗传性相关的遗传风险变异,注意到NAMPT在衰老过程中在滑膜细胞中上调。类似地,FN1编码一种存在于细胞表面或与滑膜骨软骨瘤病和滑膜炎相关的细胞外基质中的糖蛋白,在衰老过程中,不同类型的滑膜细胞中也上调(图 3B)。总之,这些数据揭示了衰老与关节疾病之间潜在的分子关联。
为了阐明指导滑膜老化的细胞间程序,通过 CellPhoneDB 进行了细胞间通讯分析。通过该分析,能够根据成对的配体-受体基因表达检测不同细胞类型之间的相互作用(图 3C)。总体而言,发现滑膜组织内不同细胞类型之间的细胞间相互作用在衰老过程中得到增强,其中 SL-MSC 表现出最显著的变化(图 3D)。当使用 GO 富集分析来关注随年龄增长而增加的细胞间相互作用时,发现这些相互作用主要富集在与趋化性、胶原形成和血管生成相关的通路中,而随年龄增长而减少的相互作用主要富集在与软骨发育和成骨细胞分化相关的途径中(图 3E)。值得注意的是,VCAM1 与整合素(由ITGA4和ITGA9编码)之间的相互作用在老化滑膜中的免疫细胞(如巨噬细胞)中明显增强(图 3F)。同时,VCAM1 在白细胞趋化和粘附中起重要作用。在 L-MSC 中以压倒性的优势表达,并且在衰老过程中在 L-MSC 中显著上调(图 3G)。据报道,单核细胞向滑膜的迁移是滑膜炎的初始步骤,主要由整合素激活和趋化性触发。因此,VCAM1 与整合素之间这种增强的相互作用可能有助于单核细胞粘附和迁移到滑膜内层,从而引发炎症反应。与年轻滑膜相比,老化滑膜内层中 VCAM1 阳性细胞的数量持续增加约 10 倍(图 3H)。此外,巨噬细胞的数量也随着年龄的增长而增加,并在老化滑膜内层中聚集在 L-MSC 附近(图 3I)。

图3. 人类滑膜老化过程中细胞类型特异性转录变化。
(A) 热图显示老化图谱数据库中注释的不同细胞类型的老化 DEG。(B) 网络图显示老化相关 DEG 与滑膜疾病基因集的相关性。(C) 热图显示年轻组和老年组中人类滑膜中所示细胞类型之间的相互作用对数量。(D) 网络图显示滑膜老化过程中不同细胞类型之间细胞-细胞相互作用对的变化。(E) 点图显示滑膜老化过程中增加的细胞-细胞相互作用对的代表性富集功能注释。(F) 点图显示年轻组和老年组中所示细胞类型中 VCAM1 相关细胞间相互作用对。(G) 点图显示滑膜老化过程中不同细胞类型中 VCAM1 的表达水平。(H) 年轻和老年人类滑膜组织中 VCAM1 的 IHC 染色。(I) 年轻和老年人类滑膜组织中 CD163 的免疫荧光染色。
04
人类老年滑膜转录变化的核心调控子
接下来,他们应用单细胞调控网络推断和聚类(SCENIC)分析来识别可能导致老年肩峰下滑膜中不同细胞类型转录变化的转录因子(图4A-B)。上调的衰老 DEG 的核心调控子包括NFATC1(在 SL-MSC 和 EC 中),已知该基因可促进破骨细胞分化,以及SOX5(在 EC 中),它在滑膜中免疫反应相关基因的转录中起着核心作用(图 4A)。值得注意的是,据报道 NFATC1 和 SOX5 均在 OA 或 RA 患者的关节中上调。对于下调的衰老 DEG,发现核心调控子是 FOXO1,其表达在大多数滑膜细胞中降低,包括 L-MSC 和 SL-MSC(图 4C)。通过免疫染色验证了老化滑膜中 FOXO1 的下调(图 4D)。进一步的 GO 和功能富集分析显示,与软骨发育和激素反应相关的基因(作为 FOXO1 靶基因)也在滑膜老化过程中下调(图 4E-F)。这些数据表明 FOXO1 的下调可能是导致老化滑膜出现退化的机制。
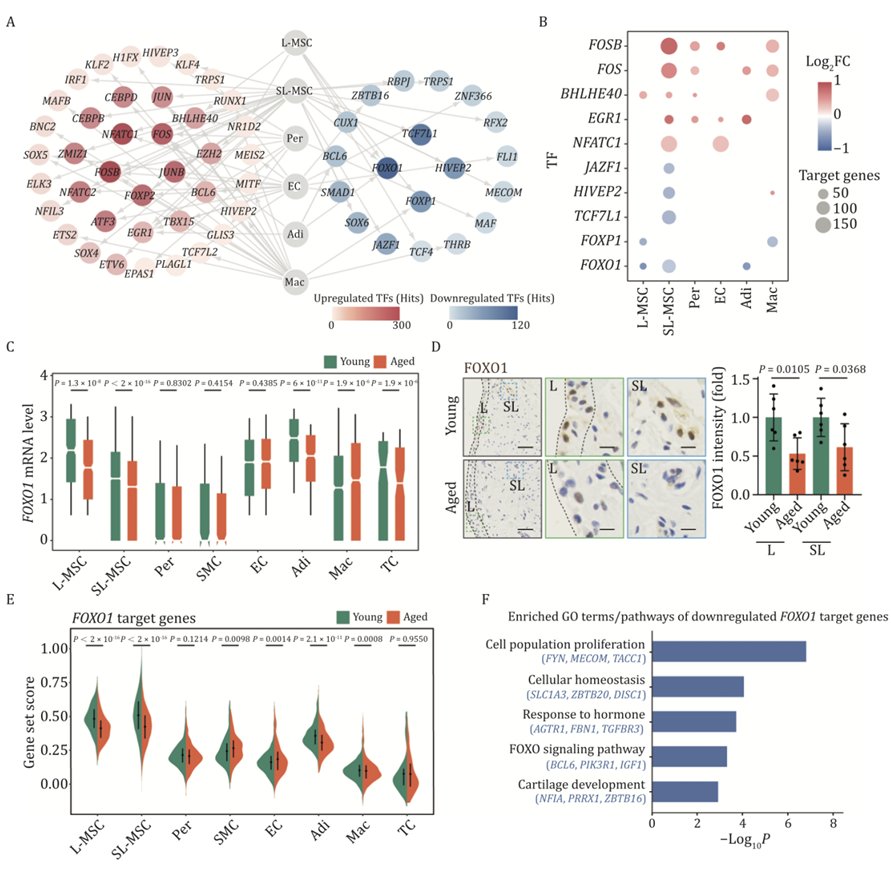
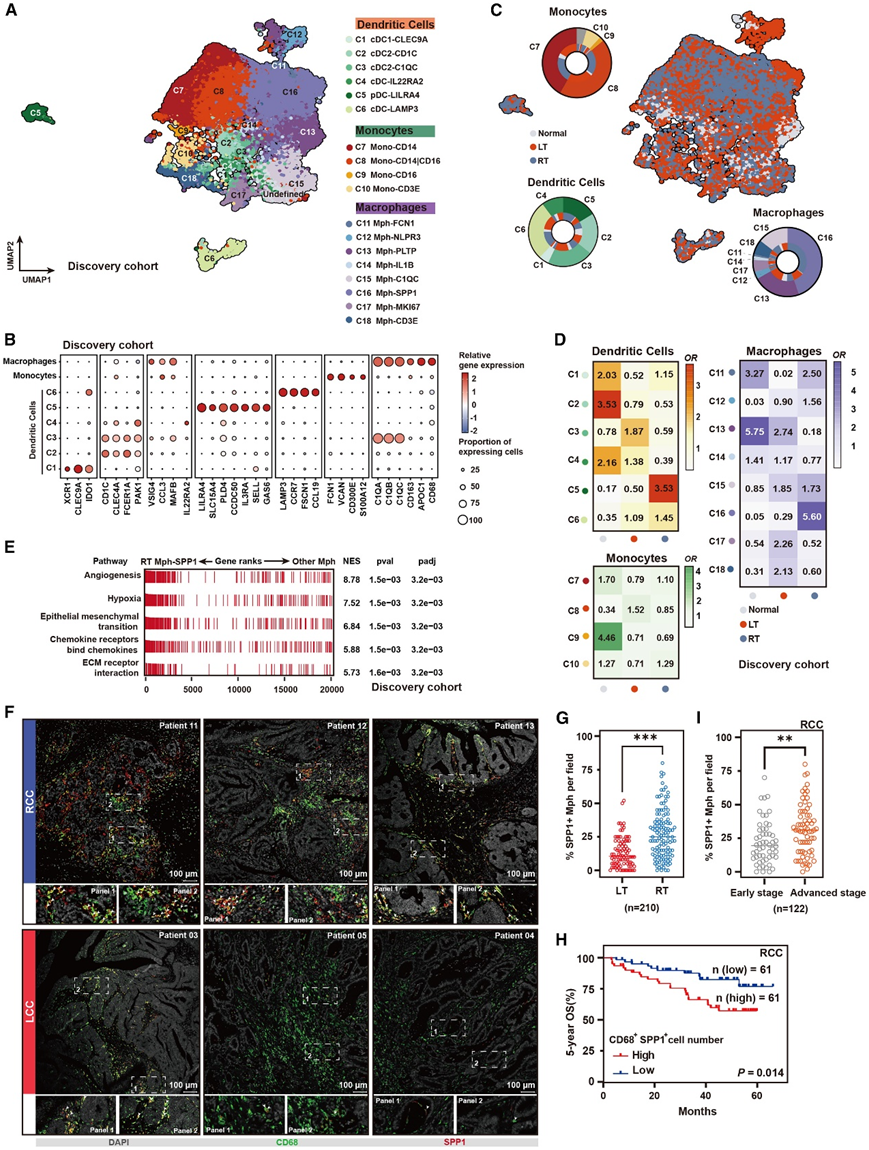
图4. 人类滑膜老化的核心转录调控子分析。
(A) 网络图显示人类滑膜老化过程中所有细胞类型中上调和下调的核心 TF。(B) 点图显示老化过程中不同细胞类型中核心 TF 的分布。 (C) 箱线图显示老化过程中不同细胞类型中FOXO1的表达水平。(D) 年轻和老年人类滑膜组织中 FOXO1 的 IHC 染色。(E) 小提琴图显示 FOXO1 靶标 DEG 在年轻和老年人类滑膜组织每种细胞类型中的基因集得分。(F) GO分析。
05
FOXO1 的消耗加速了 hMSC 中的细胞衰老
FOXO1 在老化的椎间盘和 OA 患者软骨中下调。接下来,他们将FOXO1 +/+和FOXO1–/–人类胚胎干细胞 (hESC) 分化为滑膜细胞样人类间充质基质细胞 (hMSC)。这些 hMSC 显示出 MSC 的典型标志物,并表现出与成纤维细胞样滑膜细胞相关的一组特定基因的表达。从而作为研究滑膜细胞功能和分子调控的细胞模型,他们评估了 FOXO1+ /+ hMSC在早期 (EP) 和晚期传代 (LP) 中的表达。在复制性衰老 hMSC 中,他们观察到 FOXO1 表达降低。接下来,通过免疫印迹分析验证了FOXO1 –/– hMSC中 FOXO1 的消融(图 5A)。FOXO1 – /–hMSC 表现出细胞生长迟缓、克隆扩增能力受损、Ki67 阳性细胞减少以及 S 期细胞百分比下降(图 5B-C)。此外,FOXO1 缺乏会显著升高活性氧 (ROS) 水平(图 5D)并导致 SA-β-半乳糖苷酶阳性细胞增多(图 5E)。接下来,他们检测到一组 SASP 相关基因的表达上调,例如 IL6(图 5F),因此FOXO1 –/– hMSC 中的 IL6 分泌增加(图5G)。同时,他们还观察到细胞衰老的典型指标,包括FOXO1–/– hMSC中P16INK4a表达增加和端粒缩短(图5F-I)。此外,FOXO1缺失导致hMSC中异染色质标记物H3K9me3缺失(图5J)。免疫印迹分析显示,在FOXO1–/–hMSC中,异染色质相关蛋白HP1α和HP1γ的表达降低(图5H)。总之,这些发现表明FOXO1的缺乏促进了hMSC的加速衰老。
与上述观察结果一致,bulk RNA-seq数据表明 FOXO1 缺乏诱导的转录组特征类似于衰老过程中人类滑膜中的转录组变化。L-MSC 或 SL-MSC 中有 103 个衰老 DEG 在 FOXO1 缺乏时也在 hMSC 中发生变化,包括 62 个上调基因和 41 个下调基因(图 5K)。此外,FOXO1 缺乏的 hMSC 和衰老滑膜中上调的 DEG 在血管生成、趋化性和炎症反应通路中富集,而下调的基因在调节细胞投射组织和软骨发育中富集(图 5K-L)。
综上所述,这些数据表明,FOXO1 可能在滑膜细胞中发挥重要作用,保护细胞免于衰老和炎性细胞因子和趋化因子的分泌。
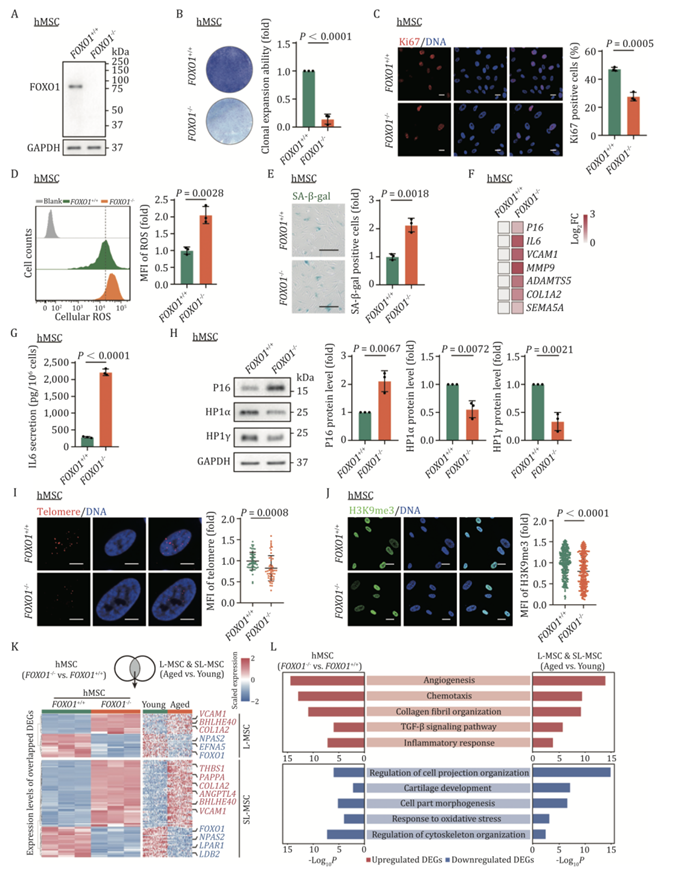
图5. FOXO1的消耗加速了 hMSC 中的细胞衰老。
(A)免疫印迹。(B) 克隆扩增分析。(C) 免疫荧光分析。(D) 流式细胞分析。(E) SA-β-gal 染色。(F) qPCR 分析。 (G) 酶联免疫吸附试验 (ELISA) 分析。(H)免疫印迹分析。(I) DNA-FISH 检测FOXO1+/+和FOXO1 –/– hMSC 中的端粒。(J) 免疫荧光分析。(K) 热图显示 snRNA-seq(L-MSC 和 SL-MSC)与FOXO1–/–和FOXO1+/+hMSC 之间的bulk RNA-seq 之间重叠的 DEG 表达谱。(L) 重叠的上调和下调 DEG 的代表性通路。
+ + + + + + + + + + +
结 论
本项研究生成了年轻和年老个体肩峰下滑膜中滑膜细胞的全面转录组谱。通过描述不同细胞类型及其相关调控网络中与衰老相关的转录组变化,在人类滑膜中确定了两种MSC 亚群,即内层MSC 和下层 MSC,并发现血管生成和纤维化相关基因在老化的 MSC 中上调,而与细胞粘附和软骨发育相关的基因下调。此外,老化滑膜中特定的细胞间通讯反映了与衰老相关的炎症和组织重塑,包括血管增生和组织纤维化。具体而言,确定了FOXO1是滑膜 MSC 中衰老差异表达基因 (DEG) 的主要调控子之一,并验证了其在老化滑膜的MSC 群体中的下调。在源自人类胚胎干细胞的 FOXO1 耗竭的人类 MSC 中,重现了在老年供体的肩峰下滑膜中观察到的衰老表型。这些数据表明 FOXO1 在调节人类滑膜衰老方面发挥着重要作用。
+ + + + +



 English
English


