文献解读|Nat Immunol(27.7):将单细胞 RNA 和 T 细胞/B 细胞受体测序与质谱流式细胞相结合,揭示人类外周免疫细胞从出生到老年的动态轨迹
✦ +
+
论文ID
原名:Integrating single-cell RNA and T cell/B cell receptor sequencing with mass cytometry reveals dynamic trajectories of human peripheral immune cells from birth to old age
译名:将单细胞 RNA 和 T 细胞/B 细胞受体测序与质谱流式细胞相结合,揭示人类外周免疫细胞从出生到老年的动态轨迹
期刊:Nature Immunology
影响因子:27.7
发表时间:2025.01.29
DOI号:10.1038/s41590-024-02059-6
背 景
发育和衰老贯穿人的整个生命过程,同时免疫系统也逐渐成熟,最终不可避免地退化。出生后,免疫系统逐渐成熟,能够更好地抵御外来病原体。相反,免疫衰老会导致感染、心血管疾病和癌症的发病率更高。此外,最近有报道称,衰老的免疫细胞会驱动心脏和肝脏等实体器官的衰老,这可能是系统性衰老的原因。然而,尚不清楚免疫系统在人类衰老过程中何时以及如何发生变化,而人类衰老通常持续近 90 年,涵盖整个生命周期的发育、成熟和衰老。
实验设计
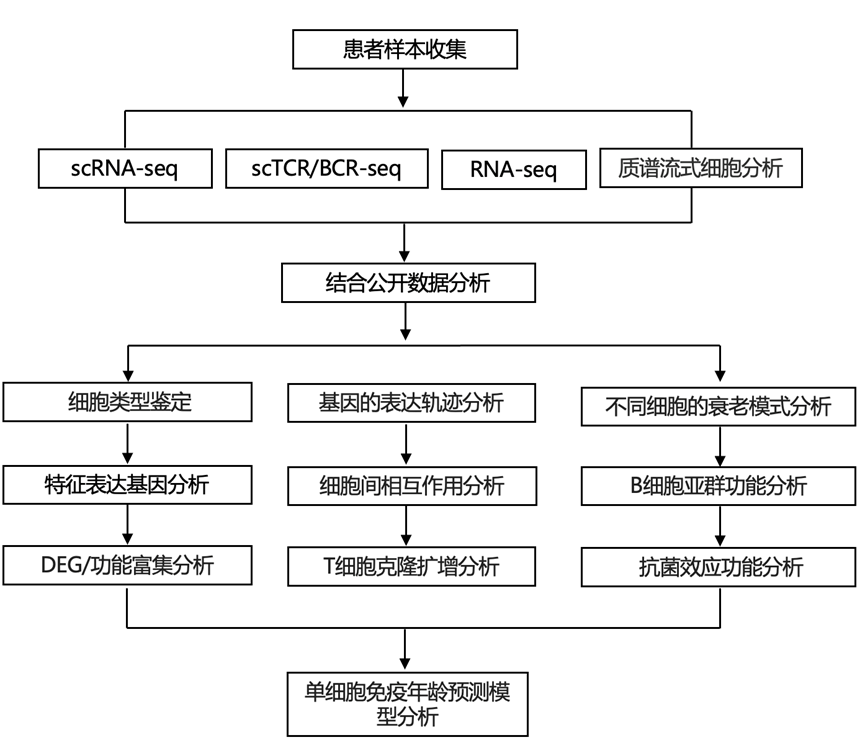
结 果
01
人类生命周期内外周免疫细胞的单细胞图谱
本研究共纳入309名来自内部和外部队列的参与者。为了探究外周免疫细胞组成和功能在人类生命周期中的动态变化,研究团队从上海浦东队列(NCT05206643)中招募了220名年龄在0岁(新生儿)至≥90岁(九十岁以上)的健康志愿者(图1a)。参与者涵盖整个人类生命周期,并分为13个年龄组(0岁、1岁、2岁、6岁、12岁、18岁、30岁、40岁、50岁、60岁、70岁、80岁和90岁以上)。他们进一步基于该生命周期单细胞数据集开发了siAge预测模型,并使用89名额外个体的外部队列验证了siAge模型,其中包括33名健康个体和56名免疫功能紊乱个体。通过单细胞转录组分析(scRNA-seq),共获得538266个细胞。根据无监督聚类和各亚群特征基因的表达情况,识别出25个不同的人外周血单核细胞 (PBMC)亚群,并通过均匀流形近似与投影(UMAP)进行可视化(图1b)。热图、特征图和小提琴图显示了细胞亚群的代表性特征基因和表达水平以及每个亚群检测到的基因数量和唯一分子标识符(UMI)(图1c)。
为了全面了解 PBMC 组成的动态变化,他们分析了 13 个年龄组的每个样本中 25 个细胞亚群在总 PBMC 中的比例。在 25 个细胞亚群中,有 22 个在不同年龄组之间比例存在显著差异(图1d)。某些细胞亚群的比例与年龄呈正相关,例如 CD4_TEM_GNLY 细胞和 CD8_TEM_GNLY 细胞,而其他细胞亚群的比例与年龄呈负相关,例如 CD4_Naive_CCR7 细胞、CD8_Naive_LEF1 细胞、NK_CD56 high细胞和 B_Naive 细胞。一些细胞亚群在某些年龄组中表现出富集。例如,CD14+单核细胞在脐带血组中富集,浆细胞在儿童中富集(在6岁组达到峰值),CD8_MAIT_SLC4A10细胞在青少年中富集(在18岁组达到峰值)。三种细胞亚群[例如自然杀伤(NK)细胞增殖,CD16+单核细胞和浆细胞样树突状细胞]没有表现出与年龄成比例的显著变化,这表明它们在人类寿命期间相对稳定。使用高通量流式细胞分析(CyTOF)在单细胞蛋白水平上进一步研究了细胞组成动态,并显示出良好的一致性。这些结果表明不同PBMC亚群在单细胞分辨率下与年龄的差异相关性。
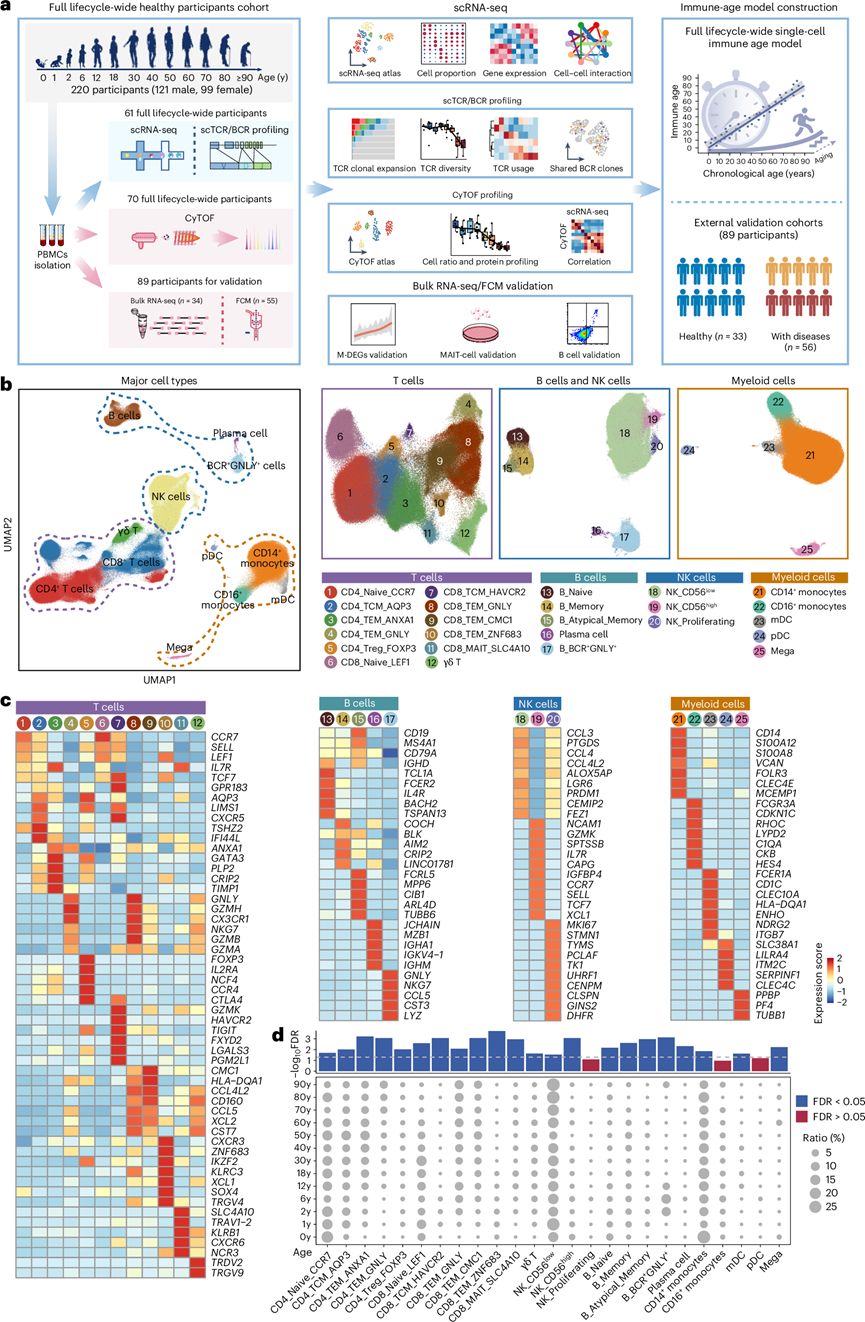
图1. 人类生命周期各个阶段外周免疫细胞的单细胞转录组概览。
(a) 本研究总体实验设计的工作流程。(b) UMAP图显示了从 61 个样本的 PBMC 中鉴定出的外周免疫细胞亚群。(c) 热图显示了每个细胞亚群中特征基因的表达。(d) 点图显示了 13 个年龄组中 25 个免疫细胞亚群比例的年龄相关变化。
02
外周免疫细胞在整个生命周期中的转录动力学
为了系统地研究PBMC亚群在整个生命周期中的转录组动态,他们根据差异表达基因(DEG)的数量对25个PBMC亚群进行了排序(图2a)。DEG数量最高的前10个细胞亚群均属于淋巴系细胞亚群(即T细胞、NK细胞和B细胞类型),这表明这些细胞亚群受年龄的影响最大。在前10个细胞亚群中,有8个是T细胞,并且在不同的T细胞亚群中观察到DEG数量的显著差异(图2a)。没有髓系细胞[即单核细胞、树突状细胞(DC)和巨核细胞]具有≥100个DEG。
为了探索 PBMC 亚群在整个生命周期中的功能动态,他们对 25 个亚群中的 DEG 分别进行了功能富集分析。这些DEG 在多种通路中富集,包括与细胞活化的正向调节(24 个细胞亚群)、淋巴细胞介导的免疫(23 个细胞亚群)、白细胞细胞间粘附的调节(22 个细胞亚群)和 II 型干扰素产生(22 个细胞亚群)相关的通路(图2b)。然后,他们重点关注与只与年龄相关的基因(M-DEG)。与 DEG 分析的结果一致,拥有M-DEG 数量最多的前 10 个细胞亚群是淋巴系细胞亚群,这表明这些淋巴系细胞亚群易受衰老影响。前十名中有八个是 T 细胞亚群,一个是 NK 细胞亚群,一个是 B 细胞亚群。M-DEG 数量最多的前三个细胞亚群是 T 细胞亚群:CD4_Naive_CCR7、CD4_TCM_AQP3 和 CD8_Naive_LEF1 细胞。功能富集分析显示,上调的 M-DEG 富集在促炎生物过程中,例如 II 型干扰素的产生和对 I-κB 激酶/NF-κB 信号的正向调控,而下调的 M-DEG 富集在端粒组织和肌动蛋白丝组织中。
接下来,他们根据 M-DEG 所涉及的细胞亚群数量对其进行排序,并确定多个细胞亚群共有的 M-DEG。大于或等于五个细胞亚群共有的 M-DEG 定义为常见的 M-DEG。分析确定了 18 个上调的常见 M-DEG 和 38 个下调的常见 M-DEG(图2c)。功能富集分析表明,上调的常见 M-DEG 富集在与 I-κB 激酶/NF-κB 信号转导的正调控、细胞间粘附的正调控和主要组织相容性复合体 II 类蛋白复合物组装相关的通路中。下调的常见 M-DEG 富集在与端粒维持、单核细胞分化和肌动蛋白丝组织相关的通路中。除了在整个生命阶段呈现单调变化外,scRNA-seq 定义的年龄相关 DEG 在特定年龄范围内表现出富集。例如,来自 12 种细胞类型的 144 个 DEG 在儿童阶段富集,而来自 18 种细胞类型的 90 个 DEG 在 70-80 岁(老年)阶段富集。
scRNA-seq 定义的常见 M-DEG 代表在不同细胞亚群中广泛表达且与年龄密切相关的基因。接下来,他们试图使用传统的转录组分析(RNA-seq)在 34 名健康个体(0 至 ≥90 岁)的独立队列中验证这些数据,这为整个细胞群提供了平均基因表达谱。他们在 bulk RNA-seq 数据集中的 PBMC中鉴定了 1071 个与年龄相关的基因(图2d)。值得注意的是,在 scRNA-seq 定义的 56 个常见 M-DEG 基因中,有 13 个与 bulk RNA-seq 定义的年龄相关基因有交叉,其中包括 4 个随年龄上调的基因和 9 个随年龄下调的基因(图2e)。这种重叠强调了从涵盖不同细胞亚群的 scRNA-seq 获得的结果与从 bulk RNA-seq 获得的结果之间的高度一致性。在四个上调的常见 M-DEG 中,S100A6、S100A4和LGALS1编码的蛋白质可以促进炎症并驱动肿瘤发生和转移。虽然之前报道称S100A4的表达在百岁老人中显著升高,但其在衰老中的潜在功能作用尚未进行研究。使用体外衰老模型,他们发现S100A4在衰老过程中起着积极的调节作用。在下调的常见 M-DEG 中,SELL、CCR7和TMIGD2编码的蛋白质通过调节免疫和耐受的平衡来维持免疫稳态。使用 CyTOF 在单细胞蛋白水平上进一步验证了与年龄相关的常见 M-DEG SELL (编码 CD62L)(图2f)。这些结果表明,不同细胞亚群共有的与年龄相关的常见 M-DEG 可能代表整个生命周期中的潜在免疫生物标志物。
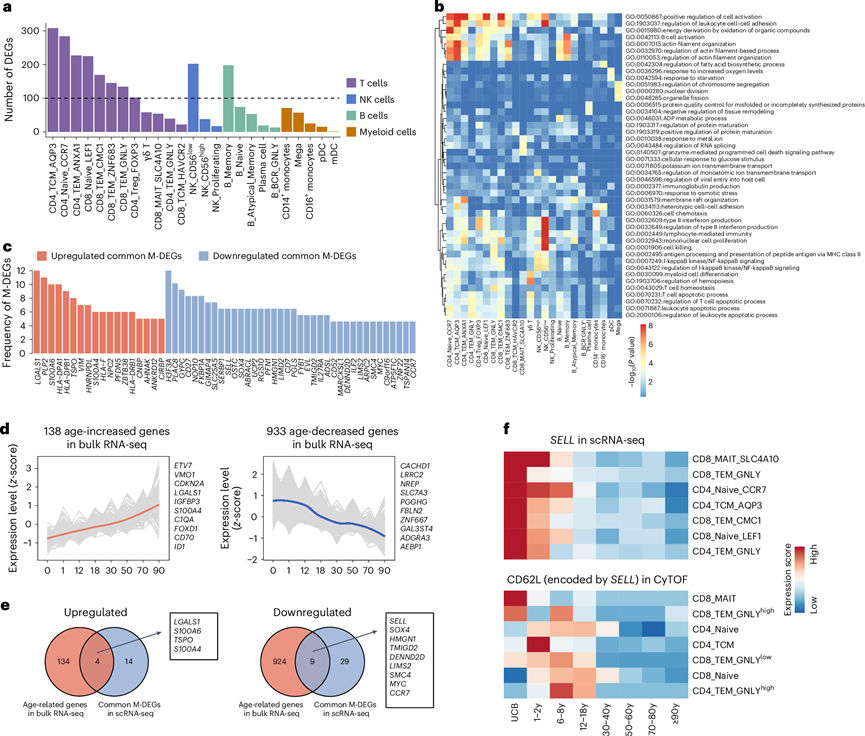
图2. 人类整个生命周期中外周免疫细胞的整体转录组动态。
(a) 条形图显示所有细胞亚群的 scRNA-seq 分析中得出的 DEG 数量。(b) 热图显示所有细胞亚群中 DEG 的功能富集分析。(c) 条形图显示在所有细胞亚群中观察到的 scRNA-seq 分析中得出的上调和下调的M -DEG 的频率。(d) 线图显示通过批量 RNA-seq 分析确定的上调(左图)和下调(右图)的年龄相关基因的表达轨迹。(e) 维恩图显示 scRNA-seq 数据中确定的常见 M-DEG 与批量 RNA-seq 数据中确定的年龄相关基因之间的重叠基因数量。(f) 热图显示了八个生命阶段中 scRNA-seq 中SELL基因在七个细胞亚群中的表达,以及CyTOF 中相应细胞亚群中CD62L 蛋白(由SELL编码)的表达。
03
细胞间相互作用分析
免疫过程涉及各种免疫细胞类型之间的相互作用,以协调它们在免疫反应期间的行为。因此,他们进一步研究了整个生命周期中外周免疫细胞之间的细胞间相互作用(CCI),发现 CCI 在生命周期的不同阶段表现出不同的模式(图3a-f)。拓扑特征表明,免疫检查点在年龄调节的 CCI 网络中比非免疫检查点具有更重要的作用(图3g-j)。整个人类生命周期中免疫检查点的改变主要发生在 T 细胞中,可能在人类发育和衰老过程中发挥重要作用(图3k-l)。
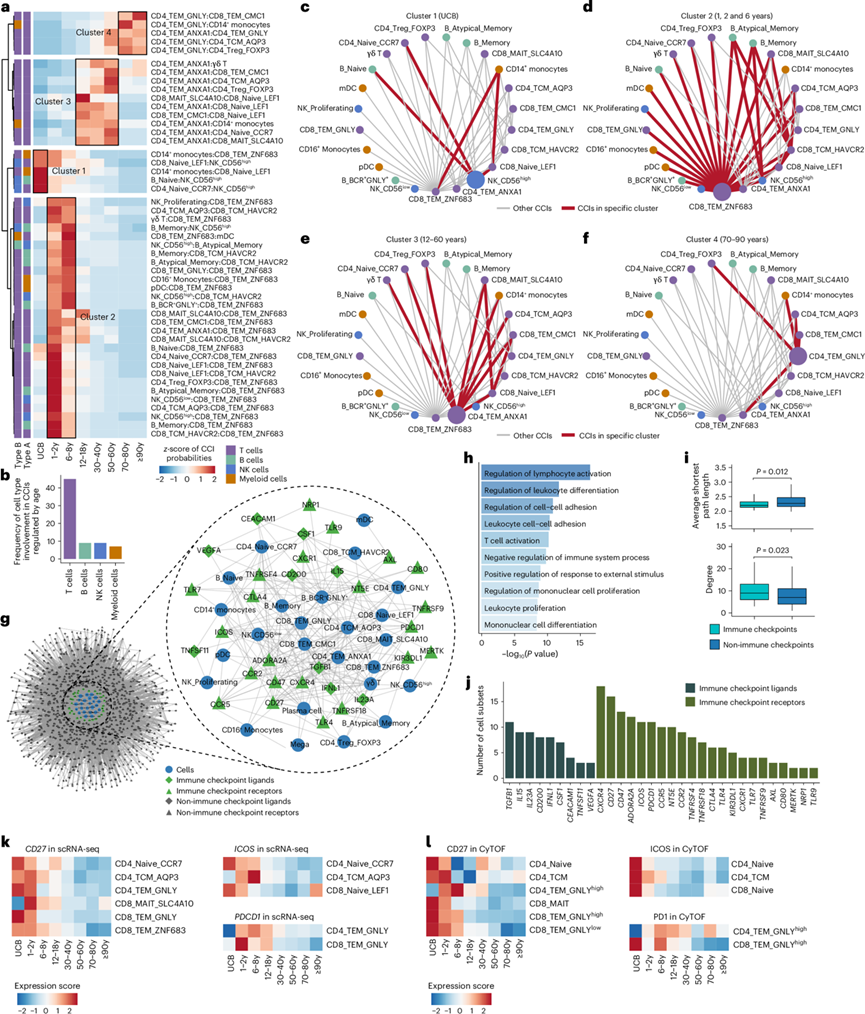
图3. 人类生命周期中外周免疫细胞中的 CCI。
(a) 热图显示 CCI 在整个生命周期中存在显著差异。(b) 条形图显示 T 细胞随着年龄的增长在 CCI 中经历最密集的重塑。(c-f) CCI聚类的网络分析。(g) 网络图显示由差异表达的配体和受体介导的 CCI 网络。(h) GO分析。(i) 箱线图显示免疫检查点和非免疫检查点的平均最短路径长度和程度。(j) 条形图显示每个免疫检查点配体和受体在哪些细胞亚群中检测到差异表达。(k) 热图显示通过 scRNA-seq 检测到的所示细胞亚群中CD27、ICOS和PDCD1基因在整个生命周期内的表达。(l) 热图显示了通过 CyTOF 检测到的所示细胞亚群中 CD27、ICOS 和 PD1 蛋白在整个生命周期内的表达。
04
效应T细胞在整个生命周期中的克隆扩增
他们通过从 scTCR-seq 重建 TCR 序列,进一步探讨了所有 11 个 αβ T 细胞亚群的克隆扩增及其整个生命周期中的 V(D)J 基因表达情况。他们从超过 90% 的所有 αβ T 细胞中获得了匹配的 TCR 和转录组信息。在之前针对成年人口的研究中,仅在老年人中观察到 T 细胞克隆扩增的峰值增加。然而,通过分析本研究队列的儿童和青少年数据,发现高 T 细胞克隆扩增表现出两个峰值,发生在生命早期发育阶段(2-12 岁)和晚年老年阶段(70-90 岁)(图4a)。进一步比较这六个年龄组的 V(D)J 基因表达情况,发现 43 个基因存在差异表达(图4b)。TCR α 链和 β 链中互补决定区 3(CDR3)氨基酸序列的长度分布没有显著差异。使用差异使用的 V(D)J 基因的层次聚类,将六个年龄组聚类为两个不同的组:2-12 岁组[早期高 T 细胞克隆扩增(高 TCE)组]和 70-90 岁组(晚年高 TCE 组)(图4b)。V(D)J 基因的选择性表达反映了不同年龄段 T 细胞反应的不同特征,可能与人体免疫发育或衰老有关。
接下来,他们探究了高TCE细胞在所有11个αβ T细胞亚群中的分布,在不同的T细胞亚群中检测到了不同程度的克隆性扩增:高TCE细胞(克隆大小≥50个细胞)仅出现在3个STARTRAC扩增评分较高的效应记忆T细胞亚群(CD8_TEM_GNLY、CD4_TEM_GNLY和CD8_TEM_CMC1细胞)中(图4c-e)。其中,CD8_TEM_GNLY细胞占高TCE细胞的比例最高(图4c)。
接下来,他们进行了DEG分析,以探索两个高TCE组中CD8_TEM_GNLY细胞克隆扩增的功能特征。在早期高TCE组中,鉴定出635个显著上调的DEG,包括细胞毒性基因(GZMB和PRF1)和能量代谢相关基因(COX5B、COX5A、NDUFAB1、NDUFB10、NDUFS6和NDUFS3)(图4f)。功能富集分析显示,这些DEG在调控T细胞活化、细胞杀伤、调控白细胞增殖和氧化磷酸化途径方面富集(图4g)。在晚年高TCE组中鉴定出87个上调的DEG,包括干扰素相关基因(IFITM3和ISG20)和抗凋亡基因(TSC22D3和IL7R)(图4f)。功能富集分析显示,这些DEG在病毒应答、II型干扰素应答、淋巴细胞凋亡过程的负调控和II型干扰素通路应答中富集(图4g)。据此,他们分析了早期和晚年高TCE组中CD8_TEM_GNLY细胞克隆扩增中细胞毒性、氧化磷酸化、白细胞增殖和II型干扰素相关通路的表达。在早期高TCE组中,细胞毒性、氧化磷酸化和单核细胞增殖的正向调节的表达显著上调,而在晚年高TCE组中,响应II型干扰素途径的基因表达上调(图4h)。因此,老年阶段高TCE CD8_TEM_GNLY细胞中上调的DEG参与了与慢性炎症相关的生物学过程,这与实体器官的衰老有关。相比之下,发育阶段高TCE CD8_TEM_GNLY细胞中细胞毒性基因的较高表达表明这些T细胞可能具有针对感染和癌细胞的强大杀伤功能。此外,转录因子分析表明,转录因子调控子GATA3在早期高 TCE 组中表现出最高活性(图4i),而转录因子调控子ETS1在晚年高 TCE 组中表现出最高活性(图4i)。GATA3调节T细胞的发育、增殖和维持。ETS1通过降低核糖体活性来调节人类健康衰老。因此,虽然两组都表现出CD8_TEM_GNLY细胞的高克隆扩增,但早期和晚年高TCE组之间这些扩增的T细胞的功能有所不同。
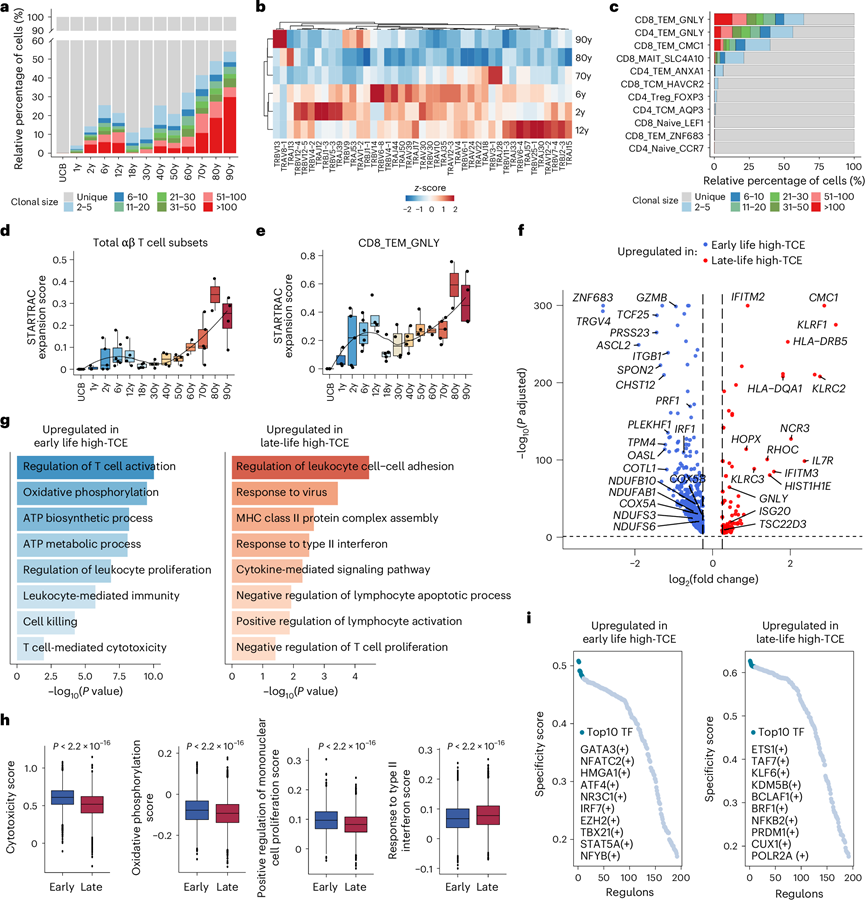
图4. 整个生命周期中 T 细胞的克隆扩增。
(a) 堆积条形图显示 13 个年龄组中 T 细胞克隆大小的分布。(b) 热图显示六个高 TCE 组(2、6、12、70、80和90 岁)中 TCR α 链和 TCR β 链中显著差异表达的 VJ 基因。(c) 条形图显示每个 αβ T 细胞亚群中 T 细胞克隆大小的分布。(d-e) 箱线图显示通过 STARTRAC-expa 指标量化的 13 个年龄组中总 αβ T 细胞亚群和 CD8_TEM_GNLY 细胞的克隆扩增水平。(f) 火山图显示晚年高 TCE 组(70-90 岁)与早期高 TCE 组(2、6 和 12 岁)相比的高 TCE CD8_TEM_GNLY 细胞(克隆大小 ≥ 50 个细胞)中的 DEG 。(g) 条形图显示早期(左图)和晚年(右图)高 TCE CD8_TEM_GNLY 细胞中上调的 DEG 的代表性富集生物学过程。(h) 箱线图显示早期和晚年高 TCE 组高 TCE CD8_TEM_GNLY 细胞中通路的基因模块得分。(i) 使用调节子特异性评分对早期(左图)和晚期(右图)高 TCE 组中高 TCE CD8_TEM_GNLY 细胞中的 TF 调节子进行排序。
05
幼稚 CD4+和 CD8 + T 细胞的衰老模式不同
与年龄相关的免疫功能障碍的一个关键特征是幼稚 T 细胞的缺失。先前依赖成人数据的研究得出结论,CD8+细胞随年龄增长而下降的速度比 CD4 +细胞更明显。然而,使用 scRNA-seq 衍生的细胞分类并覆盖整个寿命,观察到两个幼稚 T 细胞亚群(CD8_Naive_LEF1 和 CD4_Naive_CCR7)都随年龄增长而呈下降趋势(图5a),但它们的衰老轨迹从出生开始就有所不同。具体而言,这两个幼稚 T 细胞亚群在整个人类寿命中遵循不同的下降轨迹:幼稚 CD4 + T 细胞在生命早期发育阶段表现出突然减少,然后在进入成年期后减少得较慢;相反,幼稚 CD8 + T 细胞在生命早期阶段逐渐减少,然后在成年期迅速减少。CyTOF 数据进一步验证了两种幼稚 T 细胞亚群的衰老模式(图5b)。
接下来,他们试图分析两个幼稚 T 细胞亚群的功能动态,并确定了 76 个上调的幼稚 CD4+ T 细胞 M-DEG 和 73 个上调的幼稚 CD8+ T 细胞 M-DEG。幼稚 CD4+ T 细胞的 M-DEG 在生命早期迅速变化,并在生命晚期达到平台期,而幼稚 CD8 + T 细胞的 M-DEG 则在整个生命过程中持续直线增加(图5c-d)。对幼稚 CD4+和幼稚 CD8 + T 细胞中上调的 M-DEG 进行功能富集分析,揭示了两个幼稚 T 细胞亚群与促炎途径相关的几个共同的生物学过程,包括对 II 型干扰素的反应和自噬调节(图5e)。
接下来,他们检测了幼稚CD4+ T细胞和CD8 + T细胞中TCR多样性的动态模式,发现它们的模式也存在差异(图5f-g)。同样,幼稚CD4+ T细胞在生命早期发育阶段的TCR多样性下降比幼稚CD8+ T细胞更为剧烈;相反,幼稚CD8+ T细胞在老年期的TCR多样性下降比幼稚CD4+ T细胞更为显著。这些结果揭示了幼稚CD4+ T细胞和CD8+ T细胞之间不同的衰老相关转录模式和组库动态。
黏膜相关不变T细胞(MAIT)是独特的类先天性T淋巴细胞,连接先天免疫和适应性免疫。MAIT细胞通过TCR依赖性和非TCR非依赖性机制快速产生细胞因子和细胞毒性效应物,以应对多种细菌和病毒,例如结核分枝杆菌和乙型肝炎病毒。他们发现CD8_MAIT_SLC4A10细胞在青少年时期表现出单峰富集模式,在18岁组达到峰值(图5h)。CyTOF分析结果与scRNA-seq结果明显一致(图5i)。克隆分析表明,CD8_MAIT_SLC4A10 细胞的 TCR 多样性特征表达也在青春期达到峰值(图5j),这意味着此阶段的 CD8_MAIT_SLC4A10 细胞可能比其他生命阶段的细胞表现出更强的抵御病原体入侵的能力。
为了表征 CD8_MAIT_SLC4A10 细胞在成熟过程中的功能,他们比较了青少年时期与其他生命时期(包括儿童、成人和老年人)的 CD8_MAIT_SLC4A10 细胞的基因表达谱。鉴定了青少年时期 CD8_MAIT_SLC4A10 细胞中上调和下调的 DEG 的表达;上调的 DEG 的表达在青少年时期达到峰值(称为“上调的 DEG”)(图5k)。相互作用网络分析表明,29 个上调的 DEG 中有 19 个紧密相互作用,其中KLRB1确定为一个关键基因。值得注意的是,CyTOF 分析显示,MAIT 细胞内 CD161 蛋白(由KLRB1编码)的表达也在青少年期达到峰值。
进一步的GO分析显示,青少年时期个体的CD8_MAIT_SLC4A10 细胞中上调的DEG在与有氧呼吸、淋巴细胞增殖和炎症反应的正向调节相关的生物学过程中富集(图5l),而下调的DEG与细胞粘附和凋亡通路有关(图5l)。他们进一步通过基因集富集分析(包含所有表达基因)来描述青少年组CD8_MAIT_SLC4A10 细胞的功能特性。在此阶段,结核病相关信号在CD8_MAIT_SLC4A10 细胞中显示出显著的下调(图5m)。根据世界卫生组织2021年全球结核病报告,年轻人(15-24岁)中结核病的发病率和患病率最低,这与本研究关于这一时期MAIT细胞功能增强的发现一致。此外,抗菌效应功能测定显示,青年人(18岁)MAIT细胞的抗菌活性明显高于中年人(50岁)(图5n)。综合以上结果,提示成熟期CD8_MAIT_SLC4A10细胞可能比其他年龄段的细胞具有更强的抵抗病原体入侵的能力。
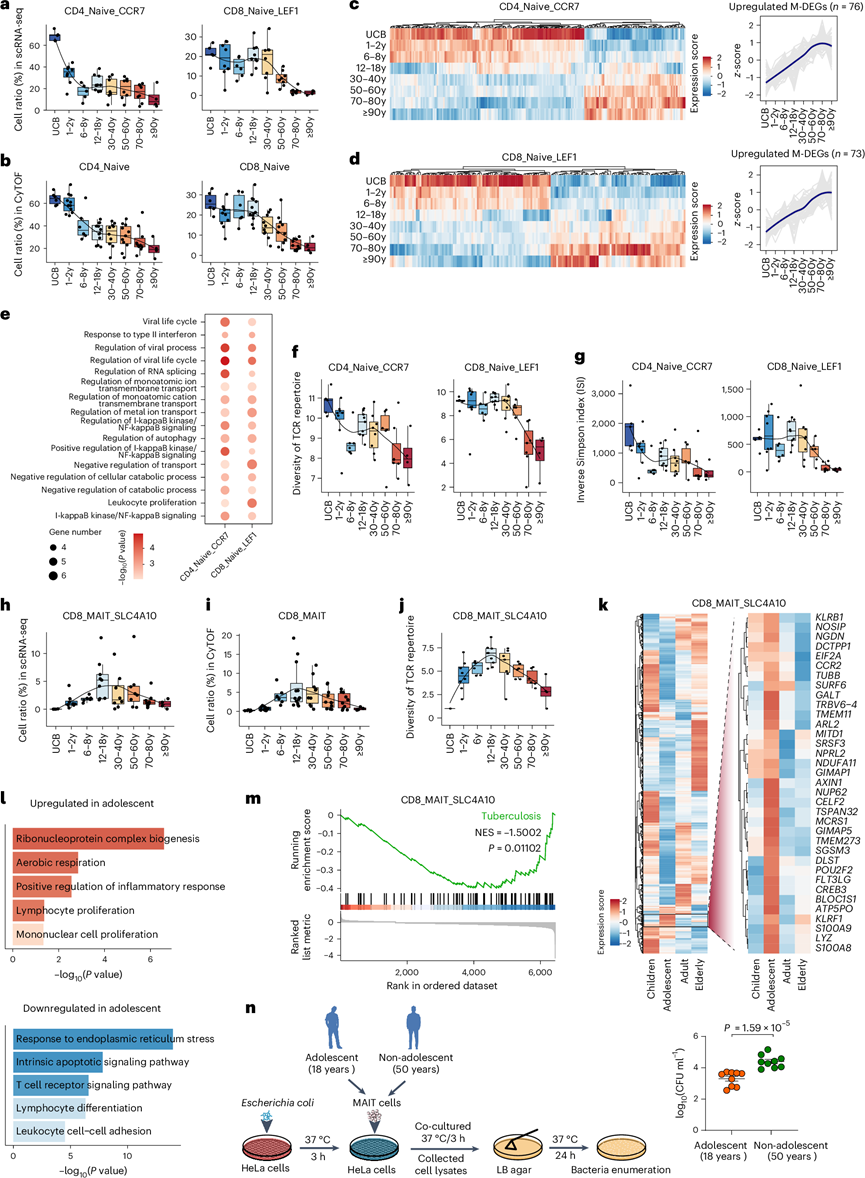
图5. 幼稚 T 细胞和 CD8+ MAIT 细胞的衰老特征。
(a-b) CD4 +(CD4_Naive_CCR7;左)和 CD8 +幼稚 T 细胞(CD8_Naive_LEF1;右)在总 αβ T 细胞中的比例随着年龄的增长而变化。(c-d) 热图显示八个生命阶段中 CD4_Naive_CCR7和 CD8_Naive_LEF1细胞中 M-DEG 的行尺度表达(左),线图显示随年龄上调的 M-DEG 的表达轨迹(右)。(e) 点图显示 CD4 +和 CD8 +幼稚 T 细胞中随年龄上调的 M-DEG 的代表性富集生物学过程。(f-g) TCR 库多样性,以 Shannon 熵和逆辛普森指数衡量。(h-j) CD8_MAIT_SLC4A10 细胞在总 αβ T 细胞中随年龄变化的比例变化,及其以 Shannon 熵衡量的八个生命阶段的 TCR 库多样性。(k) 热图显示青少年(12-18 岁)中 CD8_MAIT_SLC4A10 细胞中所有 DEG 的表达(左)和上调基因的放大(右)。(l)通路分析。(m) GSEA 富集图。(n) MAIT 细胞杀菌能力测定设计的示意图。
06
新发现的细胞毒性B细胞亚群
健康个体外周血中具有细胞毒功能的免疫细胞一般包括NK细胞和细胞毒性T细胞。有趣的是,他们检测到一个新发现的独特B细胞亚群(B_BCR + GNLY +细胞),其同时表达B细胞标志(例如BCR基因,包括免疫球蛋白重链或轻链编码基因和JCHAIN)和经典细胞毒基因(例如GNLY和NKG7)(图1b-c)。在其中几乎检测不到TCR基因、TRAC和KLRF1的表达,排除了这些细胞是T细胞或NK细胞的可能性。由于B_BCR+ GNLY +细胞中检测到的基因和UMI数量低于其他亚群,他们排除了潜在的技术伪影(即多重峰)的可能性,并使用了严格的双峰过滤标准来排除潜在的双峰。B_BCR+ GNLY +细胞呈现单峰模式,在儿童中富集,并在6岁组达到峰值。这些细胞在新生儿和1岁婴儿中含量较低,在2至6岁儿童中含量增加,随后在12岁时逐渐下降,并在成年期达到较低水平(图1d)。
为了探索B_BCR+ GNLY+细胞与其他四个B细胞亚群的功能差异,他们鉴定了所有B细胞亚群的特征基因。B_BCR+ GNLY+细胞的特征基因富集最多的通路是细胞溶解通路(图6a)。利用免疫荧光法在另外6名健康6岁儿童的PBMC中鉴定出双阳性细胞(J链和颗粒溶素、IgM和颗粒溶素或IgA和颗粒溶素)(图6b)。纵向 scRNA-seq 和单细胞T细胞受体/B细胞受体测序(scTCR/BCR-seq)结果显示,这些儿童中 B_BCR+ GNLY +细胞从 1 岁到 2 岁有所扩增(图6c)。他们采用流式细胞技术检测外周血中双阳性细胞(IgM 和颗粒溶素)的百分比。儿童(4-9 岁)的双阳性细胞(IgM 和颗粒溶素)比例明显高于成年人或老年人(图6d)。
细胞毒性T细胞和B细胞在用扩增混合物(包括细胞因子、趋化因子、抗体和佐剂)体外刺激后诱导。因此,从健康个体中分离循环B细胞,并用激活B细胞的扩增混合物刺激。流式细胞分析表明,与用载体培养的B细胞相比,暴露于扩增混合物的培养B细胞中IgM+ GNLY+双阳性B细胞的比例显著增加(图6e)。同时,在B细胞培养上清液中检测到了纳克水平的颗粒溶素(图6f)。此外,为了确定对刺激的反应是否与年龄有关,他们对从三个不同生命阶段(儿童,4-9岁;成人,24-30岁;老年人,64-72岁)分离的PBMC进行了扩增混合物的处理。与本研究的scRNA-seq 结果一致,儿童中 IgM+ GNLY+双阳性 B 细胞的比例明显高于成人组和老年组(图6d)。
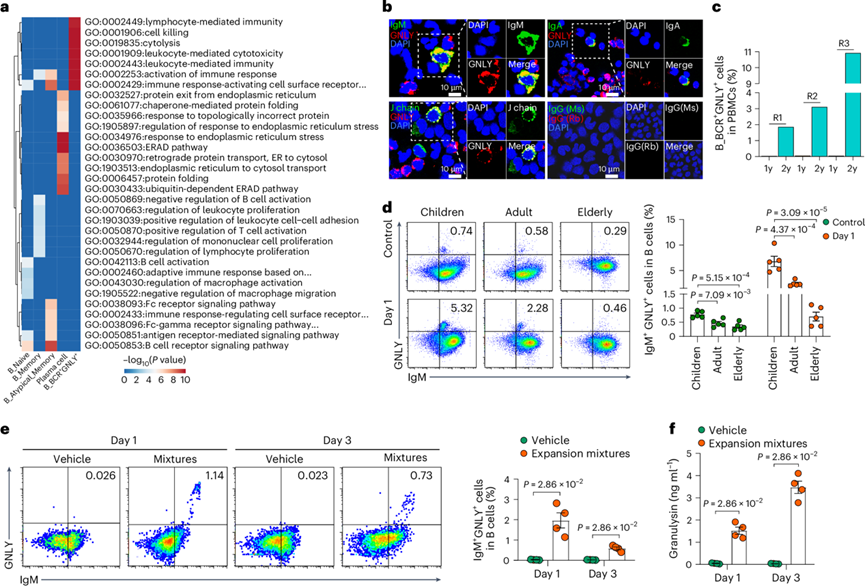
图6. 新发现的细胞毒性B细胞亚群的功能。
(a) 热图显示基于 scRNA-seq 分析的每个 B 细胞亚群中特征基因的功能富集分析。(b)免疫荧光分析。(c) 条形图显示来自三名纵向随访婴儿的 PBMC中 B_BCR+ GNLY +细胞的百分比。(d-e) 流式细胞分析。(f) 条形图显示在有或没有扩增混合物的体外刺激后培养第 1 天和第3 天的 B 细胞培养上清液中的 GNLY 浓度。
07
单细胞免疫年龄预测模型
衰老的免疫系统是导致老年人发病率和死亡率的原因之一 。理解免疫系统变化的一个重大障碍是衰老的精确量化。独特的生命周期单细胞数据提供了构建单细胞免疫年龄时钟模型(即 siAge 评分)的机会,以分析个体的免疫年龄并描述其免疫状态(图7a)。他们首先构建了 25 个仅包含一个细胞亚群数据的模型,并构建了另一个包含所有细胞亚群的模型。整合所有 25 个细胞亚群数据集的预测模型在 26 个预测模型中具有最高的预测得分并实现了最佳性能(图7b-c),并选为最终的 siAge 预测模型。
为了进一步验证siAge预测模型的预测能力,他们使用几个独立的验证队列的scRNA-seq数据测量了预测模型的有效性。在健康验证队列(33人)中,实际年龄(cAge)与siAge之间存在很强的正相关性(图7d),表明siAge预测模型在健康个体中取得了良好的性能。然而,在免疫功能受损的验证队列(56个PBMC样本)中,cAge与siAge之间的相关性变弱(图7e)。患者中 cAge 和 siAge 评分之间相关性的破坏表明本研究的预测模型可能能够反映免疫相关疾病患者免疫稳态的破坏。为了更好地评估 siAge 模型的预测能力,他们定义了一个拟合指数,该指数由 siAge 和 cAge 之间的比率计算得出,并用它来评估健康受试者和免疫功能紊乱患者之间 siAge 和 cAge 的偏差。研究结果强调,由 T 细胞亚群的 21 个关键基因驱动的 siAge 预测模型可作为评估人类生命周期内免疫系统状态和衰老相关变化的潜在标记(图7f-i)。
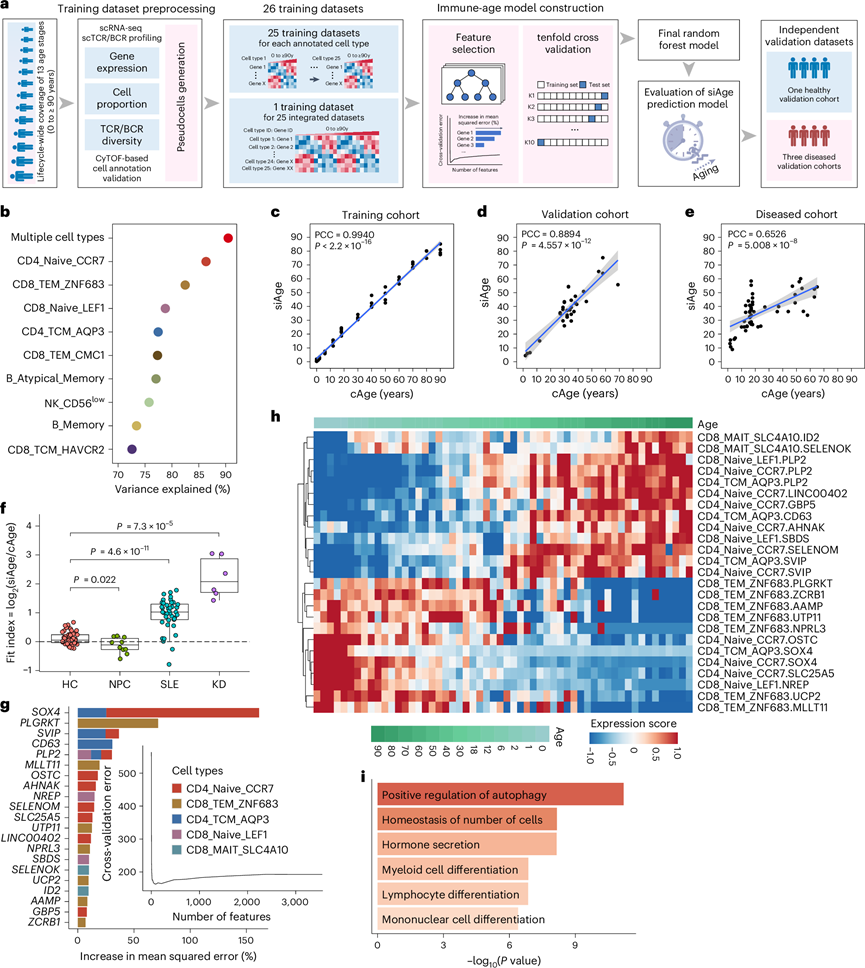
图7. 基于生命周期单细胞数据的单细胞免疫年龄预测模型的构建。
(a) 单细胞免疫年龄预测模型构建的工作流程。(b) 点图显示基于整个生命周期的单细胞数据的细胞类型特定免疫年龄预测模型的预测性能。(c) 散点图显示训练集中单细胞免疫年龄 (siAge) 与实际年龄 (cAge) 的相关性。(d) 散点图显示外部健康验证队列中 siAge 与 cAge 的相关性。(e) 散点图显示免疫功能紊乱的患病患者的外部验证队列中 siAge 与 cAge 的相关性。(f) 箱线图比较了健康验证队列中 siAge 模型计算的拟合指数分布与患病验证队列。(g) 条形图显示随机森林回归确定的前 21 个关键基因。(h) 热图显示相应细胞亚群中跨年龄的前 21 个关键基因的表达。(i) 条形图显示前 21 个关键基因的功能富集。
+ + + + + + + + + + +
结 论
本研究从上海浦东队列(NCT05206643)招募了总共 220 名健康志愿者,涵盖从 0 岁到 90 岁以上的 13 个年龄组,并通过scRNA-seq结合scTCR/BCR-seq、高通量质谱流式细胞技术、RNA-seq和流式细胞技术验证实验分析了他们的外周免疫细胞。发现 T 细胞受年龄的影响最强烈,并且在特定年龄段经历最密集的细胞间相互作用重连。不同的 T 细胞亚群在转录组和免疫组库中表现出不同的衰老模式;例如 GNLY+ CD8 +效应记忆 T 细胞,它在所有 T 细胞亚群中表现出最高的克隆扩增,并在儿童和老年人中表现出不同的功能特征;以及CD8+ MAIT细胞,这些细胞在青少年时期相对丰度、克隆多样性和抗菌能力达到峰值,随后逐渐减少。有趣的是,他们鉴定并通过实验验证了一个此前未认识的“细胞毒性”B细胞亚群,该亚群在儿童中富集。最后,基于生命周期范围内的单细胞数据开发了一个免疫年龄预测模型,该模型可以评估健康个体的免疫状态并识别免疫功能紊乱的个体。
+ + + + +



 English
English


