文献解读|Nat Cell Biol(21.3):前列腺谱系特异性代谢控制管腔分化和对抗雄激素治疗的反应
✦ +
+
论文ID
原名:Prostate lineage-specific metabolism governs luminal differentiation and response to antiandrogen treatment
译名:前列腺谱系特异性代谢控制管腔分化和对抗雄激素治疗的反应
期刊:Nature Cell Biology
影响因子:21.3
发表时间:2023.12.04
DOI号:10.1038/s41556-023-01274-x
背 景
谱系转变是前列腺发育、肿瘤发生和治疗耐药的核心特征。虽然众所周知表观遗传变化会驱动前列腺谱系转变,但尚不清楚上游代谢信号如何促进前列腺上皮特性的调节。
实验设计
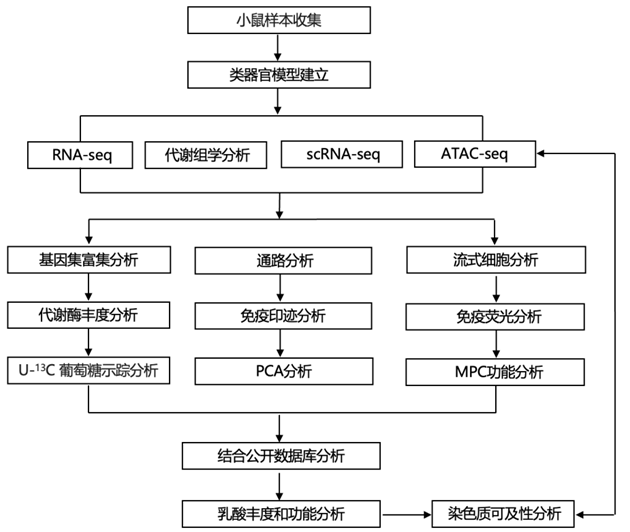
结 果
01
基底细胞和管腔细胞具有不同的代谢特征
研究者团队试图研究前列腺上皮细胞类型和代谢特性之间的关系,他们使用荧光激活细胞分选(FACS)分析成年小鼠前列腺,以分离原代基底细胞(EpCAM+ CD49fhigh)和管腔细胞(EpCAM+CD49flow)。他们首先进行转录组分析(RNA-seq),然后进行代谢组学分析和葡萄糖示踪(图1a)。
他们结合所有 Hallmark、Reactome 和京都基因与基因组百科全书 (KEGG) 代谢基因集进行了基因集富集分析(GSEA),并鉴定了基底细胞中 MYC 靶标通路的富集以及管腔细胞中丙酮酸代谢和氧化磷酸化相关通路的富集(图 1b)。基底细胞表现出几种糖酵解酶和转运蛋白的RNA和蛋白质丰度升高,而管腔细胞表现出许多关键的三羧酸(TCA)循环酶的水平升高(图1c)。
代谢组学分析显示,基底细胞的关键糖酵解代谢物(包括PEP、3PG和F6P)水平升高,而管腔细胞的TCA循环中间体(包括异柠檬酸、aKG和琥珀酸)水平升高。[U-13 C]葡萄糖示踪显示,葡萄糖衍生的碳从柠檬酸盐到乌头酸盐的转化减少,特别是在管腔细胞中。相比于基底细胞,管腔细胞中参与从头脂肪生成的基因的RNA丰度增加(图1f)。
前列腺上皮中的锌积累会抑制乌头酸酶活性,从而防止柠檬酸氧化并促进柠檬酸分泌。他们评估了锌转运蛋白的表达,发现管腔细胞中的几种锌转运蛋白相对于基底细胞有所升高(图1g)。[U- 13C]葡萄糖示踪分析还表明,基底细胞通过丙酮酸脱氢酶活性优先生成M2柠檬酸(图1h),而管腔细胞通过丙酮酸羧化酶活性优先生成M3柠檬酸(图1i),这些数据表明基底细胞和管腔细胞具有不同的代谢物丰度分布和营养利用模式。
接下来他们探究了细胞类型特异性代谢特征是否在物种具有保守性,他们使用了来自三个人类前列腺的良性前列腺基底和管腔上皮细胞群体的 RNA-seq数据集。除HK2外,所有糖酵解酶和转运蛋白均在基底细胞中富集,而许多 TCA 循环酶在管腔细胞中富集(图1j),表明不同的前列腺上皮细胞类型具有独特的代谢特征。
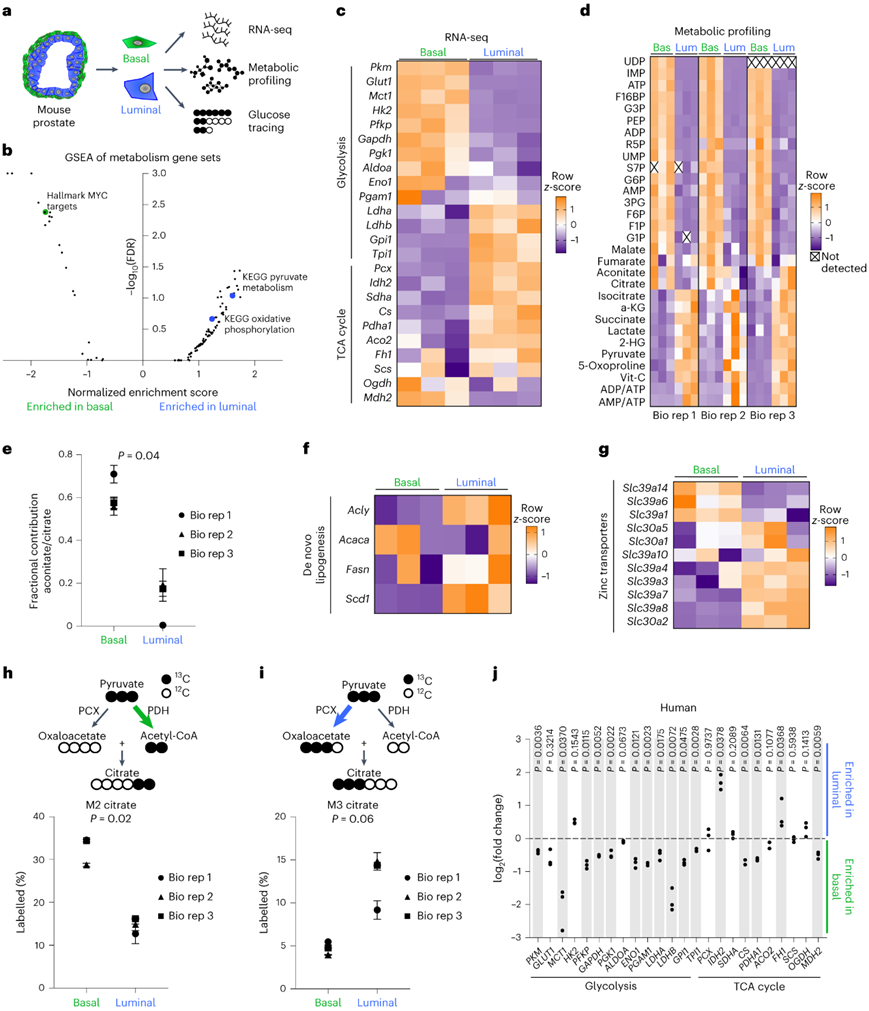
图1. 原代基底细胞和管腔前列腺细胞具有不同的代谢特征。
(a) 对从小鼠前列腺分离的原代基底细胞和管腔细胞进行的RNA-seq、代谢组学分析和葡萄糖追踪的示意图。 (b) 基底细胞和管腔细胞中所有 KEGG、Hallmark 和 Reactome 代谢基因集的 GSEA。 (c) 来自基底细胞和管腔细胞的糖酵解和TCA循环酶的热图。(d) 原代基底细胞和管腔细胞中代谢物丰度的热图。(e) 用[U- 13C]葡萄糖示踪剂喂养16小时的原代基底和管腔细胞中乌头酸盐与柠檬酸盐的分数贡献比。(f-g) 来自原代基底细胞和管腔小鼠前列腺细胞的 RNA-seq 的涉及从头脂肪生成和锌转运的基因热图。 (h-i) 基底细胞和管腔细胞中[U- 13C] 葡萄糖的M2 柠檬酸百分比和 M3 柠檬酸百分比。(j) 来自三个人类前列腺的基底细胞和管腔细胞的RNA-seq的糖酵解和TCA循环酶的差异倍数。
02
丙酮酸氧化增加并伴有管腔分化
他们利用了多能基底细胞在出生后(P)10天发育中的前列腺远端区域(尖端至距远端100 μm)的空间限制(图2a)建立了类器官模型。GSEA显示,相比于基底细胞衍生的管腔细胞,基底细胞中KEGG氧化磷酸化基因发生负富集(图2b)。
免疫印迹分析显示,基底源性类器官表达高水平的基底标记物Trp63(p63),但表达低水平的管腔标记物细胞角蛋白8(KRT8)(图2c-d)。到离体培养的第5天,KRT8升高并且p63降低(图2d),通过流式细胞分析,他们确定 KRT8 逐渐上调。
他们在接种类器官培养物后 3、5 和 7 天进行代谢分析和 [U-13 C] 葡萄糖示踪分析。主成分分析(PCA)表明了每个时间点的独立聚类(图2e)。从第3天到第7天,[U-13C]标记葡萄糖衍生的碳掺入糖酵解代谢物中并没有显著变化(图2f)。相反,随着基底衍生的类器官逐渐具有管腔特征,[U-13C]标记的TCA 循环中间体的比例增加(图2g)。在第5天至第7天,[U-13C]标记的部分核苷酸中间产物和增殖标记物PCNA的表达都有所下降(图2h)。这些结果表明,基底到管腔的分化与代谢重塑有关,其中包括向葡萄糖氧化增加的转变。
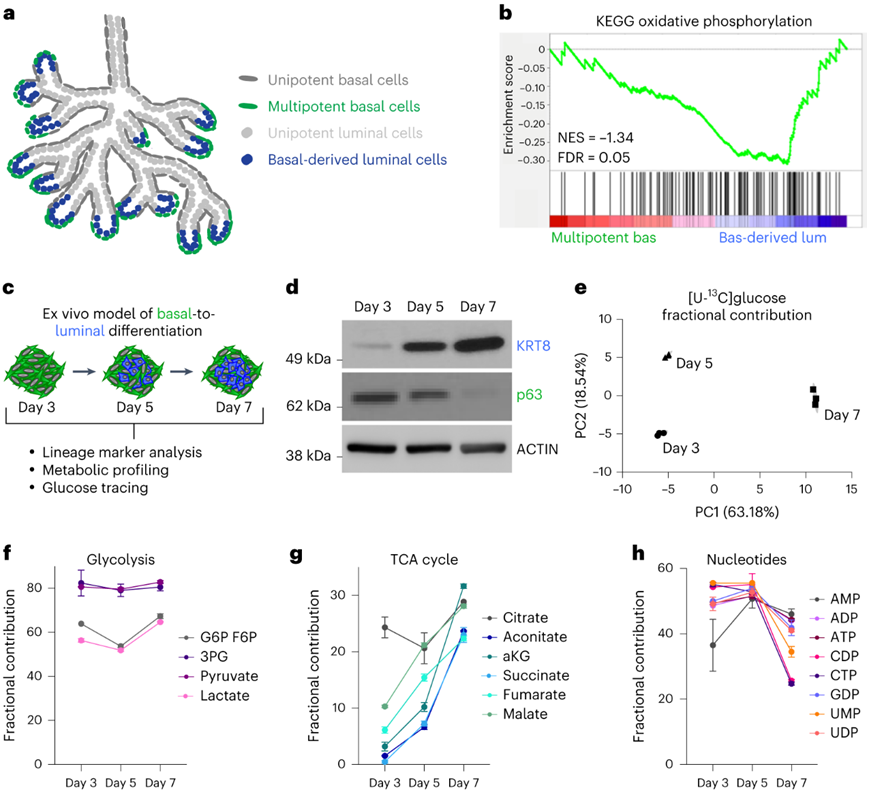
图2. 基底膜到管腔的分化伴随着丙酮酸氧化的增加。
(a) P10-P12小鼠前列腺基底至管腔分化的体内模型示意图。(b) GSEA显示基底源性管腔细胞中的KEGG氧化磷酸化相对于体内多能基底细胞的富集。 (c) 在接种类器官培养物后3、5和7天对原代基底来源的小鼠类器官进行谱系标记分析、代谢组学分析和葡萄糖追踪的示意图。 (d) 免疫印迹分析。 (e)PCA分析。 (f-h)基底源性类器官中糖酵解、TCA和核苷酸中间体的[U-13C]标记比例。
03
线粒体丙酮酸载体(MPC) 调节细胞命运
MPC 将丙酮酸从细胞质运输到线粒体,在那里它可以发生氧化为 TCA 循环提供燃料。由于基底到管腔的分化与丙酮酸氧化增加有关,他们研究了用小分子 MPC 抑制剂 UK5099 抑制 MPC 的效果。[U- 13C]葡萄糖示踪剂分析证实,UK5099 显著减少了小鼠基衍生类器官中葡萄糖源性碳掺入 TCA 循环中间体(图3a)。UK5099不会显著影响基底衍生类器官的类器官形成率(图3b)或类器官大小(图3c)。
免疫印迹分析和免疫荧光表明UK5099处理降低了KRT8的表达并增加了p63的表达(图3d-e)。他们以单细胞分辨率评估了 KRT8 表达,发现 UK5099 处理后 KRT8 下调(图3f-g)。这些数据表明 MPC 抑制是拮抗管腔分化,而不是选择性杀死具有管腔特性的细胞。
[U-13C]葡萄糖示踪剂分析表明,Mpc1敲除(Mpc1-KO)基底衍生的类器官减少了葡萄糖来源的碳与 TCA 循环中间体的结合(图3h)。免疫印迹分析表明, Mpc1-KO 减少了管腔谱系标记(图3i)。RNA-seq和GSEA显示,与对照类器官相比,UK5099处理的类器官和Mpc1-KO处理的类器官(图3j)的管腔特征呈阴性富集,而基底特征呈阳性富集。
为了进一步评估MPC抑制在控制前列腺谱系识别中的作用,他们对基底源性类器官进行了单细胞转录组分析(scRNA-seq)。原代基底衍生类器官中只有1%的细胞是Epcam-Krt8-(图3k)。相比之下,在3D培养中维持1个月的类器官显示出上皮-间质转化的特征,Epcam-Krt8-细胞的百分比增加(图3k)。通过聚类分析和典型谱系标记表达的注释,将细胞分为6种不同的细胞类型(图3l-m)。MPC抑制时,管腔表型细胞群(Krt8+ Krt18+ Krt5 - Trp63 -)的细胞百分比降低,而上皮-间充质转化样细胞群(Epcam- Cdh1 - Vim+)的细胞百分比升高(图3n)。
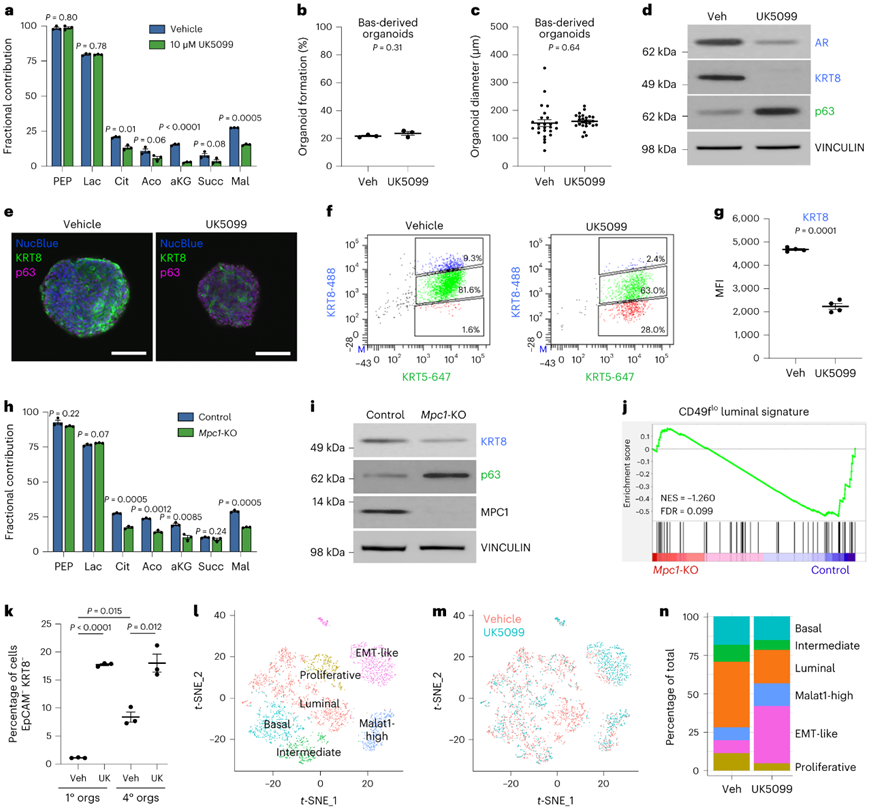
图3. 抑制或敲除 MPC 可阻止基底细胞向管腔细胞的分化。
(a) 铺板后 7 天对载体和 10 μM UK5099 处理的基底衍生类器官进行[U- 13C] 葡萄糖示踪分析。(b-c) 载体和10μM UK5099处理的基底衍生类器官形成百分比和类器官直径。(d)免疫印迹分析。 (e)免疫荧光分析。(f)流式细胞分析。(g) KRT8 平均荧光强度 (MFI) 的量化。(h) 对照和Mpc1 -KO 基底衍生类器官的[U- 13C] 葡萄糖示踪分析。(i) 免疫印迹分析。(j) GSEA分析。 (k) 流式细胞分析的定量。(l-m) t-SNE可视化。(n) 每个聚类中载体和 10 μM UK5099 处理的细胞的百分比进行定量。
04
MPC 是前列腺癌谱系同一性的调节因子
抑癌基因Pten和Rb1缺失在前列腺癌中常见,Pten缺失和联合Pten;Rb1缺失的基因工程小鼠模型再现了前列腺腺癌的关键特征。UK5099处理SKO和DKO类器官会降低管腔标记物KRT8和KRT18的表达(图4a)。RNA-seq分析证实,在UK5099处理的DKO类器官中,经典管腔标记物的表达减少,基底标记物表达增加(图4b)。
接下来,他们研究了前列腺癌患者样本中 MPC 表达与谱系同一性之间的关系。对癌症基因组图谱 (TCGA)中 499 个原发性前列腺癌的 RNA 序列进行相关分析,结果显示MPC1和MPC2 RNA 的丰度水平与管腔标记物KRT8和KRT18的 RNA 丰度呈正相关。此外,他们使用第二军医大学 (SMMU) 数据集计算了管腔特征分数。在两个数据集中,MPC1和MPC2转录本的丰度水平与腔内特征评分呈正相关(图4c-f)。与神经内分泌前列腺癌样本相比,腺癌中的MPC1 RNA 丰度没有显著差异(图4g)。然而,与腺癌肿瘤相比,神经内分泌肿瘤中的MPC2 RNA丰度显著降低(图4h)。与腺癌移植瘤(PDX)模型相比, MPC2在神经内分泌中减少(图4i-j)。
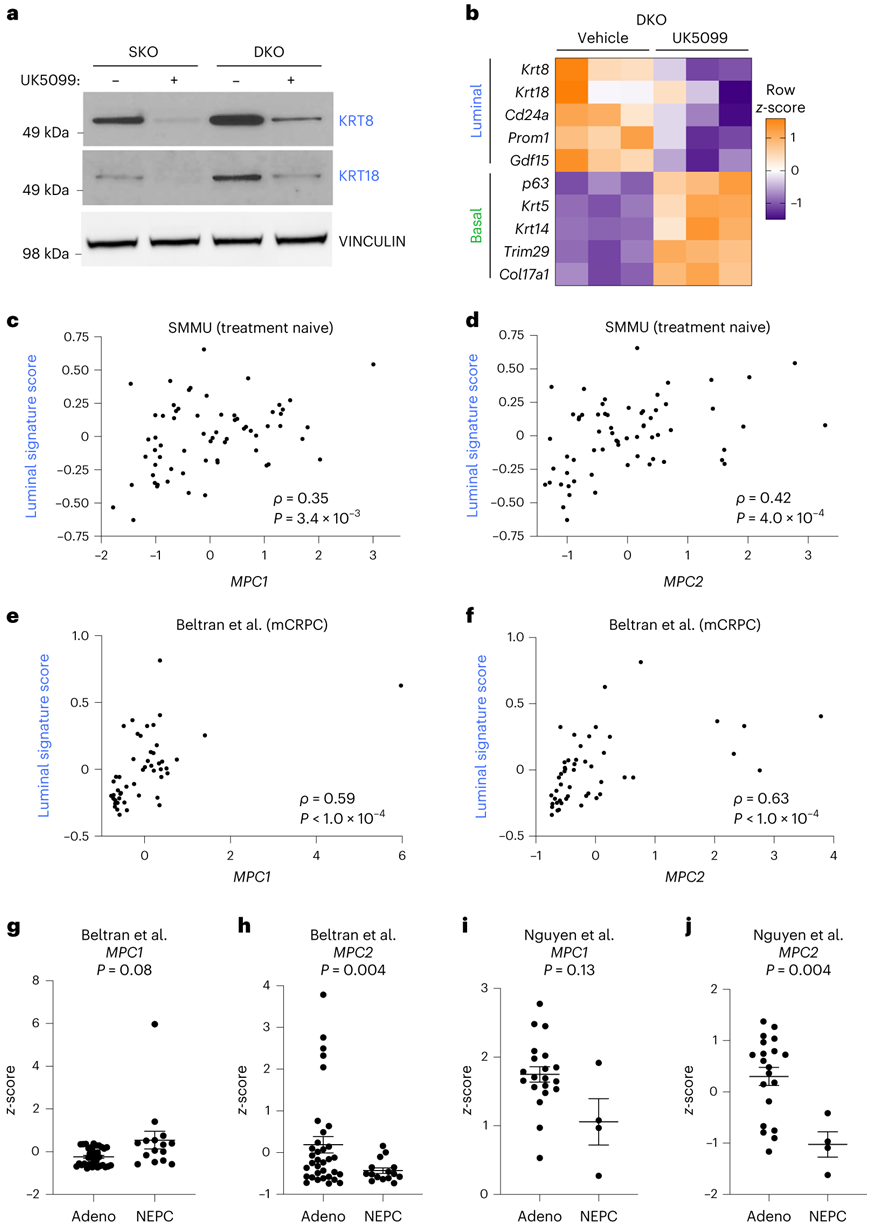
图4. MPC 是前列腺癌中管腔谱系特性的调节因子。
(a)免疫印迹分析。(b) 来自载体和 10 μM UK5099 处理的 DKO 类器官的 RNA-seq 的典型基底和管腔标记的热图。(c-d) 来自 SMMU 数据集的未接受治疗的前列腺癌样本中管腔特征评分与MPC1或MPC2 z评分的相关性分析。 (e-f) 转移性去势抵抗性前列腺癌样本中管腔特征评分与MPC1或MPC2 z评分的相关性分析。 (g-h) 腺癌 (adeno) 或神经内分泌前列腺癌 (NEPC) 样本中MPC1或MPC2的 RNA 丰度。 (i-j) MPC1和MPC的 RNA 丰度。
05
乳酸积累导致染色质重塑
代谢分析显示,细胞外和细胞内乳酸丰度水平均随 UK5099 处理而增加(图5a),补充乳酸会降低KRT8的蛋白质丰度并增加p63的蛋白质丰度(图5b)。他们验证了两种 HDAC 抑制剂曲古抑菌素 A 和丁酸钠的靶效应,并发现 HDAC 活性的抑制会拮抗管腔特征并增强前列腺类器官的基底特征(图5c-d)。
为了确定HDAC抑制和MPC抑制是否对基因表达具有相似的影响,他们对用载体、UK5099、丁酸钠或UK5099和丁酸钠组合处理的原代小鼠前列腺类器官进行RNA-seq。UK5099 影响的基因中有 60% 也受到丁酸钠的影响,并且效应大小非常相似(图5e)。这些结果表明 MPC 抑制和随后的乳酸积累可能通过组蛋白乙酰化的改变来调节谱系特性。
因此,他们使用转座酶染色质可及性测序(ATAC-seq) 对经过 UK5099 或乳酸处理的类器官进行分析,以阐明这些代谢操作如何改变染色质可及性。他们在 UK5099 处理的类器官中鉴定出 1712 个可及性增加的基因和 766 个可及性降低的基因(图5f)。补充乳酸的类器官含有 1147 个高可及性基因和 336 个低可及性基因(图5g)。
他们还在 UK5099 处理和乳酸补充后变得超可及的区域中鉴定了转录因子结合基序(图5h-i)。在40个转录因子基序中,有36个在乳酸补充和UK5099处理后可及性显著增加(图5j)。其中一个基序是p63,它是基底特征的主要调控因子。在UK5099和外源性乳酸处理的类器官中,p63启动子的可及性显著增加(图5k)。
在UK5099处理和外源性补充乳酸的前列腺类器官中,2000个基底细胞富集的基因中有1507个的可及性显著增加(图5l)。总的来说,这些结果表明 MPC 抑制和乳酸补充促进关键谱系特异性转录因子和基因的大规模染色质重塑。
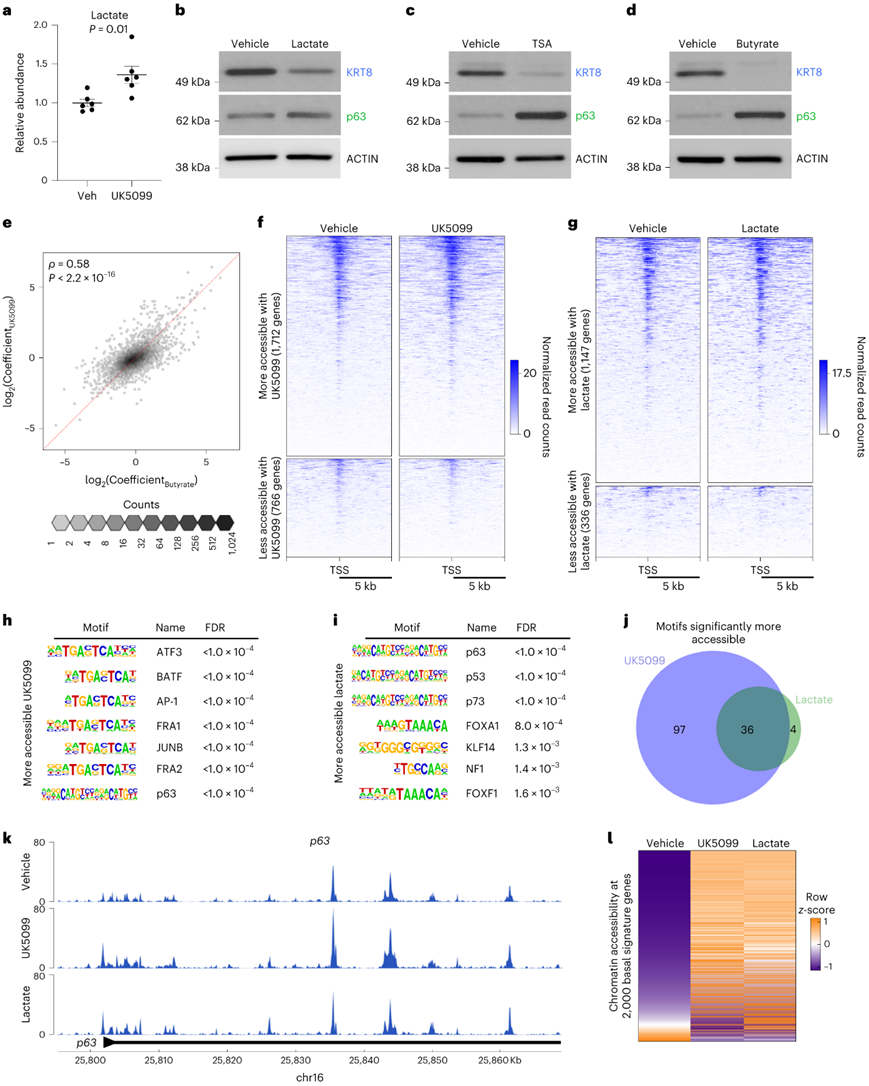
图5. 细胞内乳酸积累导致关键谱系特异性转录因子的大规模染色质重塑。
(a) 用载体或 10 μM UK5099 处理 7 天的原代基底源性小鼠类器官中的细胞外乳酸丰度。 (b-d)免疫印迹分析。 (e) 每个基因的 UK5099 的log 2系数与丁酸盐效应之间的 Spearman 相关性。 (f-g) 小鼠类器官中高可及性基因和低可及性基因的热图。(h-i) 可及性区域中七个最显著富集的转录因子结合基序。(j) 维恩图显示在 UK5099 处理和补充乳酸的类器官中可及的区域中显著富集的转录因子结合基序的重叠。(k) ATAC-seq 峰分析。 (l) 染色质可及性热图。
06
乳酸代谢调节改变抗雄激素反应
鉴于从管腔谱系到具有干细胞样、基底和/或神经内分泌特征的细胞状态的可塑性与雄激素通路抑制剂的耐药性相关,他们接下来评估了MPC表达是否也与治疗反应相关。结合多个公开数据库,与治疗无应答者相比,治疗异常应答者的KRT8和KRT18 RNA丰度增加,这与治疗异常应答者的肿瘤具有管腔特征相符。相比于无应答者,异常应答者表现出MPC1和MPC2的RNA丰度增加(图6a-d)。这些结果表明高MPC RNA丰度与增加的腔内特征和对雄激素途径抑制的更好反应呈正相关。
由于乳酸积累会拮抗管腔谱系特性,他们假设增加乳酸丰度的代谢调控会导致对抗雄激素恩杂鲁胺(enzalutamide)的耐药性增加。他们首先证实 MPC 抑制或乳酸补充不会改变去势抵抗 16D 前列腺癌细胞系的增殖或凋亡。在来自去势抵抗性MDA PCa 203-A PDX模型的类器官(图6e)中,UK5099处理和乳酸补充降低了雄激素受体信号传导,增加了神经内分泌样标志物的表达,并降低了对恩杂鲁胺的敏感性(图6f)。这些结果表明,增加细胞内乳酸丰度可以调节对抗雄激素的反应。
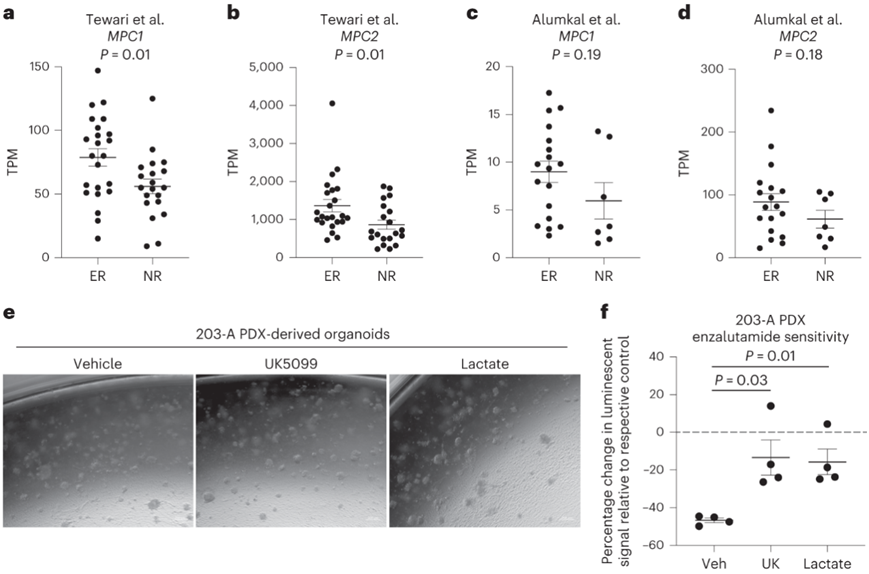
图6. 乳酸代谢的调节改变了前列腺癌的抗雄激素反应。
(a- d) MPC1或MPC2 的 mRNA 丰度。 (e-f) 用载体、10 μM UK5099 或 20 mM 乳酸钠处理 7 天的 MDA PCa 203-A PDX 衍生类器官的代表性相差图像和量化。
+ + + + + + + + + + +
结 论
本项研究发现前列腺的基底细胞和管腔细胞表现出不同的代谢调控和营养利用模式。此外,基底到管腔的分化伴随着丙酮酸氧化的增加。抑制线粒体丙酮酸载体或补充外源乳酸会导致大规模染色质重塑,影响谱系特异性转录因子和抗雄激素治疗的反应。这些结果证明了代谢和前列腺上皮谱系特性的相互调节。
+ + + + +



 English
English


